[编者按] 疾病的正确诊断和合理治疗是患者和医务工作者共同的心愿。在广东省人民医院肿瘤中心,吴一龙教授指导临床医生应用循证医学理论进行肿瘤的多学科综合治疗,开展临床病例讨论。讨论会上各学科共同围绕一个病例或一个病种进行会诊,临床、病理、B超、放射影像等资料齐全,除相关科室提前准备的中心性发言外,到会人员各抒己见,气氛热烈。参会人员受益匪浅,提高了对疑难病例的诊治水平。为了将他们的诊治经验传播出去,让更多的临床医生获益,我刊开辟“循证病例讨论”栏目,希望广大医务工作者关注此栏目。
患者曾× × , 女, 58岁, 2016-07-25因“ 左下腹痛伴便血2个月” 入住我院普外科, 经肠镜、增强CT和PET检查诊断为乙状结肠癌合并周围系膜内淋巴结转移和肝脏多发转移。2016-08-02行乙状结肠切除术+肠粘连松解术, 术后病理:(乙状结肠)中分化腺癌, 肿瘤最大径约3.8 cm; 未见明确脉管癌栓及神经束膜侵犯; 肿瘤浸润肠壁全层至浆膜下脂肪组织; 两端外科切缘未见癌灶; 肠壁肠系膜淋巴结未见癌转移灶(0/13); pT3N0M1 Ⅳ 期(肝转移), KRAS、NRAS、BRAF野生型。综合患者病情予以化疗+靶向治疗, 2016-08-26至2016-10-25予西妥昔单抗靶向治疗(5周期)+FOLFOX化疗4个周期, 化疗后白细胞2度减少, 予升白细胞治疗后好转。复查CT肝转移灶明显缩小, 疗效评价为部分缓解, 2016-11-23行经腹腔镜肝右叶切除术, 术后病理:(右半肝+胆囊)结合病史、镜下形态及免疫组化结果, 符合转移性腺癌, 下消化道来源。肿瘤最大径约2.0 cm; 未见明确脉管癌栓及神经束膜侵犯; 肿瘤侵犯被膜但未见穿透; 非肿瘤肝组织未见特殊病理性改变; 胆囊未见癌病灶。术后复查PET未见转移征像。2017-01-05至2017-04-26予第5至12周期FOLFOX方案化疗, 2017-01-04至2017-05-17予西妥昔单抗第6至13周期靶向治疗, 8周期复查CT病情稳定, 血小板、白细胞2度减少, 对症治疗后改善, 12周期复查PET未见肿瘤转移和复发征像, 2017-06-01至2017-07-22行4周期西妥昔单抗+5-氟尿嘧啶单药维持治疗, 复查PET评价为病情稳定, 2017-08-09至2018-02-23予12周期西妥昔单抗单药维持治疗, 过程顺利, 出现有2度皮疹, 予以对症处理后好转, 4周期和8周期复查增强CT疗效评价为病情稳定, 现到时间收入院。
既往有原发性高血压和糖尿病病史2年, 规则治疗病情控制可。
体格检查:T 36.0 ℃, P 81次/分, R 20次/分, BP 128 mmHg /81 mmHg, Wt:71 kg, H:163 cm, 体表面积1.69 m2, PS评分0分。腹部外形正常, 可见手术疤痕。腹软, 全腹无压痛, 全腹无反跳痛, 未触及包块, 无液波震颤, 肋下未触及肝脏、脾脏和胆囊, Murphy征阴性, 麦氏征阴性, 双侧输尿管无压痛。移动性浊音阴性, 双侧肾区无叩痛, 膀胱无叩痛。肠鸣音4次/分, 无气过水声。
辅助检查:
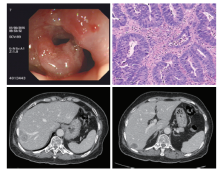
2016-08-19行肠镜检查:距肛门18 cm乙状结肠处见一个环腔浸润性生长肿物, 致肠腔稍狭窄, 镜端尚能通过, 肿物表面黏膜充血水肿伴糜烂, 质脆, 易出血, 诊断:①乙状结肠癌, ②大肠多发息肉(已电切及钳除), ③痔疮。病理诊断:①(升结肠)管状腺瘤, ②(降结肠)大肠黏膜呈慢性炎症伴淋巴组织轻度增生, ③(乙状结肠)中分化腺癌, ④(直肠)管状腺瘤。
2016-07-28增强CT:乙状结肠的肠曲处可见肠壁增厚, 肠腔稍狭窄, 增强后肠壁不均匀强化。周围脂肪间隙内可见多发小结节。肝右叶S7/8段及S6段见类圆形密度减低影, 边缘欠清楚, 其内密度欠均匀, 较大者位于肝右叶S7/8段, 直径约22 mm× 26 mm(6-414), 增强呈边缘轻度环状强化, 似呈多病变融合, 并似见分隔。右叶亦见一小类圆形囊性密度影, 未见明显强化。门静脉主干及左右支, 下腔静脉, 肝静脉未见明显异常。 诊断:乙状结肠癌可能性大, 合并周围系膜内淋巴结转移及肝多发转移。患者初诊时的肠镜、病理和肝转移CT图像见图1。
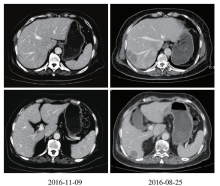
2016-11-09增强CT:肝右叶S7/8段见类圆形密度减低影, 边缘欠清楚, 其内密度欠均匀, 增强呈边缘环状强化, 大小约16 mm × 12 mm、7 mm× 5 mm, 门静脉主干及左右支、下腔静脉和肝静脉未见异常。 乙状结肠区可见条索状极高密度影, 呈术后改变, 周围脂肪间隙稍浑浊。诊断:乙状结肠癌术后改变, 术区未见明确肿瘤复发征象。 肝转移灶与前比较明显缩小, 疗效评价为部分缓解。 4周期靶向治疗+化疗前后CT检查图像见图2。
赖晓嵘(肿瘤内科副主任医师):汇报病史特点(略), 提出讨论要点:(1)晚期结直肠癌的治疗策略, (2)原发灶和转移灶的顺序, (3)围手术期化疗方案和靶向药物的选择依据, (4)肝转移切除方式的考虑因素, (5)肝转移切除术后辅助化疗和维持治疗的方案。
该患者为晚期结肠癌伴肝转移, 对这类患者的治疗策略是怎样的?如果行手术切除, 原发灶和转移灶的切除顺序有哪些考量因素?请外科医生给我们介绍一下。
吴德庆(胃肠外科主治医师):这个患者到我科就诊时有腹痛、血便病状, 结合肠镜、增强CT等影像学检查提示结肠肿物巨大, 导致肠腔狭窄伴出血, 因此, 就直接做了一个原发灶的切除, 考虑术后进行化疗, 然后择期做肝转移灶的切除。若晚期结肠癌伴肝转移患者没有这些伴发症状, 可以考虑先进行新辅助化疗再做原发灶、转移灶的同期或分期切除。
周雨(肝胆外科医师):随着肝切除手术技术和围手术期管理水平的提高, 越来越多的患者可以进行原发灶和转移灶的同期切除。Meta分析显示手术的顺序对患者的生存情况没有显著影响, 包括同期切除结直肠病灶和肝转移灶, 或者先切除肝转移灶再切除原发灶, 再或者先切除原发灶再切除肝转移灶。如果这个患者在初次乙状结肠癌手术时考虑右半肝本身的手术难度, 出血风险大, 我们会诊时可能也不建议同期切除。但回过头来想如果患者先进行新辅助化疗, 评价为肝转移灶的生物学行为良好, 肿瘤明显缩小, 原发病灶和肝转移病灶的同期切除也是有可能的, 这样可以减少患者的手术住院时间、费用以及二次切除的麻醉风险和等待手术的时间。
旁述:2016年NCCN指南指出, 考虑结肠切除时的危急因素包括梗阻和大出血, 解除梗阻可以采用结肠切除, 短路手术、造瘘术或支架置入的方法。
2016年NCCN指南中将晚期结直肠癌分为可切除和不可切除两类, 其中可切除的结直肠癌可以同期或分期结肠病灶和肝肺转移灶的切除或局部治疗, 或者新辅助治疗后进行同期或分期结肠病灶和转移病灶的切除, 也可以结肠癌切除后进行联合化疗再分期切除转移灶。对那些高复发风险、CRS评分超过3分、同期肝转移的患者建议进行新辅助化疗。
陈晓明(介入科主任医师):这类患者围手术期的化疗方案和靶向药物的选择有哪些?
马冬(肿瘤内科主任医师):患者为同时性肝转移, 肝转移灶数目大于1, 有高危复发风险, 肝转移瘤切除术前考虑行术前化疗, 以期尽可能缩小肿瘤病灶、保留肝组织。加用靶向药物可以提高手术切除率和R0切除率, 并且多项大型Ⅲ 期晚期结直肠癌的临床研究也已证实联合使用靶向药物可以明显延长患者的生存时间, 有生存获益。因此, 对这个患者我们采用了FOLFOX联合西妥昔单抗靶向治疗的治疗方案, 以期达到短期内使肝转移瘤缩小、尽可能保留肝实质的目的。
曹小龙(肿瘤内科主任医师):多项大型Ⅲ 期临床研究一致证实, 使用抗EGFR治疗左半结直肠癌患者的总生存是获益的(延长生存时间6.7~10个月) 。补充一下左半RAS野生型患者一线首选抗EGFR(西妥昔单抗)的考虑, 较联合抗血管内皮生长因子的靶向治疗可更大程度和更快地退缩肿瘤, 与更高的反应率和R0切除率相关, 因此, 化疗联合抗EGFR治疗可以创造更多的R0手术切除机会。另外, 临床上使用贝伐单抗时, 手术前必须停用6~8周, 术后也要停用6~8周, 对手术时间的限制制约了抗血管内皮生长因子在临床实践中的应用。基于这个患者是左边结肠癌, RAS全野生型, 选用FOLFOX联合西妥昔单抗是恰当的, 4个疗程达到部分缓解进一步证实了化疗的有效性和肝转移灶良好的生物学特性。
旁述:2016年ESMO 指南对于预后很差的技术上“ 可切除” 转移性结直肠癌, 术前新辅助治疗推荐化疗联合靶向药物, 除了选择EPOC研究中的FOLFOX方案以外, 也可以考虑更加强烈的方案, 比如两药细胞毒化疗联合靶向药物, 或FOLFOXIRI三药化疗单独或联合贝伐单抗, 对于这个推荐方案, ESMO专家组给出的证据级别为Ⅴ 级, 属于最低等级的“ 未设对照的研究、病例报告或专家观点” , 但专家组对此的共识度却是最高级别的(> 75%); 对于技术上可切除且选择围手术期治疗的适应证是一般预后特征的患者, 不推荐使用靶向制剂[Ⅱ , R]; NCCN指南对初始可切除的转移性结直肠癌的靶向治疗的推荐有一个演变过程:2009-2016年 NCCN指南对于晚期结直肠癌中初始可切除转移性结直肠癌的术前新辅助治疗推荐均维持在相同的状态:两药化疗± 贝伐单抗, FOLFOX/FOLFIRI± 西妥昔单抗(KRAS/RAS野生型)。2017年的指南中, 初始可切除转移性结直肠癌的术前新辅助治疗删除了分子靶向药物的推荐方案!
基于EPOC的结果在初始可切除转移性结直肠癌的新辅助治疗中进行了联合靶向治疗的探索。在EGFR靶向治疗领域, 目前唯一的前瞻性Ⅲ 期随机对照临床研究就是NEW EPOC研究:术前3个月的FOLFOX+西妥昔单抗对比FOLFOX新辅助化疗, 然后手术, 术后再继续3个月与术前治疗相同的化疗, 研究期待西妥昔单抗能进一步提高疗效, 然而, 事与愿违, 西妥昔单抗组没带来生存获益, 当研究观察到比预期要少一半的终点事件发生时, 西妥昔单抗组的无进展生存期已经呈现出显著缩短(14.8个月vs. 24.2个月, 风险比=1.50, 95%可信区间1.00~2.25, P< 0.048)(Primrose等, Lancet Oncol 2014), 因此, NCCN指南在2015年起就在相关部分增加了一条警示说明, “ 对于在潜在可切除的患者中使用FOLFOX+西妥昔单抗的研究结果仍有争议” 。这是西妥昔单抗在初始可切除转移性结直肠癌中唯一、阴性研究结果, 原因分析可能与以下因素有关:试验设计不对称, 相当部分患者因毒副作用而将化疗药物减量。
赖晓嵘:患者4周期化疗+靶向治疗后疗效评价为部分缓解, 应肝转移灶手术切除, 鉴于患者右肝转移灶非常分散, 肝转移瘤的切除方式是采取非解剖性切除还是联合消融手术?
周雨:已知肝转移切除对患者总生存有获益, 这个患者肝切除术后复发风险的评估、化疗的良好反应和本身的肿瘤特点(RAS全野生型、原发灶切除后病理未发现淋巴结转移, 肝转移灶数目不超过3个)的综合考虑预示了肝转移灶切除术后患者长期生存的良好愿景。肝转移瘤手术方式有解剖性切除和非解剖性切除。对于结直肠癌患者选择解剖性切除或非解剖性切除一直有争议。既往认为非解剖性切除有助于保留更多的肝实质, 对术后复发的患者再次切除有益, 可改善预后。解剖性肝切除对于减少术后局部复发有利, 但2017年《Ann Surg》上一篇文章又提出, 对KRAS突变的肠癌肝转移进行解剖性肝切除患者获益明显, 可延长肝内和总的无病生存期。这个患者考虑到S6/7段切除的难度和出血风险, 术前预测左肝的体积足够, 因此行右肝全部切除。目前有染色技术(如ICG荧光)可以标记区分正常肝段和肿物, 可以术中更精准地切除肝转移瘤。另外, 我们术前也评估了这个患者肝转移瘤射频消融的可能性, 目前介入治疗也是肝转移瘤达到无疾病征像的重要手段之一, 有比较肝转移瘤手术切除和消融手术的Meta分析显示, 手术切除比消融局部治疗在总生存、无病生存上有显著差异, 二者的风险比分别是2.35和1.66, 但介入治疗的并发症要少一些。鉴于患者右肝转移瘤的特殊部位还是选择做手术切除。
陈晓明:肝转移瘤的介入治疗包括射频消融术、微波消融术和化疗栓塞术, 至于采取何种治疗手段和介入时机要考虑转移瘤的部位、大小、邻近器官情况和治疗目的。这个患者肝S7段转移瘤邻近腹壁, 消融手术风险较大, 选择手术治疗是明智的。
钟文昭(肺科主任医师):肝段切除和肺段切除有相似之处, 都是以血流为解剖基础。肺癌的手术切除模式也经历了局部切除到肺叶切除, 了解肺癌的生物学行为后开始亚肺叶切除。KRAS突变可以理解为肿瘤的生物学行为更有浸润性和侵袭性, 预后更差, 因此, 这部分患者进行解剖性切除对减少肝内无病生存和总无病生存从理论上可以理解。如果2017年《Ann Surg》上那篇文章对肝转移瘤的位置、数目、大小等因素进行进一步的分层分析, 可能可以了解解剖性切除的适应证。
马冬:该患者右肝切除后残留左肝体积小, 是否需要行门静脉结扎后分期切除。另外, 患者是RAS全野生型, 使用西妥昔单抗靶向治疗是为了保存更多的肝组织, 是否还需要右肝切除值得商榷。
赖晓嵘:患者肝转移切除术辅助治疗结束后予西妥昔单抗维持治疗已有16个周期, 病情稳定。没有相关的指南、大型临床研究和前瞻性的队列研究提示肝转移瘤切除术后的维持治疗方案, 仅仅有个案报道。对目前患者的维持治疗方案大家有何建议?
曹小龙:结直肠癌转移灶和原发灶完全切除后使用西妥昔单抗靶向治疗目前没有明确的指征。另外, 西妥昔单抗的使用时间是否可以参考晚期肺癌辅助治疗使用TKI类药物的维持时间。
钟文昭:Ⅳ 期肺癌局部治疗后靶向药物治疗的时间是2年, 超过中位无病生存期, 因此, 常规建议服用TKI靶向药物的时间是2年。Ⅲ b期肺癌患者手术切除后一般有TKI药物的空窗时间。
马冬:术后维持治疗尤其是西妥昔单抗维持治疗没有足够的循证医学证据, 但是考虑到患者已行右肝切除残留左半肝, 一旦复发再次手术的机会甚少, 因此, 需要尽可能降低复发的风险。另外, 患者已获得西妥昔单抗的赠药资料, 一旦停药再次使用就需要自费, 维持治疗过程中患者的副作用仅仅是2度皮疹, 基本可以耐受。
吴一龙(肿瘤学教授):首先, 目前结肠癌肝切除术后的维持治疗没有相应的指南或大规模临床试验数据, 临床提示持续的西妥昔单抗靶向治疗有明确的生存获益。其次, 考虑到西妥昔单抗2度皮疹的副作用对患者生活质量的不良影响, 即使不考虑经济效益的因素也不支持长期使用西妥昔单抗。
总结一下今天的病例讨论, 本例诊断为乙状结肠中分化腺癌合并同时性肝多发转移, 根据指南结合这个患者的具体特点选择了原发病灶切除+化疗联合靶向治疗+肝转移灶切除的序列治疗, 至今肝转移灶切除已有17个月, 目前病情稳定。治疗的成功主要得益于患者的肿瘤生物学行为和预后良好(RAS全野生型, 左边结肠, 疗效为部分缓解, 原发病灶淋巴结阴性等)。先行结肠癌切除再做化疗还是新辅助化疗后同期/分期肝肠病灶切除主要依据是否进一步降低患者的死亡风险和延长生存时间。另外, 4个周期化疗疗效为部分缓解, 肝转移灶是否采用消融术的局部治疗主要取决于转移瘤的部位、是否邻近周围重要器官以及手术医生和医院的习惯、条件。肝转移切除后辅助治疗结束后西妥昔单抗的维持治疗考虑到患者的副作用, 并且没有相关指南、临床研究支持长期使用西妥昔单抗有生存获益, 因此不考虑继续使用西妥昔单抗, 建议停药观察。
The authors have declared that no competing interests exist.