作者简介:
 | 韩宝惠教授,上海市领军人才、优秀学科带头人,上海市胸科医院呼吸内科主任,医院药物临床试验管理机构主任,博士及博士后导师, 享受国务院特殊津贴。卫生健康委员会上海市胸科医院呼吸内镜培训基地主任,专科医师培训基地主任,任中国抗癌协会肿瘤精准医学专委会副主任委员,CSCO血管靶向专委会主任委员,CSCO理事会理事,上海医学会肿瘤靶分子专委会副主任委员, ASCO、ESMO、IASLC会员等。任多个核心期刊杂志编委。发表肺癌研究文章230余篇,近5年以第一负责人承担国家级课题2项,市级课题4项,局级课题1项。曾获得局级以上各类医学奖项共9项,其中,2013年获得第八届中国呼吸医师奖,以第一完成人获得中华医学科技奖二等奖,上海市医学科技二三等奖多项,主编主译著作5部,参编著作10部。1997年成为上海市首批医学“百人计划”培养对象。 |
Kelly K, Altorki NK, Eberhardt WE, et al. Adjuvant Erlotinib versus placebo in patients with stage Ⅰ B-Ⅲ A non-small-cell lung cancer (RADIANT): A randomized, double-blind, phase Ⅲ trial[J]. J Clin Oncol, 2015, 33(34):4007-4014.
1b。
EGFR-TKI在EGFR突变的晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的治疗中已确定了重要地位, 但在辅助靶向治疗中的地位和价值, 一直是研究者多年来想要探索的科学问题, 2017年年底CTONG1104结果的公布, 证实了吉非替尼对比化疗能够显著提高Ⅱ ~Ⅲ A期EGFR突变NSCLC患者的无病生存期(disease-free survival, DFS)。回顾辅助靶向TKI治疗这条艰辛之路, 我们不得不提到2015年发表在《J Clin Oncol》上的RADIANT研究的结果。
主要目的是探索厄洛替尼能否提高EGFR表达阳性的Ⅰ B~Ⅲ A期NSCLC患者的术后DFS[EGFR表达阳性即EGFR蛋白表达阳性(免疫组化法)或EGFR扩增(FISH法)]。
次要目的是探索厄洛替尼能否提高EGFR表达阳性的Ⅰ B~Ⅲ A期NSCLC患者的总生存率(overall survival, OS); 探索厄洛替尼能否提高EGFR突变阳性的Ⅰ B~Ⅲ A期NSCLC患者的DFS、OS和安全性。
• 研究条件:19个国家204个研究中心参加的多中心大型临床试验(RADIANT研究)。
• 研究起止时间: 2007年11月至2010年7月。
• 研究方法:多中心、随机、双盲、安慰剂对照的Ⅲ 期临床试验。
• 研究对象:患者的入组标准为18岁以上成年人; 手术切除的肿瘤组织经免疫组化法验证为EGFR蛋白表达阳性或经FISH法检测EGFR扩增; 接受完全性手术切除且术后分期为Ⅰ B~Ⅲ A期(只有N2); ECOG评分为0~2分; 有足够的器官功能。接受过新辅助全身治疗或辅助靶向治疗的患者不允许入组。
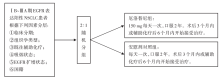
• 干预措施:患者以2:1比例随机分配至厄洛替尼组(150 mg, 每天一次)或安慰剂对照组(每天一次), 接受2年的辅助靶向治疗。所有患者必须在术后3个月内或辅助化疗后6个月内开始接受辅助靶向治疗(即厄洛替尼或安慰剂)。分层因素包括:术后分期、组织学类型、既往是否接受辅助化疗、吸烟状态、经FISH法检测后EGFR状态以及国籍。流程见图1。
• 评价指标:主要终点指标为意向性治疗人群的DFS; 次要终点指标为意向性治疗人群的OS, EGFR驱动基因阳性患者的DFS、OS以及安全性。
共有973例EGFR表达阳性的早期NSCLC患者接受随机分组, 厄洛替尼组和安慰剂对照组分别入组623例和350例EGFR表达阳性的早期NSCLC患者, 其中EGFR突变的患者例数分别为102例和59例, 中位随访时间47个月, 主要研究结果见表1。厄洛替尼组和安慰剂组EGFR表达阳性早期NSCLC患者的DFS分别是50.5个月和 48.2个月; 风险比(hazard ratio, HR)0.90, 95%可信区间(confidential interval, CI)0.714~1.104; P=0.324。厄洛替尼组和安慰剂组EGFR突变阳性早期NSCLC患者的DFS分别是46.4个月和 28.5个月; HR 0.61, 95%CI 0.384~0.981。2年OS分别是89%和72%, HR 0.53, 95% CI 0.28~1.03; P=0.06。
| 表1 RADIANT 主要研究结果 |
与安慰剂组相比, 厄洛替尼组中EGFR突变患者发生脑转移的比例更高(37.1% vs. 1.9%), 发生骨转移的比例更低(14.3% vs. 29.0%)。
厄洛替尼组中, 皮疹是最常见的不良事件, 发生率为86.4%, 其次为腹泻, 发生率为52.2%。三到四级不良反应主要是皮疹22.3%、腹泻6.2%以及皮肤瘙痒1.3%。
• 厄洛替尼辅助治疗无法提高EGFR表达阳性早期NSCLC患者的术后DFS;
• 由于本研究并未纳入EGFR突变这一分层因素, 故在EGFR突变组患者中厄洛替尼取得的DFS生存优势还需要进一步验证。
手术治疗仍是可能临床治愈早期肺癌的唯一方法。全球每年有20%~25%的新发肺癌患者可接受手术切除治疗, 而这部分患者的5年生存率仅有60%[1]。先前已有研究证实术后辅助化疗可使Ⅱ ~Ⅲ 期NSCLC患者的生存获益, 但这部分患者的5年OS也仅提高了约5%[2, 3]。因此, 对于早期可手术切除的肺癌患者, 仍需要新的治疗模式来提高患者的5年OS。
RADIANT研究[4]是一项2015年发表于《J Clin Oncol》杂志上的随机双盲Ⅲ 期临床试验, 对比了厄洛替尼和安慰剂在完全切除的Ⅰ B~Ⅲ A期NSCLC患者术后辅助治疗的疗效。由于研究设计时, 第一代EGFR-TKI(包括厄洛替尼和吉非替尼)并未明确其作用靶点为EGFR基因的敏感性突变, 因此研究者将EGFR基因扩增(FISH法)和EGFR蛋白表达(免疫组化法)作为了筛选条件。最终在2007年11月26日至2010年7月7日期间共入组了973例患者, 其中623例患者接受了厄洛替尼治疗, 350例患者接受了安慰剂治疗。研究结果显示两组患者的DFS差异并无统计学意义(HR 0.90, 95%CI 0.741~1.104)。厄洛替尼组和安慰剂组的中位DFS分别为50.5个月和48.2个月(P> 0.05)。
对RADIANT研究的设计和结果进行进一步的分析, 我们认为得到阴性结果的原因主要在两方面。首先, 如前文所述, 研究者要求入组患者为EGFR基因扩增(FISH法)或EGFR蛋白表达(免疫组化法)者, 而现在我们知道二者与第一代EGFR-TKI的疗效均无显著的相关性, 因此导致了厄洛替尼的疗效未显著优于对照组。那么如果入组条件为EGFR敏感性突变的患者, 研究的结果会如何呢?RADIANT研究中的亚组分析结果给了我们答案, 入组的患者中共有161例为EGFR敏感突变的患者, 其中102例接受了厄洛替尼治疗, 59例接受了安慰剂治疗, 两组的中位DFS分别为46.4个月和28.5个月, 虽然差异无统计学意义, 但是已经有了明显差别的趋势(HR 0.61, 95%CI 0.384~0.981)。以EGFR敏感突变为条件, 厄洛替尼组虽然有了获益的趋势, 但结果仍不能令人满意, 这就牵扯到了我们要分析的第二个原因。RADIANT研究共入组了973例患者, 其中Ⅰ B期患者达到了329例, 占总入组人数的52.8%, 在EGFR敏感性突变亚组中, Ⅰ B期患者同样达到了46.6%。我们知道Ⅰ B期患者接受术后辅助治疗一直存有争议, 一项于2008年发表在《J Clin Oncol》杂志上的Meta分析[3], 对4 584例接受术后辅助化疗患者的疗效进行了分析, 研究结果显示Ⅰ B期患者接受术后辅助化疗后并未明显获益(HR 0.93, 95%CI 0.78~1.10)。因此, 这也可能是厄洛替尼相对于安慰剂并未显示出明显获益的原因之一。
综上所述, RADIANT研究的阴性结果, 一是由于未以EGFR敏感性突变作为筛选条件, 二是由于入组患者中Ⅰ B期患者占了太大的比例。吴一龙教授牵头的ADJUANT研究[5]于2018年1月在线发表在《Lancet Oncol》杂志上, 该研究将入组条件设定为EGFR敏感突变的N1-N2期的NSCLC患者, 使用吉非替尼与长春瑞滨联合顺铂的治疗方案进行对比, 该研究获得了阳性结果, 吉非替尼治疗组获得了28.7个月的中位DFS, 而化疗组的中位DFS则为18.0个月(HR 0.60, 95%CI 0.42~0.87, P=0.005 4)。同时, 亚组分析结果显示N2患者相较于N1患者具有更明显的获益。从以上二个阳性及阴性结果的术后辅助靶向治疗的研究不难看出, 对于手术完全切除的早期Ⅰ B期患者, 靶向治疗可能是“ 无的放矢” 或“ 无用武之地” 。靶向治疗对于这部分人群目前是无任何循证医学证据支持; 而对于尽管手术“ 完全” 切除的Ⅲ A期, 尤其N2患者, 其术后仍残留无法检测到的靶向敏感的肿瘤细胞, 因此, 这部分人群是术后靶向治疗的潜在人群, 术后靶向治疗能够取得疾病控制的获益。
2018年ASCO会议报道的几项驱动基因阳性的晚期NSCLC一线靶向治疗的结果给我们带来了无限的遐想, 如ALK阳性Ⅲ B~Ⅳ 期NSCLC, 一线艾乐替尼靶向治疗其疾病控制时间(无进展生存时间)达到34.8个月、有效率达到82.9%的“ 震撼” 结果[6], 可以想象如果对于Ⅲ A-N2的局部晚期NSCLC应用一线艾乐替尼, 同样会取得非常高的缓解率和疾病控制时间, 这种情况下我们是否有必要急于手术或将来采用非手术的局部治疗呢? 随着第三代EGFR-TKI的出现, 其应用也从晚期肺癌患者的治疗, 逐步推到了早期肺癌患者的辅助治疗当中。吴一龙教授牵头的另一项ADAURA研究的方案设计于2018年5月刚刚发表在了《Clin Lung Cancer》杂志上[7], 该研究主要评价Osimertinib与安慰剂在Ⅰ B~Ⅲ A期NSCLC患者术后治疗中的疗效。随着近期多项大型临床试验的开展及研究结果的逐步公布, 相信会对肺癌患者的术后辅助治疗有一个更加完善的治疗方案, 从而进一步提高可手术肺癌患者的5年OS。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|