作者简介: 王正航(1989-),男,河南新乡人,医学博士,主要研究方向为结直肠癌的综合治疗。
直肠癌是我国常见的消化道肿瘤之一, 根据肿瘤下缘与肛缘的距离分为低位直肠癌(0~5 cm)、中位直肠癌(5~10 cm)和高位直肠癌(10~15 cm)。对于局部进展期的直肠癌而言, 目前通常认为上段直肠癌(腹膜反折以上)的处理原则同结肠癌, 主要为手术联合围手术期化疗, 而中下段直肠癌则更需要包含手术、放疗和内科治疗在内的多学科综合管理[1]。
美国国立综合癌症研究网(National Compressive Cancer Network, NCCN)和中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)均推荐对于cT3-4或cN1-2的患者进行同步放化疗后行根治性手术切除[1, 2]。但目前多数研究显示放疗可减少局部复发, 但不能延长总生存期; 同时放疗有可能严重影响患者术后的生活质量(如放射性肠炎、膀胱炎、性功能损害和第二肿瘤发生), 并可能会降低后续化疗的耐受性; 理论上, 较强的系统药物治疗替代同步放化疗有可能在控制局部病灶的同时早期消除微转移灶, 进而改善总生存期[3]。因此直肠癌手术前给予单纯的药物治疗(去放疗)逐渐引起众多学者的关注。
另一方面, 约15%~20%的直肠癌患者在新辅助治疗后能够达到临床完全缓解(clinical complete response, cCR)[4]。考虑到手术对于直肠癌(尤其是低位直肠癌)患者长期生活质量的影响(泌尿生殖系统受损、肠道功能紊乱, 尤其是造瘘后的生理与心理影响), 部分学者对这部分患者不进行手术而采用 “ 观察与等待(watch & wait, W& W)” 的策略(去手术)[5], 但目前这一策略仍有较多的问题未能解决, 其实施也存在一定的阻力。
因此, 本文将对“ 去放疗” 和“ 去手术” 两种治疗策略在局部进展期中下段直肠癌中的应用及前景进行阐述。
对于局部进展期直肠癌, 欧洲肿瘤学会(European Society for Medical Oncology, ESMO)已经根据不同的预后分层来推荐不同的临床路径:预后良好的患者(如中位直肠癌、cT3a/bN0、直肠系膜筋膜未受累、无壁外血管侵犯)无需行放疗, 若术者能够保证高质量的全直肠系膜切除术(total mesorectum excision, TME)时, 预后中等的患者也无需放疗[6]。
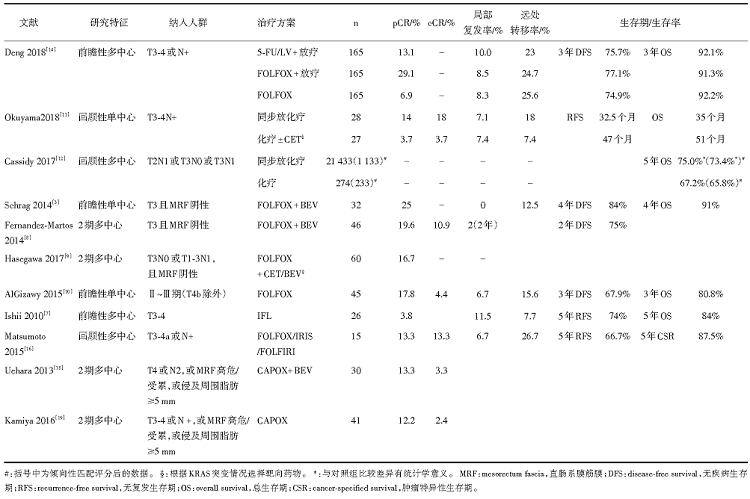
但事实上, “ 去放疗” 的策略仍未得到广泛的认可和推广。Ishii等于2010年首次报道了对T3-4患者单纯使用术前药物治疗的前瞻性多中心研究结果, 局部控制率欠佳(局部复发率为11.5%)[7]; 后续也有FOLFOX或CAPOX联合贝伐珠单抗(Bevacizumab, BEV)或西妥昔单抗(Cetuximab, CET)方案进行这一理念的尝试[3, 8, 9, 10], 结果显示病理完全缓解率可高达16.7%~25%, 局部复发率为0%~6.7%, 远处转移率为12.5%~15.6%, 低于同期常规治疗的Ⅱ ~Ⅲ 期直肠癌的远处转移率(约25%)[3]。
尽管上述单臂的研究看似极具前景, 但是单纯药物治疗的地位却始终充满争议。Okuyama等回顾了55位T3-4N+患者的情况, 发现与术前同步放化疗(n=28)相比, 单纯术前药物治疗组(n=27)虽然病理完全缓解率较低, 但是局部复发率相当, 且远处转移率和生存期有改善的趋势[11]。而Cassidy等进行的一项更大规模的回顾性分析发现, 对于T2N1、T3N0或T3N1的患者而言, 单纯术前化疗组(n=274)患者的生存率要差于同步放化疗组(n=21 433), 经过倾向性匹配后这一差异仍然显著[12], 因而其认为术前放疗是非常必要的。而我国进行的大型3期前瞻性多中心研究(FOWARC)在Ⅱ ~Ⅲ 期人群中对比了5-FU/LV+放疗、FOLFOX+放疗和单纯FOLFOX的疗效。其数据在2016年进行了初次报道[13], 在2018年ASCO会议上更新了最新数据[14]:单纯FOLFOX化疗的局部复发率、远处转移率和生存期均与放疗组相当, 首次在随机对照研究中证实“ 去放疗” 的合理性。
理想情况下, 应当在不同危险分层的人群中研究“ 去放疗” 策略的可行性, 但事实上, 现阶段的临床研究纳入的人群均不相同(见表1), 并且日本学者通常对于腹膜反折以下的肿瘤行侧方淋巴结清扫[15], 因而很难得到一致的结论。尽管如此, 笔者认为对于“ 局部复发风险低” 的患者和“ 风险高” 的患者, 去放疗的具体实施策略应是不同的。
| 表1 术前单纯药物治疗文献回顾 |
对局部复发风险低的患者(如T3, MRF阴性)可考虑单纯行术前药物治疗。FOLFOX是最为常用的化疗方案, 也有临床医师选择伊立替康, 疗效似乎与FOLFOX相近[16], 为了尽可能消除远处转移, 加用靶向药物也是一种选择[3, 8, 9]。
对于局部复发风险高的患者[如中下段(T3c-d/T4), LN(+), 壁外浸润(+), MRF(+)], 可以考虑术前化疗+抗血管生成治疗(CAPOX± BEV)能达到56.7%~60%的T降期、52.5%~83.3%的N降期以及90%~90.2%的R0切除率, 但目前尚缺乏复发和生存情况的数据[18, 19]。另外, 为了提高客观缓解率(objective response rate, ORR)和新辅助治疗中的病理完全缓解率, 对于全RAS野生型的直肠癌推荐使用化疗+抗EGFR单抗, 期望达到肿瘤退缩深度明显[20, 21, 22], 基于近期的ESMO会议报道, 未来甚至可以考虑使用FOLFOXIRI+抗EGFR单抗[23]。而对于RAS突变的患者, 尽管贝伐珠单抗对于ORR的改善不明显[24], 但贝伐珠单抗可能提高病理完全缓解率[25], 因此也可以考虑将贝伐珠单抗用于新辅助治疗。目前已启动的BACCHUS研究就是探索在高危患者中使用FOLFOXIRI+BEV与FOLFOXIRI的疗效差异[26]。尽管目前临床证据缺乏, 笔者认为对于体质好的局部高危人群, FOLFOXIRI ± 靶向治疗有可能在提高局部控制率的基础上甚至改善长期生存率。
随着液体活检技术的广泛应用, 血液循环肿瘤DNA(circulating tumor DNA, ctDNA)在临床实践中的地位也逐渐凸显, 并有望成为TNM之外的又一个分期指标[27]。在局部进展期结直肠癌中, ctDNA阳性患者的预后要差于阴性的患者, 因而未来ctDNA很有可能作为选择术前药物治疗方案和预后判断的重要指标。此外, 基因分子分型的指导作用也不可忽视, 共识分子亚型(consensus molecular subtype, CMS)1型以高度微卫星不稳定(microsatellite instability-high, MSI-H)为特征, 对常规的药物治疗效果不佳[28, 29], 而MSI-H的结直肠癌对于免疫检查点抑制剂反应良好, 且目前已有Nivolumab用于非小细胞肺癌新辅助治疗的成功案例[30], 因此免疫治疗用于针对MSI-H直肠癌的新辅助治疗也应是值得关注和期待的。
在新辅助治疗(同步放化疗、单纯药物治疗或者全程新辅助治疗)后, 约15%~20%的患者会出现cCR, 其中大多数患者接受了放疗联合化疗[4]; 而单纯药物治疗的人群中cCR比例仅为2.4%~13.3%[8, 10, 11, 16, 18, 19](见表1)。由于手术切除的并发症和造瘘口对心理及生理的影响较大, W& W策略成为另一种选择[5]。但目前尚无前瞻性随机对照研究比较手术和W& W的预后差异。
对于cCR的患者而言, 一项Meta分析显示, W& W组(n=71)和手术组(n=128)在非局部再发的复发率、肿瘤相关死亡率、无病生存期和总生存期方面都无差异; 且采用W& W的cCR患者和进行手术的病理完全缓解(pathological complete response, pCR)患者的总生存期也相近[31]。为了更好地研究W& W, 学者们建立了International Watch & Wait Database(http://www.iwwd.org/)。在2017年ASCO GI上, 公布了679位采用W& W患者的数据, 3年局部再发率为25%, 3年远处转移率为7%, 总体人群的 3年生存率为91%, 局部再发者的3年生存率为87%[32]。近期, 一项纳入了692例患者的荟萃分析也得出了相似的数据:局部再发率22.1%, 其中96%为3年内出现; 转移率8.2%; 3年生存率93.5%[4]。即使出现局部再发, 挽救性手术切除的比例也高达88%~95.4%[4, 31], 提示W& W的肿瘤学预后良好。尽管W& W显示可保留器官不影响预后的前景, 但是仍有一些问题值得关注。
首先, cCR并不等同于pCR— 这也是W& W策略受到质疑的最主要因素。理论上, 只有达到pCR的cCR患者使用W& W才是安全的; 但遗憾的是, cCR和pCR的一致率令人担忧:早期文献中, cCR患者中只有24%~25%为pCR[33, 34]。但目前研究提示W& W中局部复发率仅为22%~25%[4, 32], 这提示cCR和pCR的一致率可能远远高于24%~25%。笔者分析可能存在以下原因:(1)上述一致性研究时间较早, 无法代表当今直肠癌综合诊疗的现状。当前cCR的判断越来越精确, 主要为直肠指诊(无可触及肿块)、影像学(无残存肿瘤表现)以及内镜(无残存肿瘤、黏膜变白或毛细血管扩张)和癌胚抗原水平正常的综合判断[5, 35]; 目前各种检查手段准确性有了极大的提高, 所以二者的一致率也有所上升。最近的一篇小样本研究报道显示, 17例cCR患者, 有16例均术后确认为pCR(94%)[36]。(2)部分cCR/近cCR的患者因放疗的后遗效应[37]以及继续接受更多周期的药物治疗而达到了pCR。无论如何, 近期大规模的分析显示W& W策略具有几乎等同于手术的良好肿瘤学预后, 提示这一策略的有效性和安全性[4, 31]。
其次, 提高临床完全缓解率、使得更多的患者有机会拥有W& W的选择应成为研究重点。着眼于提高临床完全缓解率的研究较少, 增加观察疗效的时间是可选策略:接近cCR的患者中, 6~12周后再评估时, 有90%转变为cCR[37]。同时可以参考提高pCR的各种策略, 包括在长程放疗基础上, 使用更强力的化疗(如FOLFOXIRI)或联合靶向治疗的全程新辅助治疗策略[38]。另外研究者也应该警惕随着临床完全缓解率的提高, 也会有更多的非pCR患者进入到W& W策略中, 如何将这部分患者早期筛选出来进行手术也是未来关注的焦点。除了目前更加精确的影像学手段和病理检测外, 后续的研究可以考虑使用治疗前基因水平的差异[39]以及治疗期间ctDNA的动态变化情况来帮助甄选。此外, cCR后的随访策略和间隔也尚无统一共识。
中下段局部进展期直肠癌的新辅助治疗尚有很多未解决的问题, 本文着重回顾和总结了“ 去放疗” 和“ 去手术” 策略的现状和存在的问题, 笔者认为, 在精准医学背景下, 利用临床病理特征、影像学手段和基因检测来筛选出各个治疗策略的获益人群是今后的研究方向。此外, 仍有一些热点问题值得探讨; 因此, 在后面的循证评价部分中, 将推荐8篇关于新辅助治疗疗效的高影响力文章和专家评论, 供大家共同探讨。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|