| 潘燚,主任医师,医学博士,广东省人民医院放疗科行政副主任。1999年毕业于中山医科大学临床医学系,2006年获中山大学肿瘤防治中心肿瘤学硕士学位。2013年赴丹麦欧登塞大学攻读肿瘤学博士。现任中国抗癌协会肺癌专业委员会放疗学组委员,广东省医学会肿瘤学分会副主任委员,广东省医学会放射肿瘤学分会常委,广东省抗癌协会放疗专业委员会委员,广东省抗癌协会癌症康复与姑息治疗专业委员会委员,广东省肝脏病学会放射肿瘤专业委员会副主任委员。以第一作者发表多篇SCI及国内核心期刊文章,主持广东省自然科学基金、广东省医学科研基金等多项研究。 |
研究一: Erlandsson J, Holm T, Pettersson D, et al. Optimal fractionation of preoperative radiotherapy and timing to surgery for rectal cancer (StockholmⅢ ): A multicentre, randomised, non-blinded, phase 3, non-inferiority trial[J]. Lancet Oncol, 2017, 18(3): 336-346.
研究二: Bujko K, Wyrwicz L, Rutkowski A, et al. Long-course Oxaliplatin-based preoperative chemoradiation versus 5 × 5 Gy and consolidation chemotherapy for cT4 or fixed cT3 rectal cancer: Results of a randomized phaseⅢ study[J]. Ann Oncol, 2016, 27(5): 834-842.
1b。
研究一:术前长程放疗[(long course radiotherapy, LRT), 每周5次, 每次1.8~2 Gy, 连续5~6周]加延迟手术和短程放疗[(short course radiotherapy, SRT), 每周5次, 每次5 Gy, 持续1周]加即刻手术是临床常用的治疗方案。SRT后, 延迟4~8周再手术可以减少术后并发症, 同时增强肿瘤退缩效果, 所以术前放疗的分割方式及手术时机仍存争议。
研究二: 既往有文献报道采取术前SRT及即刻手术的方式对比传统分割同期放化疗方式对直肠癌的疗效没有差异。也有文献报道, SRT后延迟4~8周再进行手术对比立即手术的疗效没有差异, SRT后加上巩固化疗是否比传统分割同期放化疗更优, 目前没有结论。
研究一: 研究SRT立即手术、SRT延迟手术、LRT延迟手术三种方案在原发性直肠腺癌中的治疗效果的差异。
研究二: 研究SRT加巩固化疗延迟手术对比LRT同步化疗延迟手术两种方案在原发性直肠腺癌中治疗效果的差异。
研究一:
• 研究条件:18家瑞典医院参加的临床研究。
• 研究起止时间:1998年10月5日至2013年1月31日。
• 研究方法:多中心、随机对照、非盲、非劣效Ⅲ 期临床研究。
• 研究对象:经病理活检证实为直肠腺癌(距离肛缘15 cm内), 无不可手术或远处转移的征象, 腹部和盆腔没有接受放疗史, 无严重的心血管合并症。
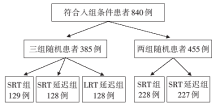
• 干预措施:入组的患者被随机分三组, 分别为:SRT组(5 × 5 Gy SRT后1周内接受手术)、SRT延迟手术组(5 × 5 Gy SRT后4~8周进行手术)、LRT延迟手术组(25× 2 Gy LRT后4~8周进行手术)。每家医院可以根据自己的情况选择两种SRT方案(1:1)或三种治疗方案进行随机, 如图1。
• 评价指标:主要研究终点指标为局部无复发生存率(recurrence-free survival, RFS), 次要研究终点指标包括:总生存率(overall survival, OS), 术后死亡率, 术后并发症, 再次手术率, 放疗副反应等。
研究二:
• 研究条件: 39家波兰的医院和研究机构参加的临床研究。
• 研究起止时间:2008-2014年。
• 研究方法:多中心、随机对照、非盲、Ⅲ 期临床研究。
• 研究对象:经病理活检证实为直肠腺癌, 临床分期T4或者触诊固定T3, PS评分≤ 2分的适合手术及放疗的≤ 75岁患者。
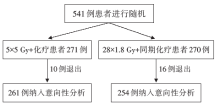
• 干预措施:入组的患者被随机分两组, A组:SRT组(5 × 5 Gy 放疗+3个疗程FOLFOX4化疗), B组:LRT组(28× 1.8 Gy放疗, 同期给2程奥沙利铂+亚叶酸钙+氟尿嘧啶化疗), 如图2。
• 评价指标:主要研究终点指标为R0切除率, 次要研究终点指标包括:OS, 无病生存率(disease-free survival, DFS), 术前治疗急性反应, 术后并发症, 术后病理完全缓解率(pathological complete response, pCR), 局部和远处失败率等。
研究一:
本研究共纳入840名符合入选标准的患者, 其中385名三组随机分组的患者被随机分配至SRT组(129例)、SRT延迟组(128例)和LRT延迟组(128例), 455名两组随机分组的患者随机分配至SRT组(228例)和SRT延迟组(227例)。其中有74例(9%)患者有方案违背。SRT的两组患者临床特征均衡性良好。所有患者的中位随访时间为5.2年。
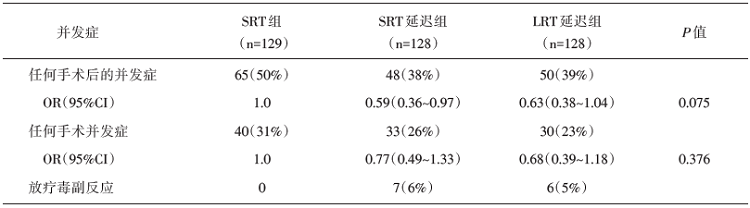
SRT组、SRT延迟组和LRT延迟组的中位局部复发时间分别是28.3个月( 20.7~62.2个月)、22.1个月(15.5~34.3个月)和33.3个月(17.8~114.3个月)。SRT组、SRT延迟组和LRT延迟组的5年OS分别是73%[(95%可信区间(confidence interval, CI) 64%~80%]、76%(95%CI 67%~83%)和78%(95%CI 70%~84%)。SRT组、SRT延迟组和LRT延迟组的5年RFS分别是65%(95%CI 56%~73%)、64%(95%CI 54%~71%)和65%(95%CI 56%~73%), 差异无统计学意义。并发症方面:SRT延迟手术组的患者术后并发症要少于SRT组[41% vs. 53%; 风险比(hazand ratio, HR) 0.61(95%CI 0.45~0.83), P=0.001]。见表1和表2。
| 表1 短程放疗患者并发症的比较 |
| 表2 三组随机分组患者的放疗并发症比较 |
研究二:
本研究共纳入541例符合入选标准的患者, 26例患者退出研究, 其中261例患者纳入A组(SRT + 化疗组)和254例患者纳入B组(LRT同步化疗组)进行意向性分析。两组患者临床特征均衡性良好。所有患者的中位随访时间为35个月。
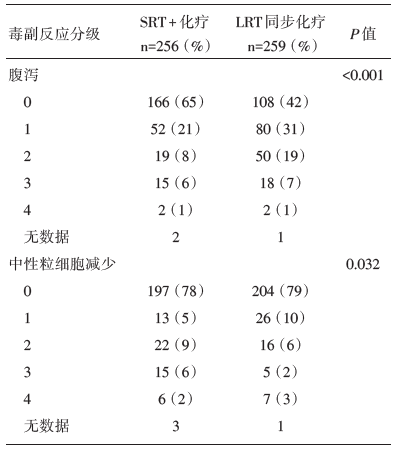
毒性方面:A组的所有急性反应低于B组(75% vs. 83%, P=0.006), Ⅲ ~Ⅳ 级反应23% vs. 21%。腹泻和中性粒细胞减少情况见表3, 晚期反应和手术并发症两组没有明显的差异。
| 表3 术前新辅助治疗的急性毒性反应 |
手术情况:术后pCR A组为16%, B组为12%, P=0.17。R0切除率A组为77% (95%CI 72%~82%), B组为71% (95%CI 65%~76%), P=0.07, HR=1.42 (95%CI 0.96~2.12)。
生存情况:A组和B组的3年OS分别是73%和65% (HR=0.73, 95%CI 0.53~1.01, P=0.046)。A组和B组的3年DFS分别是53%和52%(HR=0.96, 95%CI 0.75~1.24, P=0.85)。A组和B组的3年局部复发率和远处转移率分别为22% vs. 21% (HR=1.04, 95%CI 0.67~1.38, P=0.82)和30% vs. 27% (HR=1.21, 95%CI 0.59~1.15, P=0.25)。
研究一:三种术前放疗方案的疗效无明显差异, 但是SRT后延迟4~8周进行手术的并发症发生率低, 能使直肠癌患者获益更多。
研究二:虽然局部治疗效果SRT加巩固化疗与LRT同期化疗没有差异, 但是SRT加上巩固化疗能提高OS并降低急性毒副反应。
多项前瞻性研究及Meta分析结果表明, 术前放化疗能降低直肠癌肿瘤分期, 提高R0切除率和保肛率, 降低术后局部复发率, 比术后放疗的疗效更好[1, 2, 3]。这奠定了新辅助放化疗在局部进展期直肠癌治疗中的重要地位, 是cT3、cT4直肠癌的标准治疗方法。然而, 对于放疗分割方式、放疗与手术的时间间隔一直存在争议。直肠癌术前放疗的标准方式一直为LRT, 即常规分割:每次1.8~2 Gy, 每周5次, 连续5~6周。但LRT治疗时间长, 延迟了手术时间、增加了治疗的费用。上世纪90年代, 欧洲开始探索缩短放疗时间的治疗方式。1997年瑞典一项随机对照研究结果显示:1周5× 5 Gy的SRT联合手术降低了直肠癌局部复发率、提高了生存率[4]。2012年Ngan等的研究表明T3患者行SRT+立即手术的疗效与LRT+同期化疗+手术的疗效无差异[5]。目前临床实践出现三种治疗模式:(1)SRT(1周5× 5 Gy放疗+1周内手术); (2)SRT延迟手术(1周5× 5 Gy放疗+4~8周后手术); (3)LRT(25× 2 Gy放疗+4~8周后手术)。然而未有头对头的研究比较这三种放疗模式, 本文评述的两篇研究正是探讨SRT与LRT、立即手术与延迟手术之间的疗效及不良反应的差异。
Stockholm Ⅲ 试验是第一项比较直肠癌SRT后立即手术与延迟手术的疗效及不良反应的Ⅲ 期随机对照研究。该研究入组可手术、病理证实的Ⅰ ~Ⅲ 期直肠癌患者, 随机分为三种模式:SRT+立即手术、SRT+延迟手术、LRT+手术, 研究中心可以选择随机入组三个治疗组, 或者仅随机入组SRT两个治疗组, 结果显示:SRT+立即手术、SRT+延迟手术、LRT+手术三组的5年OS、RFS均差异无统计学意义, 而不良反应方面SRT+延迟手术组的手术并发症及术后并发症都较SRT组低(28% vs. 36%, 41% vs. 53%), 然而SRT+延迟手术组的患者因放疗不良反应的再入院率较SRT组高(7% vs. 1%), 这有可能是因为SRT 后1周放疗的急性反应还未出现, 便已经接受了手术治疗; 而两者的晚期不良反应的发生率是相似的, 因此SRT+延迟手术组的术后耐受性与SRT+立即手术组相似, 甚至可能更好。因此, Stockholm Ⅲ 研究认为SRT后4~8周手术优于SRT后立即手术。
然而Stockholm Ⅲ 研究仅仅比较了三种术前放疗模式的差异, 并未加入同期化疗。目前局部晚期直肠癌的标准治疗方案为放疗联合化疗, 而Stockholm Ⅲ 试验中只纳入了单纯放疗的患者, 因此虽然结论证实了SRT+手术组的疗效及耐受性不差于LRT+手术组, 但不能说明SRT延迟手术组是否也不劣于LRT同步化疗。而Bujko等开展的另外一个研究正好回答了这个问题。
Bujko等的临床研究对比了手术前两种治疗模式:SRT+序贯化疗与LRT+同期化疗, 结果显示SRT+序贯3周期化疗提高了3年OS并且降低了急性不良反应的发生。SRT+术前化疗缩短了术前放疗的时间、消除了同期放疗和化疗两者叠加作用的影响, 使得SRT序贯化疗的急性不良反应较LRT同步放化疗减少。虽然SRT序贯放化疗组与LRT同步放化疗组之间R0切除率、pCR、局部复发及远处转移率均无差异, 但OS仍有显著差异, 可能与SRT组的术前足量化疗完成率更高有关, 足量的化疗更有利于清除全身的微小肿瘤病灶, 另外, SRT组的大分割放疗有利于激活体内抗肿瘤免疫反应[6], 可能为后续长期的抗肿瘤治疗提供帮助。
Stockholm Ⅲ 试验和Bujko等的临床研究都是Ⅲ 期随机对照研究, 从样本量的计算、研究设计、方案执行到数据分析都遵循了科学严谨的原则, 其研究结果为不同术前放疗模式的选择提供了高级别的循证医学证据, 但尚有以下不足:(1)MRI不是术前常规检查。在Bujko等的研究入组标准中未将盆腔MRI检查作为术前常规检查; Stockholm Ⅲ 研究在2003年并未统一术前检查, 2003年之后术前检查才统一采用盆腔MRI及胸+上腹部CT进行分期。MRI为多参数成像、有良好的软组织分辨率, 可以清晰显示直肠内外层结构, 对于低位直肠癌的分期优于CT, 因此术前未行MRI检查可能影响肿瘤分期的准确性; (2) Stockholm Ⅲ 的研究对象纳入了T1/T2的患者, 而目前循证医学证据表明这部分患者接受术前放疗并无获益, 仅建议T3/T4的患者行术前放疗, 因此该研究剔除T1/T2患者再行二次分析也许更恰当; (3)Stockholm Ⅲ 研究于1998年启动, 2015年完成随访, 整个研究时间跨度大。在试验启动之时没有证据表明同期放化疗较单纯放疗的疗效更好, 但2006年的EORTC 2292[7]及FFCD 9203[8]两项研究均显示术前同步放化疗优于术前单纯放疗, 因此Stockholm Ⅲ 研究未加入术前同期化疗, 其研究结果对于判断联合化疗的术前放疗不同分割方式意义有限; (4)SRT的一个优势是缩短治疗时间、降低治疗费用, 但在两个研究中均未对SRT与LRT的经济效益进行分析; (5)Bujko等的临床研究中SRT组与LRT组奥沙利铂的剂量不一致, 有可能对结果造成偏倚。
这两项临床试验证实了局部晚期的直肠癌术前放疗可选择SRT, 并且SRT后序贯化疗较LRT同步化疗生存获益更大。虽然目前LRT同步化疗仍然被认为是标准的治疗方式, 但随着临床获益证据的补充及SRT在时间-效益比的优势, SRT联合化疗的地位将越来越高。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|