[编者按] 疾病的正确诊断和合理治疗是患者和医务工作者共同的心愿。在广东省人民医院肿瘤中心, 吴一龙教授指导临床医生应用循证医学理论进行肿瘤的多学科综合治疗, 开展临床病例讨论。讨论会上各学科共同围绕一个病例或一个病种进行会诊, 临床、病理、B超、放射影像等资料齐全, 除相关科室提前准备的中心性发言外, 到会人员各抒己见, 气氛热烈。参会人员受益匪浅, 提高了对疑难病例的诊治水平。为了将他们的诊治经验传播出去, 让更多的临床医生获益, 我刊开辟“ 循证病例讨论” 栏目, 希望广大医务工作者关注此栏目。
患者, 男, 46岁, 吸烟者, PS=1。因“ 确诊右上肺腺癌并治疗后2个多月” 入院。
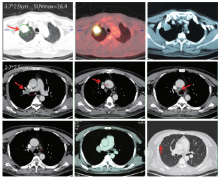
患者于2017年11月体检发现右上肺肿物, 考虑肺恶性肿瘤。后来我院门诊, 2017-11-16 行PET-CT提示:右上肺肿物, 大小约3.7 cm× 2.9 cm, SUVmax=16.4, 3A#、4R#、10R#淋巴结肿大, 代谢增高, 考虑右上肺恶性肿瘤伴肺门纵隔淋巴结转移。右侧胸膜可见散在结节, 不排除转移, 见图1。
个人史/既往史/家族史:父亲患食管癌, 余无特殊。
入院诊断:右上肺恶性肿瘤, cT2aN2M0, Ⅲ A期。
术前诊断及分期处理:
(1)2017-11-22 右侧内科胸腔镜:胸腔内粘连明显, 难以分离, 未能探查, 遂于腔镜可到达处(无明显结节)予右胸膜组织活检, 病理提示未见明确肿瘤。
(2)2017-12-04 纵隔镜检查术:4R#可见癌转移(1/2), 7#可见癌转移, 为腺癌(1/4), 其余淋巴结(4L#、2R#)未见转移癌(0/3)。
(3)厦门中心实验室报告:EGFR未见突变。筛选新辅助靶向治疗的临床试验(C-TONG1103)失败。
(4)本院病理科报告:EGFR 19 Del(+),ALK无断裂(2%)。
治疗经过:
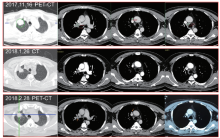
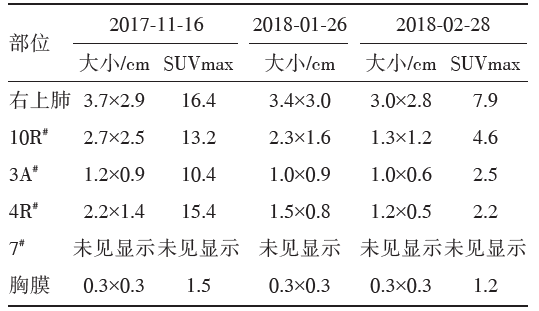
(1)2017⁃12⁃13开始行3周期新辅助化疗,多西紫杉醇 +卡铂,期间出现Ⅳ度中性粒细胞减少,末次化疗时间为2018⁃01⁃29。疗效评价为部分缓解(-32%),见表1及图2,分别为基线(2017⁃11⁃16)、2周期新辅助化疗后(2018⁃01⁃26)和3周期新辅助化疗后(2018⁃02⁃28)肺肿物和淋巴结的变化情况。
(2)2018-03-02 行电视辅助胸腔镜手术(video-assisted thoracoscopic surgery, VATS)(中转开胸)右上肺叶切除术 + 纵隔淋巴结活检术 + 胸腔粘连松解术。
术中探查:胸腔广泛粘连, 未见胸腔内播散; 右上肺肿瘤侵犯胸顶胸膜。
右上静脉及相关动脉切断后, 游离上叶支气管, 可见上叶支气管根部一枚淋巴结(11#)与支气管粘连致密, 难以分离, 予部分活检后送冰冻, 后切断上叶支气管。冰冻切片提示:支气管切缘(-), 上叶淋巴结(11#)可见转移灶; 予钛夹标记(R2切除)。肿瘤侵犯胸膜处予胸膜外切除, 切缘送冰冻, 病理报告:可见腺癌, 予钛夹标记(R1切除)。
于奇静脉上方打开上纵隔胸膜, 右上下气管旁淋巴结致密粘连, 呈纤维状增厚变硬, 难以分离切除, 予活检, 冰冻切片提示右下气管旁淋巴结可见癌灶, 为R2切除。
| 表1 新辅助化疗前后肺肿物和淋巴结的变化情况 |
术后病理提示:右上肺浸润性腺癌, 呈腺泡样生长方式。肿瘤最大径3.5 cm, 肿瘤侵犯并突破胸膜; 支气管切缘未见癌; 胸顶切缘可见癌; 淋巴结可见癌转移(共10/15, 亚段淋巴结3/3, 段淋巴结1/1, 叶淋巴结2/2, 叶间淋巴结0/4, 右下气管旁淋巴结2/3, 右上气管旁淋巴结为纤维脂肪组织, 血管前淋巴结2/2)。
目前分期:右上肺腺癌, pT3N2M0, Ⅲ B期(R2切除)。
林俊涛(肺外科医师):汇报病史(略)。提出讨论要点:(1)术前确诊为Ⅲ A/N2腺癌后的治疗策略讨论; (2)下一步的治疗方案:术后化放疗?术后放疗?术后靶向 + 放疗?
组内讨论意见:患者pⅢ A/N2, 多站淋巴结转移, 现R2切除。术前曾行3周期术前辅助化疗。术后可行同步化放疗。
吴一龙(肿瘤学教授):本病例经纵隔镜活检确诊为N2转移, 标本送检厦门中心实验室行EGFR检测为阴性, 而我院病理科检测提示存在EGFR 19外显子缺失, 两次检测结果不一致, 主要原因是什么?
钟文昭(肺外科主任医师):支气管内超声检查(endobronchial ultrasonography, EBUS)和纵隔镜活检标本进行EGFR检测存在一定假阴性率, 可能原因包括:①EBUS/纵隔镜的假阴性; ②组织标本量少; ③标本中肿瘤含量少, 而病理评估不充分。C-TONG1103研究入选患者的EGFR检测均送厦门艾德中心实验室, 检测前并未进行病理评估。因此可能存在组织中肿瘤组织少或无肿瘤组织的情况, 导致假阴性。
杨学宁(肺外科主任医师):本次患者行纵隔镜检查术, 组织标本量多, 肿瘤细胞含量少, 因此EGFR检测假阴性的可能原因为标本中肿瘤含量少, 而EGFR检测前病理评估不充分。
刘思阳(肺科医师):本院实验室在进行基因检测之前, 需进行病理学评估, 并由研究员确认, 肿瘤含量 > 20%时, 则进行基因检测。
吴一龙:本例患者治疗前曾行血浆EGFR检测, 结果为19外显子缺失, 同时手术后取肿瘤组织再次进行确认, 确认存在19外显子缺失。因此考虑临床试验中心实验室EGFR检测存在假阴性, 而主要原因为EGFR检测前未对组织标本进行病理评估。这个问题给我们两点启示:①基因检测前, 需严格评估检测流程的合理性, 需特别注意基因检测前是否进行了病理评估; ②以后若再出现此类现象, 可再次送组织标本至中心实验室进行检测, 但需先由我院进行病理评估, 确认组织标本中含有足够肿瘤细胞。
该患者目前已行手术治疗, 本次讨论的主要问题是下一步的治疗策略。但该患者为cⅢ A/pN2腺癌, 存在明显异质性, 诊治难度大, NCCN等指南均建议此类患者需进行多学科讨论, 以指导此类患者的治疗。这个病例可围绕患者纵隔镜确诊cⅢ A/pN2后, 尚未进行术前新辅助治疗时, 对此类患者的综合诊治进行深入讨论; 再讨论其后续的个性化治疗策略。
李伟雄(放疗科主任医师):该患者术前诊断cⅢ A/pN2, 评估为可手术, 手术范围为肺叶切除而非全肺切除。尽管化放疗有根治机会, 5年生存率尚可。Ⅲ A期非小细胞肺癌患者存在明显异质性, T1-2N2M0患者的放疗效果优于T3-4N2M0; 而部分Ⅲ A期患者(如T4N1), 由于肿瘤病灶大, 或者存在同侧多发结节, 放疗效果稍差, 这类患者建议手术切除。而此病例的原发灶约4 cm, 距离纵隔较远, 如行根治性化放疗, 需整野照射, 放疗范围大, 因此建议外科干预为主。围术期可行新辅助治疗或辅助治疗, 目前的临床研究结果提示术前化放疗可提高降期率, 但总生存率与单纯新辅助化疗相似, 化放疗相比化疗增加了约4周的治疗时间且增高手术并发症率。因此建议新辅助化疗后行手术治疗。
旁述:SAKK研究[1]是针对Ⅲ A/N2 非小细胞肺癌的临床研究, 对比术前新辅助化疗和新辅助化放疗的效果。结果显示, 新辅助化放疗组提高了反应率(61% vs. 44%, P=0.012), 且R0切除率(91% vs. 81%)、N降期率(64% vs. 53%)均有所提高。但新辅助化放疗未能提高生存期(无事件生存期12.8个月 vs. 11.6个月, P=0.67; 总生存期37.1 个月vs. 26.2个月, 风险比=1.0, 95%可信区间0.7~1.4)。
潘燚(放疗科主任医师):目前针对Ⅲ A/N2 非小细胞肺癌, 根治性化放疗对比新辅助化疗 + 手术的总生存率相似, 但目前缺乏亚组分析数据, 未能明确单站N2与多站N2两种治疗方式的优劣。多站N2 非小细胞肺癌出现远处转移的几率大, 且若手术R1/R2切除, 其5年生存率明显差于R0切除的患者, 因此接受根治性同步化放疗可能更好。所以重点需评估是否可完全切除, 若外科医师认为可完全切除, 则行以手术为主的综合治疗。另外, 此患者目前确认存在EGFR突变, 且外科评估为可完全切除, 后续若出现复发, 仍可一线使用EGFR-TKI治疗。若此时行放疗, 术后再使用EGFR-TKI, 则出现间质性肺炎的可能性增大。因此建议行新辅助化疗后手术治疗。
廖日强(肺外科主治医师):在接受相同治疗模式的情况下(无论是接受根治性同步化放疗还是新辅助化疗 + 手术), 单站N2的非小细胞肺癌患者的预后均优于多站N2的患者。而多站N2的患者, 目前无相关数据对比根治性同步化放疗和新辅助化疗 + 手术的效果, 因此无法判定此类患者两种治疗模式的优劣。
谢松喜(放疗科副主任医师):Ⅲ A/N2 非小细胞肺癌的治疗模式选择还需考虑肿瘤的生长速度以及是否存在多站N2转移。对于肿瘤倍增时间长、单站N2转移的患者, 外科干预效果较好。而对于肿瘤生长迅速且存在多站N2转移的患者, 即使外科切除, 其仍可在较短时间内出现远处转移, 而不是局部复发。针对R1切除术后的非小细胞肺癌, 放疗后的复发模式以远处复发为主, 局部复发相对较少(42% vs. 7%)[2]。
杨学宁:CSLC0501研究[3]的结果显示, 无论是单站N2还是多站N2的患者, 辅助治疗组均优于新辅助治疗组。因此此类患者若术前提示存在N2转移, 外科考虑可完全切除, 有学者提出可直接手术切除, 后续根据病理结果决定是否行辅助治疗。目前CSLC0501为临床试验阶段, 且入组术前影像学诊断Ⅲ A/N2的患者, 并不强制要求进行术前有创纵隔分期, 分期存在不足之处, 暂时仍然不能应用到临床实践, 需等待更多数据结果确认。
钟文昭:CSLC0501研究中两组患者的主要治疗方式均为手术和化疗, 差别为治疗顺序不同。新辅助化疗组, 所有患者均接受术前化疗, 但有15%的患者未接受手术, 因此新辅助化疗对该组患者生存率的提高作用可能高于手术; 而辅助化疗组的患者均接受手术, 大部分术后接受辅助化疗, 因此手术在这组患者中起到的作用更大。而CSLC0501的结果显示无论是无病生存期还是总生存期, 辅助化疗组均优于新辅助化疗组(中位无病生存期和总生存期均有边缘统计学差异), 因此在这类患者中, 手术的作用可能大于化疗。
旁述:CSLC0501[3]是一项针对Ⅰ B~Ⅲ A期非小细胞肺癌的临床研究, 对比术前辅助化疗和术后辅助化疗的效果。新辅助化疗完成率100%, 化疗后疾病进展率12.4%, 辅助化疗完成率87.4%。5年无病生存率为50.0% vs. 33.0%(风险比=0.69, P=0.051), 5年总生存率为60.0% vs. 43.0%(风险比=0.66, P=0.049)。而辅助化疗组和新辅助化疗组的中位无病生存期为5.2年vs. 2.3年(P=0.057), 中位总生存期为7.3年vs. 4.2年(P=0.087)。
廖日强:早期可手术的患者, 经过新辅助化疗后, 部分患者会疾病进展, 这部分患者可能丧失了手术机会。因此实际临床工作中, 对Ⅰ ~Ⅱ 期患者, 应先行手术治疗; 而Ⅲ A/N2患者, 出现转移的几率高, 化疗发挥的作用更大, 这类患者往往先接受新辅助化疗。
吴一龙:针对Ⅲ A/N2 非小细胞肺癌, 决定治疗方式前, 评估的重点往往为淋巴结, 其次为原发肿瘤是否可完整切除。术前评价淋巴结是否转移时, 既往主要依据淋巴结短径。目前认为Bulky N2的标准为短径 > 2.5 cm[4], 而临床工作中, 判断淋巴结是否可疑转移的标准为短径 > 1 cm[5]。这与其设定标准的敏感度和特异性有关。既往研究显示, CT诊断淋巴结转移的敏感度为55%, 意味着45%的患者漏诊[5], 其敏感度随短径的升高而降低。而淋巴结短径1 cm为目前广泛使用的淋巴结转移判断标准。CSLC0501研究[3]中纵隔淋巴结转移选择的标准为短径 > 1.5 cm, 因其敏感度及特异性均较高, 均超过80%。本例患者纵隔淋巴结短径小, 且经化疗后缩小, 考虑可完整切除, 因此建议以外科为主的多学科诊治。
第二步需明确行新辅助化疗或辅助化疗。既往认为, 相比辅助化疗, 新辅助化疗的优点为:①不可手术或预计手术难度大的患者, 通过新辅助化疗, 有可能转化为可手术患者; ②新辅助化疗后可消灭微转移灶; ③患者的依从性优于辅助化疗。后续有多项相关研究, 但样本量均较小, 难以说明化疗的作用。而后续出现样本量较大的研究, 如NATCH[6], 针对这类研究的Meta分析[7]显示新辅助化疗及辅助化疗对患者的生存均提高约5%, 术前、术后辅助化疗对生存的影响相似。因此我们设计了CSLC0501, 头对头对比新辅助化疗与辅助化疗的效果。而此时NATCH研究[6]的结果公布了, 该研究针对Ⅰ B~Ⅲ A期患者, 设置三组:①单纯手术; ②新辅助化疗 + 手术; ③手术 + 辅助化疗。结果显示无论是新辅助化疗 + 手术还是手术 + 辅助化疗, 患者的生存率与单纯手术组相比无差异(5年无病生存率34.1% vs. 38.3% vs. 36.6%, P > 0.05)。该结果颠覆了以往辅助化疗可提高生存率的概念。CSLC0501研究的结果与NATCH不同, 提示辅助化疗组与新辅助化疗组存在差异。我们后续进行了一项真实世界研究-ICAN研究, 结果显示辅助化疗未能提高生存率。可以看到真实世界研究的结果与临床研究的结果存在明显差异, 因此对于新辅助化疗或辅助化疗, 需严格按照临床试验的标准筛选患者, 所获的数据才可能真正为患者带来生存获益。但目前需更多的证据来说明此类问题。CSLC0501研究的新辅助化疗组中, 15%的患者最后未接受手术, 这可能对最终的生存率有影响, 因此我们后续对CSLC0501研究进行了ITT(intention-to-treat, 意向性治疗)分析和PP(per-protocol, 遵循研究方案)分析, 结果显示ITT分析和PP分析的结果相似, 因此认为该试验结果较为可靠, 均显示辅助化疗组优于新辅助化疗(边缘统计学差异)。综上所述, 针对cⅢ A/N2患者, 需先由外科医师评估是否可完全切除, 针对可完全切除的病例, 可考虑手术切除为主的多学科诊治; 若难以完全切除, 则考虑先行新辅助化疗, 根据疗效再决定是否行手术或同步化放疗。而根治性化放疗在此类潜在可切除患者中的证据不足, 因此治疗仍然以手术为主。
现本患者已行新辅助化疗及手术切除, 为R2切除, 需行下一步治疗。
李伟雄:Ⅲ A/N2 非小细胞肺癌术后放疗的应用范围:①N2患者R0切除, 可考虑单纯放疗(50 Gy); ② R1/R2切除, 需行局部治疗 + 全身治疗, 该患者右上下气管旁、隆突下淋巴结R2切除, 胸顶R1切除, 可考虑行同步化放疗(60~66 Gy)。
陈志勇(放疗科医师):Ⅲ A/N2 非小细胞肺癌, 存在约5.7%的R1/R2切除率, 此类患者行术后化放疗可提高生存率[8]。而放疗在其中的作用显得尤为重要, Ⅲ A/N2 非小细胞肺癌 R1/R2切除术后, 术后行放疗可提高5年生存率(28.0% vs. 18.7%, P=0.02)[9]。目前术后化疗及放疗的应用, 主要为同步化放疗和序贯化放疗, 针对R1/R2切除的非小细胞肺癌, 术后序贯化放疗和同步化放疗的中位生存期分别为42.6个月和38.5个月, 差异无统计学意义(P=0.42)[10]。因此针对这部分患者, 应根据其一般状况考虑同步化放疗或序贯化放疗。
吴一龙:术前内科胸腔镜检见粘连, 纵隔镜分离存在难度, 仅可做活检, 难以行淋巴结清扫。是否可考虑针对这类患者进行根治性同步化放疗?而患者目前行Ⅲ A/N2 R2切除术后, 需行同步化放疗, 考虑患者术前使用多西紫杉醇 +卡铂, 疗效为部分缓解, 但存在Ⅳ 度中性粒细胞减少, 术后行同步化放疗需避免严重不良反应, 建议行同步化放疗, 其中化疗方案可考虑紫杉醇 + 卡铂周疗, 或单用顺铂增敏。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|