| 周欣,医学博士,副主任医师,硕士研究生导师。 中华医学会心血管病学分会青年委员、中国医师协会高血压专业委员会委员,美国心脏病学院专家会员(FACC)。中国人民武装警察部队心血管病研究所副所长,天津市心血管重塑与靶器官损伤重点实验室副主任。主要研究领域为高血压和冠心病的基础与临床研究,近年来尤其关注妊娠期心血管风险暴露(妊娠期高血压疾病、妊娠期肥胖和糖尿病)与远期心血管代谢风险防控的相关问题;作为负责人承担国家自然科学基金课题3项。 |
Hanem LGE, Stridsklev S, Jú lí usson PB, et al. Metformin use in PCOS pregnancies increases the risk of offspring overweight at 4 years of age: Follow-up of two RCTs[J]. J Clin Endocrinol Metab, 2018, 103(4): 1612-1621.
1a。
• 多囊卵巢综合征(polycystic ovary syndrome, PCOS)可影响5%~13%的育龄女性[1]。
• 患有PCOS的女性不良妊娠结局的风险较高, 并且可能会导致宫内环境的改变。澳大利亚一项回顾性队列研究显示, 这些女性的子代中, 畸形、代谢综合征和肥胖的风险增高[2]。然而, 目前尚缺乏PCOS患者子代在出生时或童年时期代谢和发育状况的相关研究。
• 二甲双胍越来越多地应用于患有PCOS、妊娠期糖尿病、Ⅱ 型糖尿病和孕期肥胖的孕妇, 并可降低PCOS相关妊娠并发症的风险[3]。然而, 由于相关研究设计的局限性, 宫内暴露于二甲双胍的远期健康影响尚不清楚, 并且大多数是针对妊娠期糖尿病患者子代进行的研究。这些研究大多比较的是二甲双胍(单独或在需要时与胰岛素联合给药)与胰岛素治疗, 而且没有安慰剂对照[4, 5]。一项来自于美国的非随机研究显示, 与美国婴儿的性别特异性规范数据相比, 二甲双胍暴露的子代在生后18个月内生长无明显偏差[6]。
• 25名儿童的随访数据显示, 二甲双胍和安慰剂暴露儿童8岁时的生长或身体成分没有差异[7]。而一项有安慰剂对照的随机对照试验— PregMet研究中197名1岁儿童的随访显示, 胎儿期间接触二甲双胍的儿童比安慰剂组儿童的体质量更高[8]。
• 调查宫内二甲双胍暴露对子代从出生到4周岁的人体测量学的潜在影响。
• 探索与标准人群相比, PCOS患者子代(安慰剂暴露组)的人体测量学数据的变化规律。
• 研究条件:(1) 挪威St Olav's医院开展的单中心研究; (2) PregMet研究, 挪威11个研究中心参加的研究。
• 研究起止时间:2014年4月至2016年7月。
• 研究方法:多中心、双盲、前瞻性随机安慰剂对照试验。
• 研究对象:PCOS患者的子代。
入组标准:参与St Olav's医院单中心研究或PregMet研究的受试者所生的子代, 其父母同意参与本次随访研究。
排除标准:流产、误诊、后代死亡、中途退出。
• 干预/随访方案:在出生时、6月龄、1周岁、1.5岁、2周岁和4周岁这六个时间点对纳入的儿童进行人体测量学检测。根据挪威生长参考值计算随年龄变化的体长/身高、体质量、体质量指数(body mass index, BMI)和头围的性别和年龄校正标准分数。通过评估安慰剂组和参考人群(标准分数为零)之间标准分数(身高、体质量、BMI和头围)的偏差来评价PCOS对患病母亲所生的后代生长情况的影响。根据扩展的国际BMI截止值(国际肥胖工作组)定义体质量超重和肥胖情况。
• 评价指标:主要终点指标是4周岁时儿童的身高、体质量、BMI和超重/肥胖情况以及1周岁时的头围。次要终点指标是从儿童6月龄开始到对应指标的最后一次测量数据(身高、体质量和BMI是到4周岁, 头围是到1周岁), 分析二甲双胍宫内暴露对人体测量学数据和出生时人体测量学数据(体长、体质量、BMI和头围)平均值的影响。
在292名受邀儿童/父母中, 170名母亲, 182名儿童(12名女性两次参加PregMet研究)参与本次研究(62%的参与率)。二甲双胍暴露组与安慰剂组在母体基线特征、受孕方式、妊娠并发症、妊娠期母体体质量增加、胎盘重量和母乳喂养持续时间方面差异均无统计学意义。
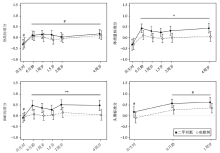
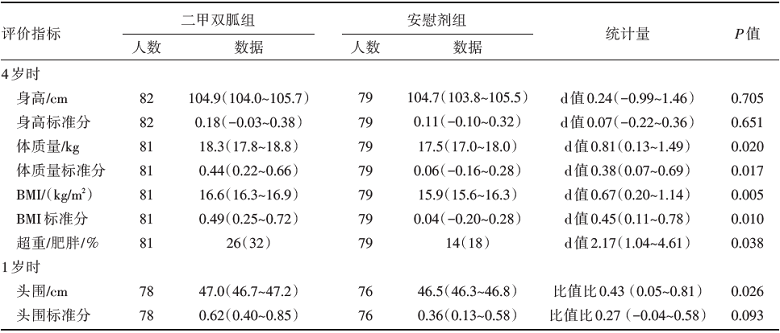
二甲双胍暴露组在4周岁时体质量超过安慰剂组[标准分数d=0.38, 95%可信区间(confidence interval, CI)0.07~0.69, P=0.017], 见表1, 这种情况从6月龄时就很明显, 见图1。二甲双胍组在4周岁时的BMI较高(d=0.45, 95%CI 0.11~0.78, P= 0.010), 见表1, 可追溯至6月龄, 见图1。同样, 二甲双胍组4周岁时超重/肥胖的儿童多于安慰剂组(比值比2.17, 95%CI 1.04~4.61, P=0.038)。
| 表1 通过混合模型分析计算的儿童人体测量数据 |
与宫内安慰剂暴露的儿童相比, 患有PCOS的母亲在孕期二甲双胍暴露后, 其子代在4周岁时具有更高的BMI。其临床意义尚不清楚, 这些儿童的身体成分和代谢健康状况应进一步调查。
近年来, 二甲双胍降糖作用之外的新型适应证在不断发现, 尤其值得注意的是其在孕期应用的安全性和有效性。在PCOS患者中, 无论是否伴有肥胖, 二甲双胍均可以改善其月经周期和激素状态。近期一项来自欧洲大型(约190万例)注册研究显示, 孕早期二甲双胍暴露不会增加子代发生先天性缺陷的风险[9]。因此, 对于PCOS育龄女性而言, 备孕期、早孕期或意外怀孕后, 二甲双胍的应用对于子代在孕期的安全没有明显影响。然而, 这篇来自挪威的子代长期随访研究, 提出了另外一个潜在的安全性问题:子代远期心血管代谢风险。该研究发现二甲双胍暴露的PCOS子代在4岁时BMI要高于非暴露的PCOS子代。这一现象提示, 尽管二甲双胍有诸多近乎“ 不可思议” 的治疗效果, 对于孕期应用不仅要关注母亲的临床收益, 还要关注子代的近期和远期风险, 要权衡利弊。我们建议, 对于PCOS患者孕期二甲双胍暴露与子代发育的这一联系, 应该从机制和人群研究层面进一步深入探讨。首先, 可对二甲双胍暴露者的胎盘从表观遗传学的角度进行研究, 发现潜在的线索; 其次, 采用多中心注册观察出生队列, 通过更大的样本量和更为细致的随访, 包括相关血清学标志物, 探讨子代出现代谢和发育异常的关键时期。通过上述工作, 可以更为全面地评估二甲双胍的安全性和作用机制, 并为子代心血管代谢异常的干预提供途径和时间窗。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|