作者简介: 李鹏(1973-),男,广东潮州人,医师,医学学士,研究方向为心血管重症。
目的 探讨阿拉明和去甲肾上腺素对感染性休克猪血流动力学和氧代谢的影响。方法 成年小型猪10只,静脉泵入大肠埃希氏菌脂多糖建立感染性休克模型,随机分为阿拉明组及去甲肾上腺素组。模型制备稳定1 h后按感染性休克集束化治疗,阿拉明组在基础治疗上使用阿拉明提升血压,去甲肾上腺素组采用去甲肾上腺素提升血压。在治疗前(T0)及治疗1/2 h(T1/2)、1 h (T1)、2 h(T2)、3 h(T3)使用脉搏指示连续心排出量监测仪观察并记录心率、平均动脉压、心指数、系统血管阻力指数;血气分析检测血氧饱和度、混合静脉血氧饱和度及乳酸水平并计算氧输送指数、氧耗指数、氧摄取率以及乳酸清除率。结果 大肠埃希氏菌脂多糖持续静脉泵入成功制备感染性休克模型猪,血管活性药物处理后两组模型的血流动力学指标均得到显著改善( P=0.000),与阿拉明组相比,在T2、T3时去甲肾上腺素组心率( t=2.317、 t=2.474)、平均动脉压( t=2.284、 t=2.313)明显较高( P值均<0.05),去甲肾上腺素组在T2时系统血管阻力指数显著大于阿拉明组( t=2.884, P<0.05),在T1、T2、T3时去甲肾上腺素组的心指数均明显大于阿拉明组( t=3.360、 t=3.058、 t=2.559, P值均<0.05);两组模型的组织氧代谢指标均得到显著改善( P<0.05),血清乳酸水平显著下降( P=0.000),与阿拉明组相比,去甲肾上腺素组在T2、T3时氧输送指数( t=2.832、 t=2.680)、氧耗指数( t=2.519、 t=2.713)以及血氧饱和度( t=2.167、 t=2.560)均明显大于阿拉明组( P值均<0.05);去甲肾上腺素组的乳酸水平在T1、T2、T3显著低于阿拉明组( t=2.807、 t=3.285、 t=2.938, P值均<0.05),去甲肾上腺素组乳酸清除率明显高于阿拉明组( t=4.939, P=0.000)。结论 阿拉明和去甲肾上腺素均能有效的改善感染性休克模型猪的血流动力学状态和组织氧代谢,去甲肾上腺素较阿拉明起效快,更有效。
Objective To investigate the impact of Aramine and Norepinephrine on hemodynamics and oxygen metabolism in septic shock pigs.Methods Ten adult miniature pigs, septic shock models established by intravenous pumping of Escherichia coli lipopolysaccharides, were randomized to the group of Aramine or the group of Norepinephrine. Septic shock pigs were treated according to sepsis shock bundle strategy 1 hour after stable model establishment. Aramine was added to the basic treatment to increase blood pressure in the group of Aramine and, similarly, Norepinephrine was added to increase blood pressure in the group of Norepinephrine. The pulse-indicated continuous cardiac output (PiCCO) monitor was used to record heart rate (HR), mean arterial pressure (MAP), cardiac index (CI), systemic vascular resistance index (SVRI) and arterial blood gas analysis was used to test oxygen saturation (SaO2), oxygen saturation of mixed venous blood (SvO2) and lactate levels as well as calculating oxygen delivery index (DO2I), oxygen consumption index (VO2I), oxygen extraction rate (O2ext) and the lactate clearance rate before treatment (T0) and 1/2 hour, 1 hour, 2 hours and 3 hours after treatment (T1/2, T1, T2 and T3).Results Septic shock pig models were successfully established by continuously intravenous pumping of Escherichia coli lipopolysaccharides and the hemodynamic parameters were significantly improved in both groups after using vasoactive agents ( P=0.000). The HR( t=2.317, t=2.474) and MAP( t=2.284, t=2.313) in T2 and T3 in the group of Norepinephrine were significantly higher than that in the group of Aramine ( P<0.05). The SVRI in T2 in the group of Norepinephrine was significantly higher than that in the group of Aramine ( t=2.884, P<0.05). The CI in T1, T2 and T3 in the group of Norepinephrine was significantly higher than that in the group of Aramine ( t=3.360, t=3.058, t=2.559, P<0.05). The tissue oxygen metabolism parameters of DO2I, VO2I, O2ext and SvO2were significantly improved ( P<0.05) and serum lactate levels were significantly declined ( P=0.000) in two groups. The DO2I( t=2.832, t=2.680), VO2I ( t=2.519, t=2.713)and SvO2( t=2.167, t=2.560) in T2 and T3 in the group of Norepinephrine was significantly higher than that in the group of Aramine ( P<0.05). The serum lactate levels in T1, T2 and T3 in the group of Norepinephrine were significantly lower ( t=2.807, t=3.285, t=2.938, P<0.05) and the lactate clearance rate was significantly higher than that in the group of Aramine ( t=4.939, P=0.000).Conclusions Both Aramine and Norepinephrine can effectively improve hemodynamics and oxygen metabolism in septic shock pigs and Norepinephrine takes effect more quickly and effectively than Aramine.
感染性休克病情凶险, 是非心脏专科急危重症患者的主要死因之一[1]。国内外的流行病学调查显示感染性休克患者的病死率高达22%~76%[2, 3]。感染性休克给社会带来了沉重的负担, 并且存活患者的生活质量也大大下降[4]。血管活性药物的早期应用是感染性休克复苏成功的关键所在, 去甲肾上腺素由于其独特的优势, 已经成为抗感染性休克首选的血管活性药物, 但其给药方式单一, 只能经静脉给药, 而且由于其强烈的缩血管作用, 使用不慎易导致周围组织缺血坏死, 特别是在经外周静脉给药时, 这种弊端更为突出。阿拉明作为血管活性药物之一, 其药理机制与去甲肾上腺素相似, 课题组前期研究结果显示阿拉明在改善感染性休克患者肾功能、清除血乳酸方面较多巴胺有一定的优势[5], 但其在感染性休克患者血流动力学及组织氧代谢方面的作用目前尚有待深入研究, 特别是其能否作为感染性休克早期复苏、中心静脉通路未建立前的“ 过渡药物” 目前尚无定论。本文就阿拉明和去甲肾上腺素在感染性休克血流动力学以及组织氧代谢方面的作用进行比较分析, 试图为感染性休克早期血管活性药物的合理应用提供一定依据。
1.1.1 实验动物
成年健康小型猪10只, 雌雄各半, 平均体质量(13± 2.2)kg(10~16 kg), 由广东省医学实验动物中心提供。
1.1.2 模型诱导药物及仪器
大肠埃希氏菌脂多糖(lipopolysaccharides, LPS)(血清型O111:B4, Sigma, 美国), 脉搏指示连续心排出量(pulse-indicated continuous cardiac output, PiCCO)监测仪(PULSION, 德国)、PiCCO动脉导管(PULSION, 德国)、Servo 900C呼吸机(西门子, 德国)、血气分析仪(GEM Premier 3000, 美国)。
1.2.1 动物模型制备
动物做好麻醉前准备后经腹腔注射0.3%戊巴比妥(1~1.5 mg/kg)诱导麻醉, 然后持续静脉注射0.3%戊巴比妥[0.2 μ g/(kg· h)]维持麻醉。以4.5号气管插管建立人工气道, 接呼吸机辅助通气, 通气模式为容控:潮气量8~10 mL/kg, 呼吸频率15~20次/min, 呼气末正压 0 mmHg, 氧浓度 30%~50%。经右颈内静脉置入PiCCO温度传感器、经右股动脉置入PiCCO动脉导管后连接PiCCO监测仪; 右股静脉置入静脉导管进行液体输注。经股静脉导管持续匀速泵入大肠埃希氏菌LPS[200 μ g/(kg· h)]直至模型猪平均动脉压(mean arterial pressure, MAP)下降大于基础值30%时, 表明感染性休克模型制备成功。
1.2.2 血管活性药物干预
感染性休克模型猪制备成功后随机分为阿拉明组和去甲肾上腺素组, 两组模型猪血流动力学稳定1 h后(记为T0)立即进行充分液体复苏等感染性休克集束化治疗[6], 晶体液以20 mL/(kg· h)的速度通过中心静脉输注。其中阿拉明组模型猪在感染性休克集束化治疗的基础上给予阿拉明[0.5~5 μ g/(kg· min)]持续静脉泵入; 去甲肾上腺素组模型猪则予以去甲肾上腺素[0.03~1.5 μ g/(kg· min)]持续静脉泵入, 依据模型的血压情况调整用药剂量, 尽可能使得MAP达到基础水平的90%以上。
1.3.1 指标观察的条件和时间节点
在实验期间予呼吸机辅助通气并根据模型的具体情况进行调节, 使得动脉血氧分压(partial pressure of oxygen, PO2)≥ 90 mmHg, 二氧化碳分压(partial pressure of carbon dioxide, PaCO2)< 45 mmHg。同时根据感染性休克集束化治疗要求, 以MAP达到基础水平的90%以上为目标调整药物剂量, 分别在治疗1/2 h(T1/2)、1 h(T1)、2 h(T2)、3 h(T3)对模型的血流动力学及全身氧代谢指标进行观察记录。
1.3.2 血流动力学指标监测
通过PiCCO监测仪, 观察并记录模型心率(heart rate, HR)、MAP、心排血量(cardiac output, CO)、心指数(cardiac index, CI)、系统血管阻力指数(systemic vascular resistance index, SVRI)。
1.3.3 全身氧代谢指标监测
分别经右股动脉PiCCO导管和中心静脉导管抽取血标本进行血气分析, 测PO2、PaCO2、血氧饱和度(oxygen saturation, SaO2)、混合静脉血氧饱和度(oxygen saturation of mixed venous blood, SvO2)、乳酸、血红蛋白(hemoglobin, Hb)等指标, 通过以下公式计算氧输送指数(oxygen delivery index, DO2I)、氧耗指数(oxygen consumption index, VO2I)、氧摄取率(oxygen extraction rate, O2ext)以及血清乳酸清除率。
DO2I = CO× (1.34× Hb× SaO2)
VO2I = CO× 1.34× Hb× (SaO2-SvO2)
O2ext = VO2I/DO2I
血清乳酸清除率(%)=(治疗前血清乳酸浓度-治疗3 h后血清乳酸浓度)/治疗前血清乳酸浓度× 100%
数据收集后, 采用SPSS 17.0统计软件对数据进行统计分析。计量资料以均数 ± 标准差表示。对于同一组模型, 不同时间节点间的血流动力学、组织氧代谢以及器官灌注的差异采用方差分析。对于造模前后以及同一时间节点, 不同组别之间血流动力学、组织氧代谢的差异采用独立样本t检验。检验水准α =0.05。
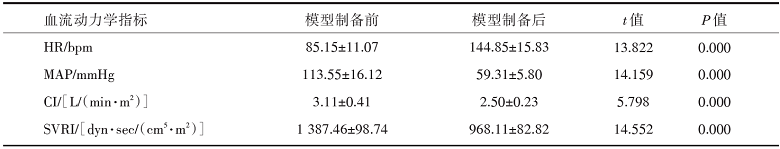
经股静脉持续输注大肠埃希氏菌LPS后, 猪的MAP持续下降, 当MAP下降至基础值的70%时, 提示感染性休克模型制备成功。与模型制备前相比, 模型制备后的HR显著升高, 而MAP、CI、SVRI明显降低, 差异有统计学意义(P=0.000), 表明所制备的模型符合感染性休克模型特点, 见表1。
| 表1 模型制备前后模型猪血流动力学指标的比较 |
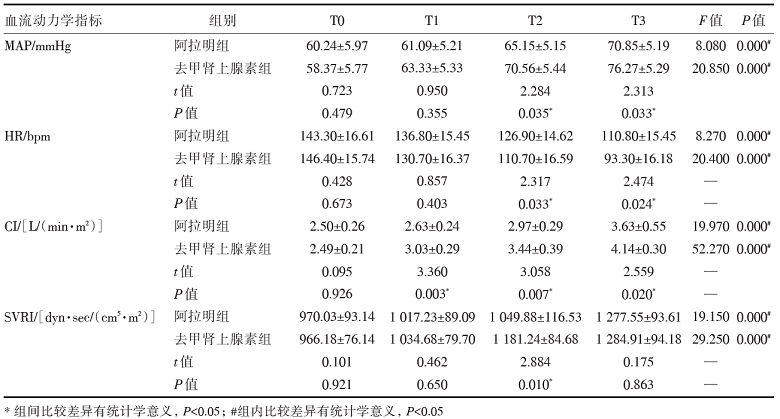
将造模成功的猪随机分为阿拉明组(n=5)和去甲肾上腺素组(n=5)。治疗前, 两组血流动力学指标无统计学差异(P> 0.05)。经血管活性药物干预后两组模型的血流动力学指标均得到显著改善(P=0.000)。去甲肾上腺素组HR、MAP在T2、T3时明显高于阿拉明组, 差异具有统计学意义(P< 0.05); 去甲肾上腺素组SVRI在T2时显著大于阿拉明组, 且差异具有统计学意义(P< 0.05); 去甲肾上腺素组CI在T1、T2、T3时均明显大于阿拉明组(P< 0.05)。表明在改善血流动力学方面, 去甲肾上腺素在起效速度和效果方面均优于阿拉明, 见表2。
| 表2 阿拉明和去甲肾上腺素对感染性休克猪血流动力学的影响 |
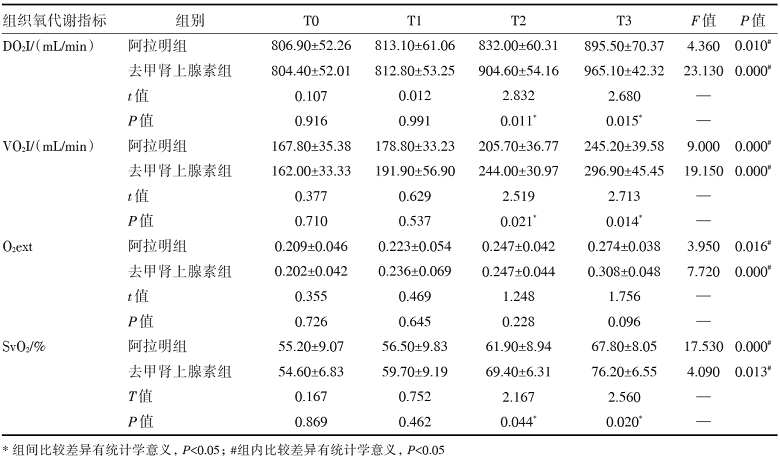
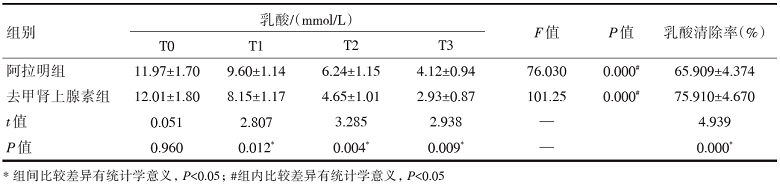
治疗前, 两组组织氧代谢指标无统计学差异(P> 0.05)。经血管活性药物干预后两组模型的组织氧代谢指标DO2I、VO2I、O2ext以及SvO2均得到显著改善(P< 0.05), 血清乳酸水平显著下降(P=0.000)。去甲肾上腺素组DO2I、VO2I以及SvO2在T2、T3均明显大于阿拉明组, 且差异有统计学意义(P< 0.05), O2ext在各时间点差异无统计学意义(P> 0.05)。去甲肾上腺素组乳酸水平在T1、T2、T3时均显著低于阿拉明组(P< 0.05); 在乳酸清除率方面, 去甲肾上腺素组也明显高于阿拉明组(P=0.000)。表明在改善组织氧代谢上, 与阿拉明相比, 去甲肾上腺素效果更为显著, 且起效更为快速, 见表3和表4。
| 表3 阿拉明和去甲肾上腺素对感染性休克猪组织氧代谢的影响 |
| 表4 阿拉明和去甲肾上腺素对感染性休克猪血清乳酸水平及乳酸清除率的影响 |
感染性休克是目前急诊和重症监护面临的难题, 一直是急危重症医学领域的研究热点[7], 近年来, 针对其治疗, 学界制定了相应的治疗指南[6], 但仍旧是急危重症医学面临的巨大挑战。积极充分的液体复苏是感染性休克治疗的基础, 但是, 当感染性休克存在严重的低血压, 甚至危及生命本身时, 即使在低血容量未完全纠正时, 早期应用血管活性药物也能支持生命, 维持组织灌注, 可见血管活性药物是感染性休克复苏过程中的重要一环, 也是目前感染性休克研究的热点之一。
对于感染性休克复苏血管活性药物的选择, 临床上以甲肾上腺素、多巴胺、肾上腺素、苯肾上腺素和阿拉明等应用最为广泛。相关研究显示[8, 9], 去甲肾上腺素和多巴胺的效果明显优于肾上腺素和苯肾上腺素。多巴胺一方面易引发快速性心动过速[10], 另一方面多巴胺能明显降低血浆催乳素水平, 影响生长激素分泌, 降低机体的免疫机能和合成代谢能力, 不利于机体的恢复[11]。不仅如此, Brienza等[12]的研究已经否定了多巴胺对肾脏功能的保护作用, 而且它还能进一步加重肠系膜的缺血缺氧, 加重消化道黏膜的损伤[11]。去甲肾上腺素由于其特有的优势, 已经成为抗感染性休克首选的血管活性药物。但同时也必须认识到去甲肾上腺素存在的不足— — 给药方式相对单一。去甲肾上腺素只能通过静脉输注给药, 但由于感染性休克患者的末梢循环灌注差, 在休克期建立周围静脉通路本身存在一定难度, 而且由于其强烈的血管收缩作用, 应用于外周血管给药时如发生渗漏极易导致周围组织缺血坏死, 临床上较为推荐的给药方式是经中心静脉给药, 实际上感染性休克指南也建议去甲肾上腺素尽可能经中心静脉给药。然而, 建立中心静脉通路是个耗时间的有创性操作, 这在一定程度上影响了去甲肾上腺素在感染性休克早期的应用。
阿拉明主要激动α 受体, 作用效应与去甲肾上腺素相似。其作用较缓和持久, 外渗后不会导致组织坏死; 对心率影响不明显, 较少引起心律失常; 对肾血管的收缩作用较弱, 较少发生少尿和无尿; 应用方便, 可静脉滴注, 也可肌注和皮下注射。阿拉明治疗硬膜外麻醉导致的低血压效果明显[13], 还能用于纠正急性心肌梗死患者的低血压[14]。
本研究结果显示静脉注入大肠埃希氏菌LPS后, 模型猪的HR明显升高, MAP、CI、SVRI明显减低, 符合感染性休克的病理生理特点。血流动力学紊乱, 有效循环血量锐减是感染性休克的重要病理生理改变, 积极充分的液体复苏及尽早的血管活性药物干预是纠正休克的重要手段。本研究结果显示, 随着治疗的推进, 两组模型猪的MAP、CI以及SVRI均得到不同程度的提升, 而HR则逐步下降, 表明在积极液体复苏的同时, 使用阿拉明或去甲肾上腺素均能改善血流动力学紊乱, 提示在感染性休克早期使用阿拉明或去甲肾上腺素均有利于机体血流动力学的稳定。但两者相比较, 去甲肾上腺素能更迅速, 更有效的改善机体的血流动力学指标。
周围组织灌注不足、缺血缺氧是感染性休克的另一特点, 早期复苏的目的之一就是尽早地纠正组织的缺血缺氧。血乳酸是机体无氧酵解的产物, 反映组织氧代谢情况, 乳酸指标的动态监测对感染性休克患者病情的评估及预后具有重大意义[15]。DO2I、V02I、O2ext以及SvO2也是组织氧代谢的重要指标。本研究结果显示, 阿拉明与去甲肾上腺素均能提升机体DO2I、VO2I、O2ext以及SvO2, 降低乳酸水平, 提高乳酸清除率, 能显著改善组织氧代谢, 但与去甲肾上腺素相比, 阿拉明改善组织氧代谢的作用相对滞后, 且疗效相对较差。
总之, 阿拉明与去甲肾上腺素均能在一定程度上改善感染性休克模型猪的血流动力学紊乱、组织氧代谢失衡。两者相比, 去甲肾上腺素更为快速、有效, 提示去甲肾上腺素仍然优于阿拉明。但是, 鉴于多巴胺在心血管、内分泌等多方面的副作用, 去甲肾上腺素外渗后容易导致组织缺血坏死, 而阿拉明作用效应与去甲肾上腺素相似, 且外渗后不会导致组织坏死。因此, 在感染性休克中心静脉通道尚未建立前, 作为去甲肾上腺素的临时替代, 我们的研究提示阿拉明不失为一种可以考虑的替代用药, 但其作用需要临床试验的进一步证实。值得提出的是, 最近有文献提示特利加压素作为治疗感染性休克患者的血管活性药物, 其维持灌注压、对28天病死率的影响等方面与去甲肾上腺素相仿, 加用特利加压素可减少感染性休克患者去甲肾上腺素用量, 且可能有利于改善感染性休克患者的肾功能[16]。因此, 在感染性休克中心静脉通道尚未建立前, 特利加压素的作用值得进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|