| 王长利,主任医师,教授,博士研究生导师,国家级重点专科胸外科学科带头人。中国抗癌协会肺癌专业委员会前任主任委员、CSCO非小细胞肺癌专业委员会副主任委员、天津市抗癌协会肺癌专业委员会主任委员、天津市肺癌诊疗中心主任。 一直从事胸部肿瘤临床外科工作,主要从事肺癌早期诊断、外科治疗、综合治疗及肺癌相关基础研究与临床研究。每年在全国范围开展多次胸腔镜肺癌手术进修班,并面向全国30 多省市举行多次肺癌规范手术及胸腔镜手术演示在线网络直播,对我国肺癌微创手术治疗技术具有重要推进作用。2016 年开展达芬奇机器人系统辅助肺癌微创手术治疗的新技术,开拓了肺部肿瘤外科治疗的新领域。2009 年起开展肺癌驱动基因检测,积极开展分子水平的个体化诊断与治疗,率先进入精准治疗时代。牵头多项全国多中心临床试验。带领学科在国家卫健委全国十佳胸外科排名及中国医院最佳专科声誉胸外科排名中连续多年名列前十。参与制定《CSCO 肺癌指南》、《EGFR 突变和ALK 融合基因阳性非小细胞肺癌的诊断和治疗指南》、《中国间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌诊疗指南》等诊疗规范。在国内外重要期刊发表论文80 余篇,主编《肺癌》、参编《肿瘤手术学》等专著。担任《中华外科杂志》、《癌症》、《中国肺癌杂志》等7 家学术期刊编委会委员。承担国家、市级和局级等各级科研课题多项。 |
Forde PM, Chaft JE, Smith KN, et al. Neoadjuvant PD-1 blockade in resectable lung cancer[J]. N Engl J Med, 2018, 378(21):1976-1986.
1b。
• 在晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者中, 程序性死亡受体1(programmed death 1, PD-1)免疫检查点抑制剂可以启动抗肿瘤免疫, 从而杀死肿瘤细胞并改善生存。
• Ⅰ A期肺癌患者的术后5年生存率为50%, 而Ⅲ 期肺癌患者为20%, 且大多数患者都会术后复发。围手术期用铂类化疗的生存率仅比单纯手术治疗高5.4%, 超过60%的患者发生3级或更高级别的毒性反应。
• 早期肺癌患者的宿主免疫功能较完好且肿瘤的克隆异质性较低, 因此PD-1免疫检查点抑制剂用于早期肺癌患者可能获得较好的抗肿瘤效果。但是目前PD-1免疫检查点抑制剂在可切除NSCLC中的研究尚未开展。
探讨PD-1免疫检查点抑制剂新辅助免疫治疗的安全性和可行性。
• 研究条件: 美国癌症中心研究所资助2个中心参加的临床研究(NCT02259621)。
• 研究起止时间:2014-09-18至2018-10-05。
• 研究方法:多中心、非随机、非盲、前瞻性Ⅱ 期临床试验。
• 研究对象:患者年龄≥ 18岁, 入组前诊断为可手术切除的Ⅰ ~Ⅲ A期NSCLC。所有患者的东部肿瘤协作组体能状态评分为0或1分, 器官功能正常且肺功能正常。主要排除标准包括免疫缺陷、正在进行的全身性免疫抑制治疗、活动性自身免疫或感染性疾病以及临床上显著的并发症。
• 干预措施:入组患者接受Nivolumab(Nivo)3 mg/kg治疗, 每2周静脉给药1次, 共治疗2次, 计划在第1次给药约4周后进行手术。
• 评价指标:主要终点指标是安全性(药物相关不良反应)和可行性。次要终点指标和探索性终点指标是治疗后的影像学评估和病理缓解, 以及血液和肿瘤缓解的免疫、基因组与病理相关因素。
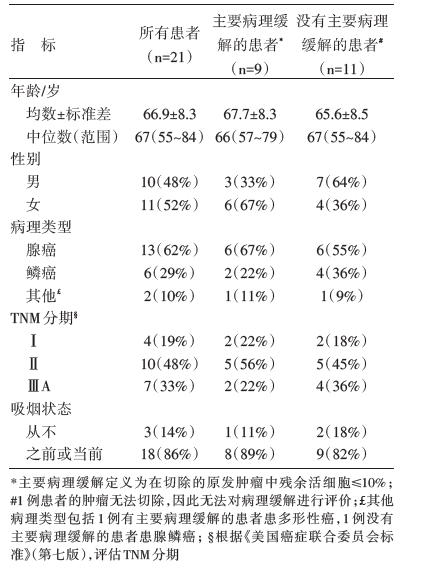
2015年8月至2016年10月, 共纳入22例患者, 所有患者均接受了至少1次Nivo治疗, 由于其中1例患者病理确诊为小细胞肺癌, 终止了研究治疗。剩余21例均符合入选本研究的条件。患者的基线特征见表1。
| 表1 根据病理缓解分类的患者基线特征 |
在安全性和可行性方面, Nivo新辅助治疗毒副作用少, 没有治疗相关的手术延迟。95%患者肿瘤被完全切除, 其中1例Ⅲ A期NSCLC患者在手术期间被发现有气管肿瘤浸润, 因此未能完全切除肿瘤。
21例患者的影像学评估中, 2例(10%)患者部分缓解, 18例(86%)患者疾病稳定, 1例(5%)患者疾病进展。在接受切除手术的20例患者中, 8例(40%)患者在新辅助治疗后病理分期降级。
术后中位随访期为12个月(范围:0.8~19.7个月), 80%的接受切除术的患者生存且无复发, 18个月的无复发生存率为73%(95%可信区间53%~100%)。
在20例标本可评价的患者中, 9例(45%, 95%可信区间23%~68%)有主要病理缓解。在PD-1阳性和PD-1阴性的肿瘤中均出现主要病理缓解。
对1例有主要病理缓解的患者进行多重免疫荧光分析发现, 与治疗前活检标本相比, 术后组织标本高表达CD8+T细胞, 并且免疫细胞上程序性死亡受体配体1(programmed death ligand 1, PD-L1)表达较高, 与适应性PD-L1上调机制一致。
对有足够组织标本的12例患者行全外显子组测序, 观察到每个肿瘤体细胞的突变中位数为92个(范围:5~366), 并发现了特定的驱动突变, 包括TP53、KRAS、CDKN2A、ARID1A、NOTCH1和RB1, 这些结果与以往的结果一致。
与没有主要病理缓解的肿瘤相比, 主要病理缓解肿瘤的突变负荷 (均数值± SE)较高 [(311± 55) vs. (74± 60), Wilcoxon检验P=0.01], 序列改变数量与肿瘤残留率成反比。突变负荷与肿瘤PD-L1表达无明显相关性。突变相关的新抗原是从治疗前肿瘤体细胞变异中计算预测的, 因此与突变负荷成正比。突变相关的新抗原负荷与病理缓解之间存在相关性。
特定基因或基因通路(包括RAS信号、DNA修复和干扰素-γ )的潜在富集情况没有发现差异。免疫相关基因包括CD274、PDCD1、CTLA4、B2M和HLA没有变化, JAK1和HLA也没有出现失活突变。
通过对T细胞受体(T-cell receptor, TCR)-β 链CDR3区进行深度测序, 发现主要病理缓解的肿瘤内外周隔室共有的T细胞克隆频率和T细胞群的克隆性高于没有主要病理缓解的肿瘤。
9例行TCR测序的患者在治疗前后有血液标本, 其中8例患者许多克隆在治疗前没有在外周血中检测到, 治疗后外周血中发现多个T细胞克隆, 在切除的肿瘤中也有发现。
采用细胞上47种算法预测的突变相关新抗原进行一项抗原识别分析, 在独立平行刺激下, 在PD-1抗体治疗开始后, 外周血突变相关的新抗原特异性T细胞克隆发生短暂扩增。
Nivo在NSCLC新辅助治疗中副作用少, 不会导致手术延迟, 在45%的切除肿瘤患者中出现了主要病理缓解。肿瘤突变负荷可预测PD-1抗体治疗后的病理缓解。PD-1抗体治疗后可诱导外周血突变相关的新抗原特异性T细胞的克隆扩增。
《Neoadjuvant PD-1 Blockade in Resectable Lung Cancer》是一项免疫检查点抑制剂Nivo用于可手术NSCLC新辅助免疫治疗的临床研究, 其研究结果首次于2018年在AACR大会上公布亮相, 并于2018年4月同步发表于《N Engl J Med》。该研究共计纳入22例可切除NSCLC(Ⅰ ~Ⅲ A期)患者, 术前给予Nivo 3 mg/kg, 每2周静脉给药1次, 共治疗2次, 在第二次给药后4周左右完成评估进行手术切除。主要研究终点指标为安全性和可行性, 探索性研究终点指标包括病理缓解情况、PD-L1表达、肿瘤突变负荷以及突变相关新抗原特异性T细胞反应。
从安全性看, Nivo新辅助免疫治疗后并没有出现以往未经报道的免疫相关毒副作用, 22例患者中, 5例(23%)患者出现治疗相关不良事件, 且只有1例为3级及以上不良事件; 从可行性看, 所有患者经术前Nivo新辅助免疫治疗后都未造成手术延迟; 该研究21例患者接受手术切除, 20例患者达到完全切除, 达到了主要研究终点。术后病理学分析9例(45%)患者达到主要病理缓解; 进一步亚组分析结果显示:对15例患者治疗前组织标本进行PD-L1表达分析结果发现, 即使是术前肿瘤组织PD-L1表达阴性的患者, 对Nivo新辅助免疫治疗依然有应答; 对11例患者组织标本测序结果发现, 达到主要病理缓解的患者相对肿瘤突变负荷更高, 且两者相关性很高; 对9例患者TCR测序结果发现, 达到主要病理缓解的患者其肿瘤组织和外周血中检测到更多的功能性T细胞克隆。截止到2018年4月该研究公布的总生存随访结果显示, 除了1例不可切除的患者、1例肿瘤复发性死亡和1例由于创伤综合征导致的非肿瘤或治疗相关性死亡以外, 其他患者仍存活。
Nivo应用于可手术NSCLC的这项新辅助免疫治疗确实具有划时代里程碑式的意义, 但也同时存在不可避免的局限性。
(1)设计的合理性。该研究从总体设计角度看是合理的, 主要表现在以安全性及可行性作为主要终点指标; 特别是探索性终点的设置为研究增色不少, 突出了免疫治疗的特殊意义, 从免疫原理、分子机制等方面进一步阐释证实了新辅助免疫治疗的合理性及可行性。
(2)结论的可靠性。该研究结论可靠。研究初步体现了新辅助免疫治疗的潜力, Nivo单药新辅助免疫治疗达到45%的主要病理缓解率, 明显高于其应用于晚期治疗最大22.2%的主要病理缓解率 [1]。新辅助免疫治疗和晚期免疫治疗两类研究的临床研究设计和疾病负荷等各种因素并不相同, 在基于鼠模型的免疫新辅助和辅助治疗效力对比中, 也能看到新辅助免疫治疗可能产生更强大的肿瘤特异性免疫反应[2]。在这项研究中, 病理缓解率和治疗前肿瘤突变负荷具有强相关性。治疗后在切除的肿瘤、淋巴结和外周血中均检测到增多的肿瘤特异性T细胞克隆, 从而进一步支持新辅助免疫治疗可以带来比较高(45%)的主要病理缓解率。该临床研究结论同样在小鼠体内动物模型研究中也得到确认, 新辅助免疫治疗在小鼠体内动物模型中18个月时的无复发生存率高达73%[3, 4]。
(3)尚存的不足。①没有针对新辅助免疫治疗优势人群进行筛选。该研究也未将EGFR突变和ALK融合基因等具有敏感突变的肺癌患者排除在外, 尽管在新辅助免疫治疗中是否有必要排除驱动基因阳性的患者尚存在争议, 但之前的一些研究我们已经看到驱动基因阳性患者对于免疫检查点抑制剂治疗的应答率低[5]。②方案中没有引入辅助免疫治疗的概念, 没有充分体现免疫治疗在真实世界临床实践中的优势。③样本量小但入组患者的选择范围大。Ⅰ ~Ⅲ A期, 而不是临床实践真实世界中更为关注的Ⅱ ~Ⅲ A期特别是Ⅲ A期的患者, 似乎也与实际临床实践有些出入。④对于本研究中提到的免疫应答相关突变、新抗原和T细胞克隆检测方法, 还需要在更加标准化检测方法指导下, 确保不同临床试验分析结果的准确性和一致性[6]。有观点认为应该进一步分析血液中抗原递呈细胞的PD-L1表达, 通过流式细胞方法检测外周血树突状细胞中PD-L1表达情况。曾有研究对比初治的38例NSCLC患者和21例非肿瘤患者[7], NSCLC患者外周血浆中类树突和骨髓类细胞的PD-L1受体和OX40配体均过表达, 推论可能促进肿瘤特异性T细胞扩增[8]。有研究者因此假定本篇文章中T细胞的扩增是由于树突状细胞驱动PD-L1受体和OX40配体过表达, 推论可能是导致免疫治疗相关不良事件的原因[9]。⑤该研究对新辅助免疫治疗能否预防NSCLC的复发以及能否延长NSCLC的总生存期还没有给出明确的答案。 现在并不清楚新辅助免疫治疗是否可以预防肿瘤复发, 对于复发的肿瘤是否仍存在免疫检查点抑制剂的应答能力, 复发的肿瘤是否会出现具有挑战性的耐药途径, 患者总体生存率是否提高, 这些问题均没有给出明确答案。目前正在开展的NSCLC患者新辅助免疫治疗的Ⅲ 期临床试验也许将最终提供给我们更清晰的答案[10]。
(4)我们在临床实践中应用这些结论时应注意的问题。目前, 我们还不能仅仅依据这个小规模的单臂临床研究得出的结论就应用于临床实践, 该研究的设计令人印象深刻的地方是探索性终点设计; 现在几个大型的免疫单药或联合化疗的新辅助/辅助临床研究正在进行[11]。我们希望得到更加可靠的安全性和疗效数据。从外科手术角度, 以往新辅助治疗的目的是为了缩小肿瘤以利于肿瘤完整切除, 新辅助免疫治疗尽管主要病理缓解率相当高, 但存在与影像学缓解率不相符并有一定比例的假性进展, 这需要准确的判断; 同时, 新辅助免疫治疗后胸腔内“ 粘连” 明显, 特别是假性进展患者增加了手术难度。
未来新辅助免疫治疗的发展方向, 一方面是需要筛选敏感人群, 并探索联合治疗方式; 更重要的是要看安全性和疗效。长风破浪会有时, 直挂云帆济沧海, 我们相信新辅助免疫治疗未来会有更加广阔和光明的前景。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|