| 陈克能,北京大学肿瘤医院胸外一科主任,主任医师,教授,博士研究生导师,中国医师协会胸外科医师分会副会长,中国抗癌协会食管癌专业委员会副主任委员、青年委员会主任委员,中国临床肿瘤学会非小细胞肺癌专业委员会常务委员,中国抗癌协会肺癌专业委员会委员,吴阶平基金会模拟医学部胸外科专业委员会副主任委员,美国胸外科协会(AATS)active member 、英国皇家外科学院(RCS)fellow、《中国肺癌杂志》副主编、《肿瘤综合治疗电子杂志》副主编 、 《Ann Thorac Surg》及《J Thorac Cardiovasc Surg》等中外10余种专业期刊编委,主要致力于肺癌与食管癌微创外科技术、围术期综合治疗与临床转化研究。 |
Zhong WZ, Wu YL, Chen KN, et al. CTONG 1103: Erlotinib versus Gemcitabine plus Cisplatin as neoadjuvant treatment for stage Ⅲ A-N2 EGFR-mutation positive non-small-cell lung cancer (EMERGING): A randomised study [J]. Ann Oncol, 2018, 29(8S): LBA48_PR.
1b。
• Ⅲ A-N2期非小细胞肺癌(non-small-cell lung cancer, NSCLC)具有相当大的异质性, 根据同侧纵隔淋巴结受累程度不同分为Ⅲ A1~Ⅲ A4 (Robinson分类), 而目前治疗方案各异, 包括放化疗、手术切除后化疗、新辅助治疗后手术切除。
• ADJUVANT试验结果提示, 对于EGFR突变阳性患者, 与一线标准化疗相比, 术后吉非替尼辅助治疗可显著延长无病生存期(disease-free survival, DFS)10.4个月。
• 局部晚期伴EGFR突变NSCLC患者, 新辅助靶向治疗的疗效尚不明确。
比较厄洛替尼新辅助治疗局部晚期EGFR突变阳性NSCLC患者的疗效是否优于吉西他滨(Gemcitabine, G)/顺铂(Cisplatin, C)化疗方案。
• 研究条件:中国胸部肿瘤研究协作组临床试验协作项目(EMERGING-CTONG 1103; NCT01407822)。
• 研究方法:多中心、Ⅱ 期、随机对照临床试验。
• 研究时间:2011年12月至2017年12月纳入患者。
• 研究对象:初治Ⅲ A-N2期NSCLC患者; N2分期通过纵隔内镜活检、支气管超声内镜、PET/CT确诊, EGFR突变阳性, ECOG评分0~1分, 年龄≥ 18岁。
• 干预措施:入组患者按1∶ 1比例随机分配到厄洛替尼组(37例)和GC化疗组(35例), 研究流程见图1。
• 评价指标:主要终点指标为客观缓解率(objective response rate, ORR); 次要终点指标包括病理淋巴结降期率, 病理完全缓解率(pathological complete response, pCR), 无进展生存期(progression-free survival, PFS), 3年和5年总生存率(overall survival, OS), 安全性和耐受性。
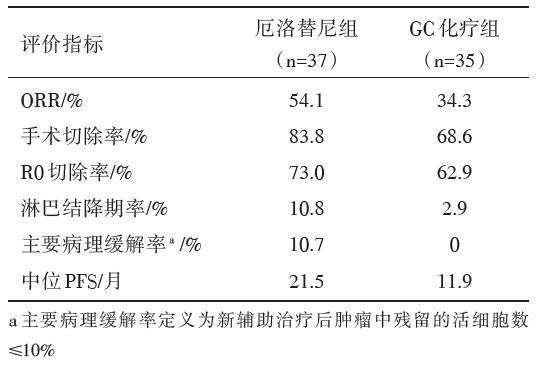
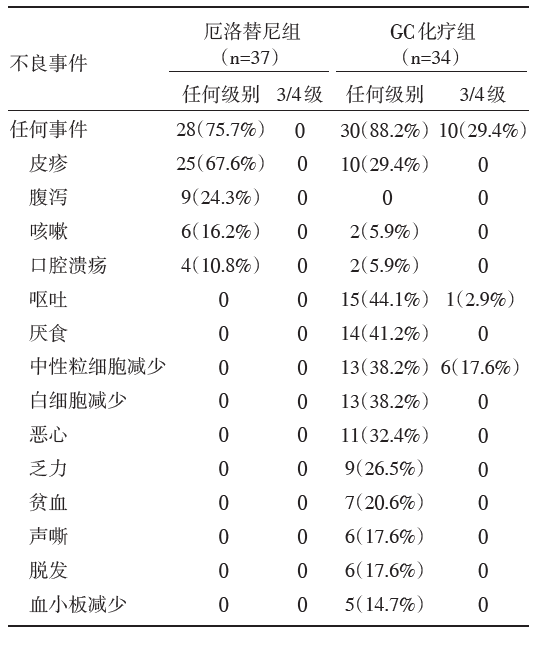
共入组Ⅲ A-N2期NSCLC患者72例。中位随访时间为28.7个月。新辅助厄洛替尼组患者的ORR较化疗组有改善, 但差异不显著(54.1% vs. 34.3%, P=0.092)。疗效评价和毒副反应情况见表1和表2。
| 表1 CTONG 1103 研究中两组患者的疗效比较 |
| 表2 CTONG 1103 研究中新辅助治疗的毒副反应 |
厄洛替尼新辅助治疗较GC化疗延长了PFS, 但OS数据未成熟, 毒副反应与既往报道相符。Ⅲ A-N2期NSCLC生物标志物指导的新辅助治疗道路仍需探索。
Ⅲ A-N2期NSCLC因预后不尽相似, 相应解剖学上又分为Ⅲ A1~Ⅲ A4(Robinson分型), 治疗方法也各不相同。目前, 所谓“ 隐匿性” Ⅲ A-N2期与N1期的长期生存相近, 建议直接手术切除; 巨块型淋巴结转移的Ⅲ A-N2期并不推荐外科治疗[1]。因此, 有手术参与的仅为单站及多站Ⅲ A-N2期, 多数认为标准治疗方法需要围术期综合治疗(全身化疗± 放疗), 并且倾向于术前治疗。鉴于靶向治疗在晚期NSCLC中取得的辉煌成绩, 容易让大家联想并试图探讨术前诱导靶向治疗的可行性。EMERGING-CTONG 1103研究正是基于这种假设开展的临床研究, 旨在提出术前诱导靶向药物治疗理念并且验证是否值得继续进行探究。
该研究入组标准严格, 限定为潜在可切除并且术前病理(多数)或功能影像学证实的Ⅲ A-N2期NSCLC(Ⅲ A2~Ⅲ A3), 此类患者预后不同于临床评估隐匿性Ⅲ A-N2期(即术前未诊断, 术后病理诊断)NSCLC的较好预后, 但同时仍存在根治机会, 是当前临床挑战最大的Ⅲ A-N2期亚型。此外, 所有患者均行病理活检并且基因检测证实为EGFR敏感突变(19或21外显子)。筛选期经过全身PET/CT及头颅MRI检查排除远处转移, 患者被随机分为两组:试验组接受EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)厄洛替尼治疗2周期(42天); 对照组采用传统的吉西他滨/顺铂(GC)化疗方案治疗2周期(42天)。诱导治疗后经各中心胸外科医师评估外科可切除性, 根治性切除术后继续行EGFR TKI(厄洛替尼)治疗1年或GC方案辅助化疗2 周期。该研究的终点指标为术前诱导治疗的ORR, 结果发现EGFR TKI组的ORR具有优于GC化疗组的趋势, 但是差异未达到统计学意义(54.1% vs. 34.3%, P=0.092), 并且手术率(83.8% vs. 68.6%)、根治性切除率(73.0% vs. 62.9%)、淋巴结降期率(10.8% vs. 2.9%)、主要病理缓解率(10.7% vs. 0%)等指标也具有一定优势; 对于术后PFS, EGFR TKI组相比GC化疗组显著提高(21.5个月 vs. 11.9个月, 风险比0.42, 95%可信区间0.23~0.78, P=0.003)。
在药物安全性方面, EGFR TKI组术前新辅助治疗期间未发生严重毒副作用; GC化疗组3~4级毒副反应发生率则为29.4%; 术后辅助治疗期间EGFR TKI组两组3~4级毒副反应发生率也低于GC化疗组(13.5% vs. 29.4%)。术后辅助靶向治疗期间常见不良反应包括:药物相关皮疹、腹泻、气短、肝功能异常。围术期EGFR TKI药物治疗后严重毒副作用风险随疗程延长而逐渐升高。
乍一看本研究的主要研究终点指标未达到统计学意义, 这其中的可能原因有样本量不足的问题, 经历6年时间最终入组72例患者, 低于预期目标(90例); 但是其一系列次要研究终点指标结果仍不失良好表现, GC化疗组的手术切除率低于EGFR TKI靶向治疗组, 可能与诱导治疗后ORR低以及毒副反应严重有关; 无独有偶, EGFR TKI靶向治疗组的主要病理缓解率也明显优于GC化疗组, 尽管同既往诱导化疗文献的数据报道不符, 但是仍说明靶向治疗有着不菲的诱导治疗成效。
该研究存在一些不足:①目前对肺癌术前纵隔淋巴结的病理分期无论在我国还是欧洲国家均不理想[2, 3], 对于直径大于3 cm或中心型肿瘤, 无论术前影像学评估是否有可测量的纵隔肿大淋巴结均应行有创性检查(超声内镜引导下的经支气管针吸活检术或纵隔镜下淋巴结活检术)以明确病理N分期[4], 而在EMERGING-CTONG 1103研究中, 约30%患者通过PET/CT诊断Ⅲ A-N2期NSCLC, PET/CT诊断纵隔淋巴结转移的敏感度0.77~0.81、特异度0.79~0.90[5, 6], 其中存在有假阳性诊断风险; ②术前诱导靶向治疗的最佳时程尚不明确, 6周EGFR TKI诱导治疗是否足量尚待验证, 因此可能存在诱导靶向治疗不足的问题; ③该研究尚未报道诱导治疗后未行手术治疗的原因以及围术期并发症发生率, 而这些信息对于全面解读目前的结果是必要的。
EMERGING-CTONG 1103研究是在当今肺癌分子靶向药物精准治疗趋势下, 继CTONG 1104/ADJUVANT[7]及EVAN[8]研究之后, 对局部晚期NSCLC围术期综合治疗策略的另一项探索。新辅助治疗的理论依据是在相对较短时间内使患者得到缓解, 提高手术切除率并清除潜在的微转移灶, 以期改善术后长期生存。与此同时, 目前术前诱导ALK靶向治疗研究也已有探索[9], 围术期多学科综合治疗将传统单纯影像学导向转化为分子标志物导向的“ 精准医疗” 时代。在新辅助治疗的药物选择方面, 除了靶向治疗, 目前还有程序性死亡受体1(programmed death 1, PD-1)检查点抑制剂免疫治疗, 初步研究提示病理缓解率高[10]。此项前瞻性Ⅱ 期随机对照临床研究结果为今后改变可手术的局部晚期NSCLC围术期综合治疗模式提供了新的临床证据, 说明EGFR TKI药物可在EGFR基因敏感突变型Ⅲ A-N2期NSCLC患者的围术期综合治疗策略中占有一席之地。期待其术后长期生存结果以及复发转移模式特征数据公布, 为进一步精细划分获益人群, 实施个体化治疗提供依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|