| 杨帆,北京大学人民医院胸外科副主任、主任医师、 副教授,医学博士,美国图兰大学癌症中心博士后,主要研究方向为肺癌的个体化治疗和靶向治疗中华医学会胸心血管外科分会青年委员会秘书长,中国临床肿瘤学会非小细胞专业委员会常务委员, 中国医学教育协会肺部肿瘤专业委员会委员,中国研究型医院学会精准医学与肿瘤MDT专业委员会青年委员会副主任委员,北京市医学奖励基金会肺癌青年委员会副主任委员、外科组组长《PLoS ONE》和《Lung Cancer》杂志编委 |
Pennell NA, Neal JW, Chaft JE, et al. SELECT: A phaseⅡ trial of adjuvant Erlotinib in patients with resected epidermal growth factor receptor-mutant non-small-cell lung cancer [J]. J Clin Oncol, 2019, 37(2): 97-104.
1b。
早期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者手术完全切除后仍可能会复发, 这使得应用辅助治疗方法清除癌细胞成为迫切的临床需求。尽管基于铂类药物的传统化疗方法治疗晚期肺癌和用于辅助治疗效果有限, 随着靶向治疗的异军突起, 我们发现表皮生长因子受体(epidermal growth factor receptor, EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)厄洛替尼在EGFR突变型晚期NSCLC患者中的治疗效果优异, 而对早期NSCLC患者厄洛替尼辅助治疗的效果尚不明确。
评估厄洛替尼辅助治疗在可手术切除Ⅰ A~Ⅲ A 期(第7版TNM分期)EGFR敏感突变NSCLC患者中的疗效和安全性。
• 研究条件:美国7个中心参加的SELECT临床研究(NCT02193282)。
• 研究时间: 2008-2017年。
• 研究方法:多中心、开放性、单臂、Ⅱ 期临床试验。
• 研究对象:完全切除的Ⅰ A~Ⅲ A期EGFR敏感突变NSCLC患者, 已按计划完成辅助化疗; 无论是否接受放疗; 年龄不小于18岁; 如果术后进行辅助化疗和放疗, 手术切除必须在入组前9个月内完成; 如果术后只进行辅助化疗, 手术切除必须在6个月内完成, 并且患者需要从辅助治疗的毒性反应中恢复。排除既往接受过EGFR TKI治疗的患者以及已知间质性肺疾病患者。
• 干预措施:在已完成计划辅助化疗(无论有无接受放疗)的基础上, 口服厄洛替尼150 mg/d, 持续2年。出现毒副反应可以酬情减少剂量。2年疗程结束、疾病复发、毒性停药、撤回知情同意书或随访失败, 则治疗停止, SELECT临床研究的流程见图1。
• 评价指标:主要研究终点指标为2年无病生存率(disease-free survival, DFS), 次要研究终点是安全性、耐受性和总生存率(overall survival, OS)。
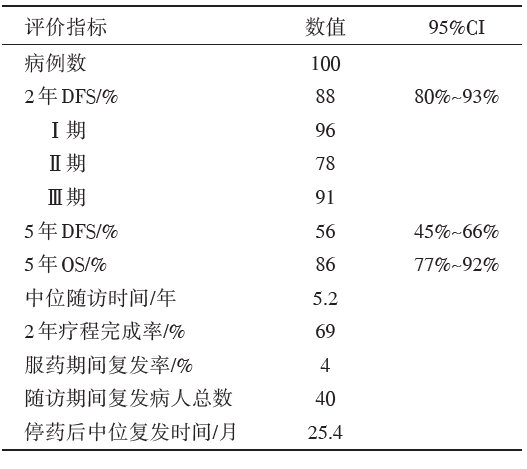
入组完全切除的Ⅰ A~Ⅲ A期EGFR突变NSCLC患者100例。中位随访5.2年, 2年DFS为88%[95%可信区间(confidence interval, CI)80%~93%], 明显高于历史对照数据76%(P=0.004 7)。40%的患者剂量减少到100 mg/d, 16%的患者减少到50 mg/d。69%的患者完成计划的2年疗程。一共有40例患者复发, 但在厄洛替尼治疗期间只有4例复发。停止厄洛替尼治疗后, 中位复发时间25.4个月。复发患者中24例接受再活检, 结果显示, 只有1例患者检测到T790M突变。主要终点指标和不良反应事件见表1和表2。
| 表1 SELECT 研究的主要终点指标 |
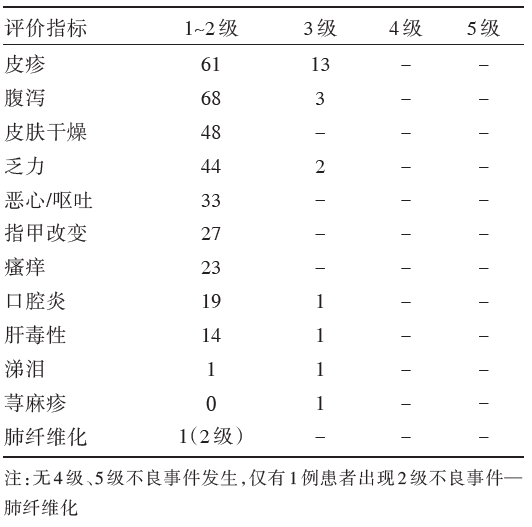
| 表2 SELECT 研究的不良事件发生率% |
100例患者中, 有69例患者完成了2年的治疗计划, 未完成2年治疗计划的共有31例患者, 复发的40例中, 未完成2年治疗计划的有17例, 见表3。复发患者接受辅助厄洛替尼治疗的时间明显短于未复发患者(Wilcoxon 秩和检验P=0.027)。
| 表3 患者的服药时间和复发情况 |
40例复发的患者中, 24例(60%)进行了再次活检, 20例患者得到基因检测结果, 且均携带最初的EGFR突变, 仅1例(5%)获得了T790M突变(在厄洛替尼治疗过程中)。26例(65%)复发患者再次使用厄洛替尼, 中位治疗时间为13.1个月(0~62个月), 至数据截止时, 9名患者仍在接受厄洛替尼治疗。
与既往基因型匹配的历史对照组相比, 应用厄洛替尼辅助治疗EGFR突变的NSCLC患者, 2年DFS得到改善。接受厄洛替尼辅助治疗的患者很少复发, 复发后再次接受厄洛替尼治疗的患者可获得持久的临床受益。
相比于晚期NSCLC治疗的风起云涌、新药辈出, 可手术NSCLC领域却落寞多年。含顺铂双药方案的辅助化疗, 作为唯一被证实可延长完全切除患者总生存期的治疗手段, 尽管代价巨大且获益有限, 却独占标准治疗推荐的排行榜逾十余年。因此, 把晚期肺癌有效药物的应用拓展到术后患者, 让晚期领域比细胞毒化疗更优效的药物去替代或者补充辅助化疗的不足, 是一个必然的探索方向。这其中, EGFR TKI挟着潜在获益患者群巨大的优势, 是当仁不让的排头兵。
类似EGFR TKI在晚期肺癌领域走过的从盲目到精准的曲折路程, 其在术后患者的探索也是一波三折。
2002年启动的NCIC CTG BR19研究是第一项尝试辅助EGFR TKI的随机对照研究(randomized controlled trial, RCT), 入组的是无选择的西方国家NSCLC患者, 计划是2年的吉非替尼对比安慰剂, 却在ISEL研究失败阴影下中途折戟、草草收场, 中位TKI使用时间仅4.8个月[1]。第二项RCT是2006年开始入组的RADIANT研究[2], 基于当时的认识, 该研究定位于免疫组化染色的EGFR表达阳性或荧光原位杂交的EGFR基因扩增患者群, 虽迷途知返, 事后(post hoc)分析了EGFR突变阳性的患者亚组, 但突变阳性患者入组不均衡, 特别是分期不均衡, 使得解读难上加难(post hoc分析加上不均衡)。在此之后, 2008年1月启动的SELECT研究, 是第一项在EGFR突变患者群中进行TKI辅助治疗的临床研究, 是前述两项“ 囿于时代” 的RCT之后第一次在正确的患者中寻求答案的临床研究, 并达到了预设的提高2年DFS 10%的目标, 具有里程碑式的意义[3]。美中不足的是其单臂的设计, 无法进行疗效的对比。
转眼已是2019年了, 疗效对比问题已经有了初步的答案。划时代的数据来自吴一龙教授牵头的ADJUVANT(CTONG 1104)研究[4], 这是一项Ⅲ 期研究, 第一次在EGFR突变患者群中头对头对比了辅助EGFR TKI和化疗, 证实术后2年TKI治疗是可行的, 而且对比辅助化疗, 延长了N1/N2阳性患者的无病生存期达10.7个月(28.7个月 vs. 18.0个月, 风险比0.6, P=0.005 4), 达到了主要终点。在安全性方面, 与晚期患者数据类似, TKI有更好的耐受性和更小比例及程度的不良反应[4]。另一项类似设计的RCT是王长利教授主持的EVAN研究, 这是一项Ⅱ 期研究, 样本量较小且仅限于N2的患者, 但其数据非常好地验证了ADJUVANT研究的结论(DFS的风险比0.268, P< 0.001)[5]。在此之前, 还有一项由王思愚教授开展的小样本Ⅱ 期研究, 60例EGFR突变的N2转移的手术患者, 在结束4周期培美曲塞联合卡铂辅助化疗后, 随机接受6个月的TKI治疗或安慰剂。研究报告了术后2年的DFS和OS, 均观察到TKI组的获益[6]。
这几项新的RCT, 让今天的认识和眼界与SELECT研究时代已不可同日而语, 现在关注和争论的热点, 已经是OS是否获益以及可能的优化辅助TKI治疗的问题。SELECT作为单臂研究显然无法回答这些疑问, 但得益于长达5.2年的中位随访和相对详细的患者后续治疗情况, 两个有意思的观察提供了一些“ 遐想” 的素材。当然, “ 遐想” 的根基是“ 新现象“ 的客观性、稳健性, 否则就是一步之遥的“ 瞎想” 了。
第一个有趣的发现是复发患者的辅助TKI用药时间显著短于无复发患者(Wilcoxon秩和检验P=0.027), 也就是长时间TKI治疗似乎能减少复发[3]。这是首次报告的现象, 如果这种关联确实客观存在, 能带来两个推测。其一是关于TKI辅助治疗的时长。在乳腺癌辅助治疗领域, 已经明确10年内分泌治疗比5年有更好的生存获益。胃肠间质瘤的伊马替尼辅助治疗, 也是3年比1年生存更优。肺癌的辅助EGFR TKI治疗, 是否也是应该时间更长?今天各研究中“ 主流” 的2年, 是否存在治疗不足?另一个联想是关于总生存时间。如一些学者所担心的, 认为辅助TKI仅仅是用药推迟复发、停药复发, 则经过较长时间(SELECT研究的中位随访5.2年)后, 复发与否应该与用药时长无关。SELECT研究观察到的负相关, 似乎提示长时间TKI可以降低复发, 而非仅仅延缓和推迟复发。倘若此现象和推测都成立, OS的获益就该是“ 情理之中” 了。
第二个值得引申一下的是关于复发患者再次活检和再次治疗的数据:SELECT研究中24例复发患者接受了再次活检, 得到基因检测结果的20例患者全部均携带最初的EGFR敏感突变基因, 其中仅1例辅助TKI用药阶段复发的患者检出T790M突变。共有26例复发患者再次接受了厄洛替尼治疗, 中位治疗时间13.1个月[3]。虽然不是经过影像学评价的无进展生存期(progression-free survival, PFS), 但13.1个月显然不劣于厄洛替尼在初治晚期NSCLC患者中的PFS数据。这一现象不是首次报告, 在SELECT研究之前, 一项来自纪念斯隆凯特琳肿瘤(MSKCC)中心的回顾性研究, 也有类似的发现[7]。这里也可以有两个推测。其一, 关于辅助TKI的争论中, 有担忧 “ 注定” 复发的患者接受提早的TKI(辅助)会导致提早耐药的发生[8, 9]。SELECT研究为消除这一担忧提供了新鲜数据。回顾RADIANT研究突变亚组的DFS曲线和刚刚发表的ADJUVANT研究中复发情况的分析, 也均显示复发主要发生在TKI停药后, 而非24个月的TKI辅助阶段[2, 10]。第二个联想是关于辅助TKI的另一个争议点, 即辅助TKI治疗是否只能推迟复发但无法改善OS[11]。但如果SELECT的复发后治疗数据在RCT中得到印证, TKI辅助治疗后复发再次接受TKI治疗仍可以获得类似初治的PFS, 则辅助阶段的疾病控制将成为“ 额外” 的收获, 辅助TKI带来的DFS获益可以“ 全盘” 转化为OS获益。而且, 如果这一推测成立, 适当延长疗程的辅助TKI(但并非使用至复发), 使得DFS尽可能长但不至于改变复发后的PFS, 也许可使OS获益最大化。
SELECT研究的两个有趣发现推广开, 都不免涉及到辅助TKI疗程的问题。遗憾的是, 现在进行中的各主要辅助EGFR TKI的RCT, 除了ADAURA研究是3年的奥西替尼对比安慰剂, 绝大多数都是用药2年。肺癌辅助TKI不同疗程对比问题, 在相当长时间内得不到回答。而且, 延长辅助TKI疗程不单是涉及生存获益, 还牵涉到卫生经济学、长期治疗毒性、耐受性以及可能存在的过度治疗问题。这其中的耐受性, SELECT研究也提供了有益的数据。现有4项2年辅助TKI的研究中, ADJUVANT是唯一使用吉非替尼的研究, 中位TKI用药21.9个月, 仅11%患者需要减量[4]。使用厄洛替尼的研究中, SELECT的中位TKI治疗时间23个月, 但40%患者需要减量至100 mg/d, 16%患者需要再次减量至50 mg/d。RADIANT研究中厄洛替尼组中位用药时间仅11.9个月, 44.4%的患者需要减量; EGFR突变亚组TKI治疗时间21.2个月, 46%患者需要减量[2]。EVAN研究中的厄洛替尼耐受性稍好, 但是TKI组仅50位患者, 中位治疗时间23.9个月, 有20%的患者需要减量或终止治疗[5]。可以看到, 一代EGFR TKI耐受性不尽如人意, 特别是部分研究中接近半数的患者需减量。未来如果需要延长辅助治疗时间, 耐受性将成为重要考虑因素。写到这里, 不由想起了耐受性更好、血脑屏障透过能力更强、治疗时间更长的ADAURA— — 奥西替尼辅助治疗研究。
推测归推测、联想归联想, 循证医学所依据的还是数据和证据。未来可期、前景可待, 期待着OS数据的成熟, 期待着更多RCT的补充和印证, 给今天的争论做一个结论。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|