| 王志杰,中国医学科学院肿瘤医院内科副主任医师,肿瘤学博士,硕士研究生导师,主要研究方向为基于分子分型的肺癌个体化诊疗中国临床肿瘤学会(CSCO)非小细胞肺癌专家委员会委员,CSCO青年专家委员会委员,中国抗癌协会肺癌专家委员会青年委员会副主任委员,北京医学奖励基金会肺癌青年专家委员会常委、内科学组副组长,中国抗癌协会肿瘤药物临床研究专家委员会青年委员,中国医促会控烟和肺癌防治专业委员会委员,国家自然科学基金评审专家以第一/共同第一/通讯作者发表SCI及核心期刊论文30余篇,包括《Lancet Respir Med》、《J Clin Oncol》、《PNAS》、《Cancer Res》、《Clin Cancer Res》、《J Thorac Oncol》等杂志获得“北京市科技新星”、北京市优秀人才培养资助计划,主持国家自然科学基金3项、省部级课题4项获得中国抗癌协会科技奖一等奖,教育部“高等学校科技进步奖”一等奖,“华夏科技奖”二等奖等。 |
Zhang C,Li SL,Nie Q,et al. Neoadjuvant Crizotinib in resectable locally advanced non-small-cell lung cancer with ALK - rearrangement [J]. J Thorac Oncol, 2018, Nov 5. doi: 10.1016/j.jtho.2018.10.161.[Epub ahead of print]
4。
• 局部晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)存在异质性, 预后令人不满意。现有的两种主要治疗模式为根治性同步放化疗或手术加化/放疗。相关随机对照试验和Meta分析表明, 新辅助化疗或辅助化疗与单独手术相比, 能提升局部晚期NSCLC的5年无复发生存率6%。一项Ⅲ 期随机对照试验显示, 新辅助化疗中加入放疗, 相比单纯的新辅助化疗, 并无生存获益。CTONG 1103研究显示相比新辅助化疗, 新辅助靶向治疗在Ⅲ A-N2期并EGFR突变阳性NSCLC患者具有更好的疗效应答率和更低的毒副反应, 同时显著延长了患者术后的无进展生存期(progression-free survival, PFS)。但总而言之, 这类患者的治疗模式仍存在异质性。
• 间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)作为可检测的重要驱动基因, 可在3%~7%的NSCLC患者中被检测到。在ALK阳性晚期NSCLC患者中应用ALK受体酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)在有效性和长期生存方面均已取得重大成果。但很少有试验关注早期可手术NSCLC患者ALK TKI治疗的情况, 部分研究(如IMPACT、ML 28280、ICTAN)仍在进行中。
评估ALK TKI克唑替尼对局部晚期NSCLC患者新辅助治疗的疗效。
• 研究条件:中国的2个中心(广东省人民医院和北京大学肿瘤医院)参加的临床研究。
• 研究时间:2015-2018年。
• 研究方法:多中心、回顾性临床研究。
• 研究对象:术前病理确诊为N2, Ventana D5F3 免疫组化伴或不伴FISH确认的ALK阳性NSCLC初治患者。
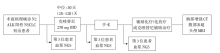
• 干预措施:所有的11名初治患者均在术前诊断为局部晚期NSCLC合并ALK阳性, 接受克唑替尼新辅助治疗, 起始用药剂量为250 mg, 每天2次。患者在术后每3个月进行一次胸部增强CT检查, 必要时行腹部B超和头颅MRI检查。收集其中1名患者的组织标本和动态血浆标本(克唑替尼治疗前后及术后5天), 并送检二代测序(next generation sequencing, NGS)。对另1名病理完全缓解( pathologic complete response, pCR)患者的术前组织标本也送检NGS(测序覆盖422个外显子)。流程图见图1。
• 评价指标:克唑替尼新辅助治疗的疗效持续时间、肿瘤缩小比例, pCR的比例, 靶向治疗的不良反应(adverse drug reaction, ADR), 病理淋巴结降期的比例, 手术切除的比例, 术后辅助治疗模式及复发率, 总体的无病生存期(disease-free survival, DFS), 克唑替尼辅助治疗人群的DFS, 动态血浆及组织标本中基因突变的丰度。
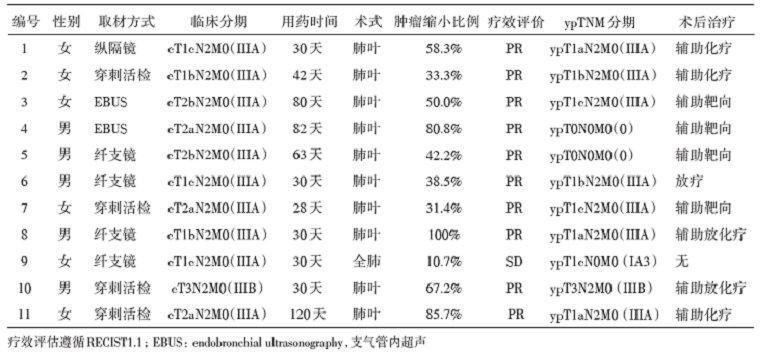
2015年至2018年5月, 纳入11例局部晚期NSCLC(腺癌)合并ALK阳性的初治患者, 接受克唑替尼新辅助治疗。患者的基线特征、疗效持续时间、肿瘤缩小比例等信息见表1。
| 表1 患者的基线特征和疗效情况 |
其中, 10例(91%)患者取得部分缓解(partial response, PR), 1例(9%)疾病稳定(stable disease, SD)。术前克唑替尼治疗的中位时间为30天(28~120天)。2例(18.2%)患者接受克唑替尼治疗后取得pCR, 其中1例患者在治疗过程中出现Ⅳ 度肝损伤, 患者停药1周, 待丙氨酸氨基转移酶和天门冬氨酸氨基转移酶恢复正常后继续服用克唑替尼治疗。3例(27.3%)患者在新辅助治疗后取得淋巴结病理降期。所有患者在新辅助克唑替尼治疗后均成功接受了手术切除, 其中10例(91%)为肺叶切除, 1例(9%)为全肺切除。克唑替尼停药至手术的中位间隔时间为11天(7~25天)。第8例患者因怀疑第4组淋巴结残留, 评估为Rx切除。所有患者未观察到显著的术后并发症和围术期死亡。1例患者出现肺部感染, 1例患者出现术后气促。术后5例患者接受4个周期的辅助化疗/化放疗。4例患者接受克唑替尼辅助治疗, 时间分别为3.0个月、4.1个月、3.6个月和12个月。其中2例患者分别在克唑替尼停药2个月和1个月后出现疾病复发。1例患者接受辅助放疗, 1例因接受全肺切除未接受任何辅助治疗。
11例患者中, 6例出现复发, 5例患者仍处于无复发状态。复发患者的中位DFS为10.1个月(5.3~20个月)。6例复发患者中, 5例接受了一线克唑替尼治疗, 所有患者均取得较好的疗效, 其中1例患者一线克唑替尼治疗后进展, PFS为15个月; 其余4例患者仍在治疗中, 未出现进展(5~26个月)。
第3位患者接受新辅助克唑替尼治疗后, 影像学评估肿瘤缩小50%。对该患者治疗前后的组织和动态血浆标本进行NGS检测, 发现新辅助治疗后ALK和 TP53的突变丰度下降, 仅在组织标本中检测到ZNF703.C854T突变丰度升高。在血浆标本中, 新辅助克唑替尼治疗后, 外周血中TP53和ALK的突变在术前和术后均未检出。
第4位患者取得pCR, 治疗前的组织标本测序发现ALK突变丰度较低(2.9%), 但其他罕见突变ERBB3(48.6%)、PRDM1(49.4%)、PTPN13(47.1%)和UVTA1A1(50.9%)的突变丰度较高, 并出现RB1拷贝数缺失。
ALK阳性的局部晚期NSCLC使用新辅助克唑替尼治疗是有前景的。但其治疗反应率、总体疗效等仍需要进一步进行前瞻性研究, 以提供更高级别的循证医学证据支持。
局部晚期NSCLC是一类具有高度异质性的疾病, 整体预后欠佳。其中尤以Ⅲ A-N2期患者的诊治最具争议, 对于这部分患者, 多学科综合治疗是合理的诊疗策略。目前的常规治疗模式为:不可手术患者进行根治性同步放化疗, 可手术患者进行手术联合辅助/新辅助化疗和/或放化疗。新辅助治疗的目的在于降期以提高手术切除率, 消灭潜在病灶改善预后, 以及作为体内药物敏感性预测等。目前的新辅助治疗主要指新辅助化疗, 既往荟萃分析结果显示, 新辅助化疗较单纯手术治疗5年总生存率仅提高5% [1], 因此, 亟需探索新的新辅助治疗手段。
以EGFR TKI为代表的靶向治疗已经尝试应用于局部晚期NSCLC患者术后的辅助治疗。ADJUVANT[2]和EVAN[3]两项研究结果显示, EGFR TKI可以作为Ⅲ A期NSCLC术后的辅助治疗。然而, 靶向治疗作为新辅助治疗的证据较少。ESTERN研究是一项评估厄洛替尼作为新辅助治疗在Ⅲ A-N2期EGFR突变型NSCLC中疗效的前瞻性Ⅱ 期单中心临床试验, 主要终点指标完全切除率达93.8% (15/16) [4]。EMERGING研究(CTONG 1103)是第一项对比EGFR TKI和吉西他滨/卡铂化疗方案用于Ⅲ A-N2期患者新辅助治疗的Ⅱ 期随机、对照临床试验。结果显示, 新辅助EGFR TKI较新辅助化疗可改善客观缓解率(54.1% vs. 34.3%, P=0.092)、pCR(10.7% vs. 0%)和PFS(21.5个月 vs. 11.9个月, P=0.003), 且不良反应较新辅助化疗少[5]。这两项研究提示, 新辅助靶向治疗高效低毒, 可能成为EGFR突变患者的新辅助治疗优选策略, 但尚待总生存数据的公布和Ⅲ 期随机对照研究的证据。
类似的, ALK抑制剂可以显著改善晚期ALK融合型NSCLC患者的预后, 但其作为新辅助治疗策略同样缺乏证据。几项靶向药物新辅助治疗的临床试验(IMPACT、ML 28280及ICTAN)正在进行中。本研究虽为回顾性研究, 但首次评估了克唑替尼在N2患者中作为新辅助治疗的疗效和安全性, 11例入组患者中, 10例达到PR, 2例达到pCR, 3例在新辅助治疗后降期, 所有患者成功接受了手术切除, 均未观察到显著术后并发症。研究结果显示出克唑替尼作为新辅助治疗具有良好的疗效和耐受性[6], 值得进一步开展与新辅助化疗对比的随机对照研究。
无疑, 本研究是ALK抑制剂作为新辅助治疗的一项有意义的尝试, 但诸多问题需要进一步探讨和明确。首先, 新辅助靶向治疗时间应持续多久?本研究中接受新辅助克唑替尼治疗时间长短各异, 并且未观察到治疗时间长短与肿瘤缩小程度具有相关性。此外, 术前停药多久目前也无共识。新辅助靶向治疗患者的最佳手术时机亦尚待明确。第二, 接受新辅助靶向治疗联合手术的患者应采取怎样的治疗模式?术后辅助选择靶向治疗还是化疗?如果选择辅助靶向治疗应持续多长时间?术后是否仍应进行放疗, 时机如何选择?本研究中有5例患者术后接受辅助化疗, 3例接受辅助放疗, 4例接受克唑替尼辅助治疗, 时间3~12个月, 尚不清楚术后复发与术后辅助治疗方案选择及维持时间之间的关系。第三, 驱动基因阳性的NSCLC患者新辅助靶向治疗术后复发的模式是怎样的?复发后的治疗该如何选择?本研究中观察到疾病复发后一线再次使用克唑替尼治疗依然有效。笔者认为, 新辅助靶向治疗若未进展, 复发后可以一线给予靶向治疗。第四, 如何评估新辅助治疗疗效?新辅助治疗的首要目的是提高治愈率。因此, 病理缓解率可能是更为合适的评价指标, 尤其是病理完全缓解率。新辅助化疗的病理完全缓解率约5%, 新辅助靶向治疗约为10%~20%。近期关于化疗联合程序性死亡受体1单抗新辅助治疗的研究初步结果显示病理完全缓解率高达65%, 提示联合治疗的重要性。因此, 对于驱动基因突变阳性患者给予化疗联合靶向治疗的新辅助治疗方案是否可能进一步提高病理缓解率值得进一步探讨。另外, DFS、降期率等也可作为评估指标。在新辅助靶向治疗临床试验中如何合理设置总生存的替代终点指标, 更好地反映患者的临床获益也是值得思考的。第五, 如何在具有高度异质性的Ⅲ A-N2期患者中筛选合适的新辅助靶向治疗人群, 进行更加精细化的分层管理亦是合理应用新辅助靶向治疗的关键问题, 这有赖于我们对此类疾病更深入的了解。第六, 目前二代ALK抑制剂如阿来替尼、赛瑞替尼等已经上市, 在晚期NSCLC患者中疗效优于一代克唑替尼, 这些药物作为新辅助治疗方案时的排兵布阵策略可能与克唑替尼不同, 需要进一步的研究证据。
本研究另外一项有意义的工作是利用二代测序技术对1例患者的组织和血浆标本进行了动态监测, 观察到血浆循环肿瘤DNA(circulating tumor DNA, ctDNA)清除的现象。既往研究显示, ctDNA未清除者往往提示存在微小残留灶, 预后显著差于清除者, 提示ctDNA动态变化在预测疾病复发中可能具有重要的意义。其与病理缓解率、DFS、总生存等指标的相关性值得进一步的深入研究。
综上所述, 本研究为ALK抑制剂作为新辅助治疗提供了宝贵的经验和理论依据, 但新辅助靶向治疗仍有许多问题亟待解决, 目前证据尚不足以支持ALK抑制剂在N2患者中作为新辅助治疗进行常规临床应用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|