作者简介: 章考飞(1986-),男,安徽泾县人,主管药师,研究方向为肿瘤药学。
目的 分析泾县医院结肠癌术后治疗方案的合理性,为进一步规范结肠癌的术后治疗方案提供有益参考。方法筛选164例就诊于泾县医院并行结肠癌术后辅助化疗的病例,分别从化疗方案选择合理性、化疗药物剂量准确性、疗程是否足够、不良反应发生率、不同科室治疗差异性等方面进行归纳统计,在此基础上对结肠癌术后辅助治疗方案合理性进行综合评价,对导致不合理治疗的原因进行总结分析。结果 化疗方案选择符合指南推荐125例(76.22%),给药剂量符合指南推荐77例(46.95%),化疗疗程符合指南推荐95例(57.93%),6个月完成既定化疗周期81例(49.39%)。肿瘤化疗科在化疗方案选择合理率、治疗疗程合理率、 6个月完成既定化疗周期比例三个统计指标上合理率明显高于非肿瘤化疗科( P<0.01)。表明结肠癌术后辅助化疗不规范现象较为严重,还存在巨大的改进空间。结论 结肠癌术后辅助化疗方案应该遵从大规模临床试验结果及相关指南推荐,严格掌握药物剂量、具体用法,足疗程给予化疗、积极预防和治疗化疗相关不良反应、及时评价疗效,避免治疗过度或治疗不足等。尤其在非肿瘤化疗科,医生更应在以上方面加以严格规范,从多方面确保结肠癌术后辅助化疗的安全、有效实施。
Objective To analyze the rationality of postoperative treatment plan of colon cancer in Jingxian Hospital, and provide beneficial reference for further standardizing the postoperative treatment plan of colon cancer.Methods Screening of 164 cases of colon cancer in Jingxian Hospital with postoperative adjuvant chemotherapy, summarized the chemotherapy scheme selection, dose accuracy, treatment sufficiency, the incidence of adverse reactions, different departments treatment comparison, aspects of statistics, on the basis of the comprehensive evaluation of the rationality of adjuvant therapy after colon cancer surgery, the causes of unreasonable treatment were summarized and analyzed.Result 125 cases (76.22%)of chemotherapy scheme selection conforms to the guidelines recommend, 77 cases (46.95%)of the dosage in accordance with guidelines recommended, 95 cases(57.93%) of chemotherapy treatment course in accordance with guidelines recommend, 81 cases (49.39%) finished the cycle of chemotherapy in six months. In the oncology department, the rational rate of chemotherapy plan, the reasonable rate of treatment course, and the completion period chemotherapy were completed in 6 months. The reasonable rate of three statistical indicators was significantly higher than that of the non-oncology department ( P < 0.01). It shows that the non-standard adjuvant chemotherapy after colon cancer surgery is more serious, and there is still a huge space for improvement.Conclusions Colon cancer postoperative adjuvant chemotherapy scheme should follow large-scale clinical trials and related guidelines recommend, strict control of drug dosage, concrete usage, full course chemotherapy, active prevention and treatment of adverse drug reactions associated with chemotherapy, timely evaluation of curative effect, avoid excessive or insufficient treatment etc. Especially in non-oncology departments, doctors should be strictly standardized in the above aspects, safety and effective implementation of adjuvant chemotherapy for colon cancer patients from multiple perspectives.
目前结直肠癌在全球范围内发病率居恶性肿瘤第三位, 我国已成为结直肠癌全球发病数最多的国家。结直肠癌的规范化治疗对于延长患者生存期、改善患者生活质量具有重要意义, 但目前结直肠癌的化疗不规范现象较为严重, 在2016年3月, 国家卫健委办公厅、国家中医药管理局办公室联合印发了《关于加强肿瘤规范化诊疗管理工作的通知》[1]。文件提出:加强肿瘤专科临床药师培训, 增强抗肿瘤药物和辅助用药的审方、点评、调剂能力, 指导临床用药; 定期开展用药监测与评价。医疗机构要定期收集、整理本机构及临床各科室抗肿瘤药物和辅助用药使用情况, 评估药物使用的合理性, 大力倡导采用信息化手段, 加强抗肿瘤药物和辅助用药临床应用监测与评价。我们设计了肿瘤治疗方案评价表, 对安徽省泾县医院结肠癌术后辅助化疗情况进行汇总与分析。
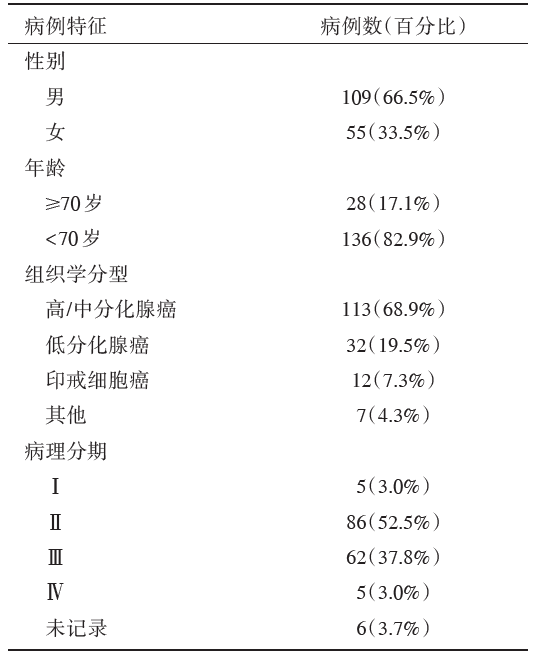
以临床诊断“ 结肠癌、结肠恶性肿瘤” 为关键词, 在医院病历系统中检索2015年就诊于安徽省泾县医院并行结肠癌根治性手术的病例。排除复发或转移性结肠癌、新辅助化疗的病例后, 入组患者164例(表1)。其中肿瘤化疗科133例, 非肿瘤化疗科31例。
| 表1 164 例结肠癌患者的临床资料 |
所有病例详细填写抗肿瘤治疗方案评价表, 按照抗肿瘤治疗方案评价表所列具体内容, 逐份查阅所提取的164份结肠癌术后辅助治疗病例, 将病例资料统计填入表中。合理性评价标准参考《美国国立综合癌症网络(NCCN)结肠癌临床实践指南(2018 V1版)》[2]及《中国结直肠癌诊疗规范(2017版)》[3]中关于结肠癌术后辅助治疗的相关内容。评价内容主要包括化疗方案选择、适应证、用法用量、疗程、不良反应等。此外, 还对分布于化疗科和非化疗科的患者分别从上述几方面进行比较分析, 评价不同科室结肠癌术后辅助治疗合理性的差异。指南认为, 结肠癌的术后辅助化疗应以根治为目的, 在无明确禁忌的条件下, 应优先选择疗效确切、不良反应轻微的方案进行化疗。此外, 指南主张足剂量、足疗程给予化疗, 不应轻易下调剂量、缩短化疗疗程、调整化疗方案等, 否则将导致复发率升高和复发时间的缩短。
使用SPSS 20.0软件对调查数据进行统计学分析。肿瘤专科与非肿瘤专科化疗合理性数据采用χ 2检验进行比较。P< 0.05为差异有统计学意义。
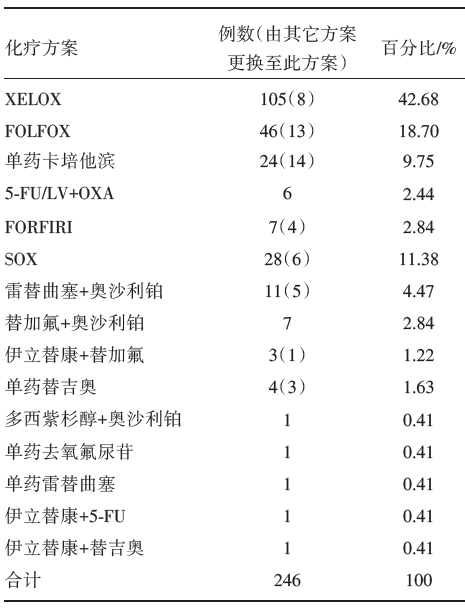
164例术后病理确诊为结肠癌患者化疗方案统计分析(其中39例患者治疗过程中有方案调整, 故本次调查共涉及治疗方案246个)。其中术后采用指南推荐mFOLFOX6、FLOX、CapeOX、卡培他滨单药或5-FU/LV方案治疗共181次, 化疗方案选择合理率为73.6%(包含从不合理方案转换为合理方案的病例), 未采用指南推荐方案化疗比例为26.4%(包含从合理方案转换为不合理方案的病例), 患者术后的化疗方案见表2。
| 表2 结肠癌患者化疗方案选择 |
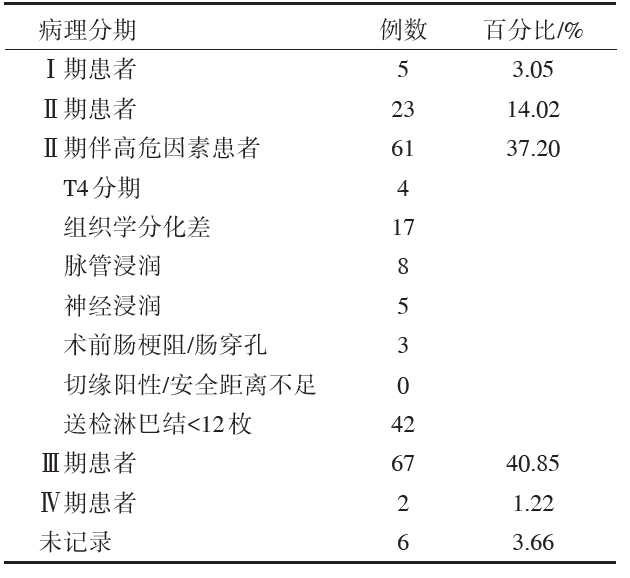
本次研究共包含Ⅰ 期结肠癌患者5例、低危Ⅱ 期结肠癌患者23例、Ⅱ 期伴高危因素(可能同一患者合并多种高危因素)结肠癌患者61例、Ⅲ 期结肠癌患者67例、Ⅳ 期结肠癌患者2例, 行结肠癌根治术, 术后病理无法追溯的患者6例。其术后病理分期分布见表3。
| 表3 结肠癌患者的术后病理分期 |
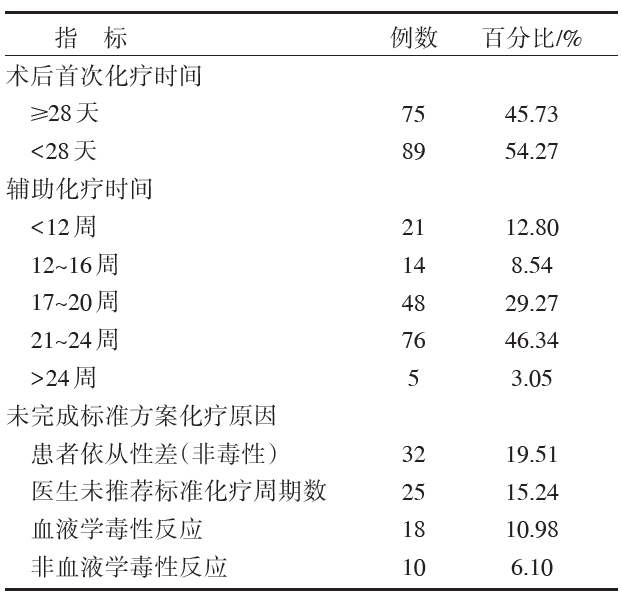
所有患者中仅有34例(20.73%)患者未减量, 按时完成既定周期的术后辅助化疗。85例(51.83%)患者未完成既定周期标准方案化疗, 其原因包括:患者依从性差32例(19.51%); 未记录具体原因而缩减化疗周期数者25例(15.24%); 不能耐受血液学不良反应者18例(10.98%); 不能耐受非血液学不良反应者10例(6.10%)。43例(26.22%)患者按期完成指南推荐的化疗周期数, 但因化疗期间血液学不良反应而下调化疗剂量。具体术后辅助化疗实施情况见表4。
| 表4 结肠癌患者术后辅助化疗完成情况 |
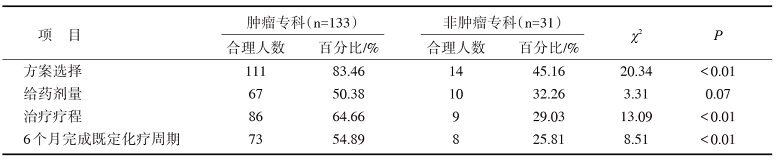
本研究从辅助化疗方案选择合理率、给药剂量合理率、疗程合理率、6个月内完成既定化疗周期的比例几方面对肿瘤化疗科和非肿瘤化疗科的患者进行了对比评价, 方案合理率分别为83.46% vs. 45.16%(P< 0.01), 给药剂量合理率分别为50.38% vs. 32.26%(P=0.07), 治疗疗程合理率分别为64.66% vs. 29.03%(P< 0.01), 6个月内完成既定化疗周期比例分别为54.89% vs. 25.81%(P< 0.01)。具体结果见表5。
| 表5 化疗科与非化疗科化疗方案选择合理性对比评价 |
本文根据肿瘤特点制定肿瘤化疗合理性调查表, 目的是全面客观地记录患者的基本病情、诊疗过程、患者化疗前后评估、患者治疗方案、化疗药物选择、治疗剂量、化疗方案的时间因素及辅助治疗情况、患者的治疗耐受性等内容。能够全面反映患者化疗的主要过程, 为运用评价指标开展合理用药评价工作提供判断依据[4]。
循证医学证据是开展肿瘤化疗的基础, 根据NCCN结肠癌临床实践指南, 按不同术后病理分型、分期及影响因素选择相应化疗方案是合理化疗的基本原则。在调查中发现部分病例未按指南推荐及循证医学原则选择合理方案化疗。比如:23例患者术后辅助化疗采用含替吉奥的方案, 而指南未推荐替吉奥用于结肠癌的术后辅助化疗, 目前研究也仅限于晚期结肠癌。7例患者首选含雷替曲塞方案用于术后辅助化疗, 而雷替曲塞仅被推荐用于治疗氟尿嘧啶类药物不耐受的晚期结肠癌患者。7例选择采用替加氟代替FOLFOX方案中的氟尿嘧啶, 缺乏足够证据支持。6例患者术后辅助化疗方案中不包含氟尿嘧啶类药物, 而大量大规模临床研究证实了氟尿嘧啶类药物在结肠癌术后辅助化疗中的基石地位, 氟尿嘧啶类药物的缺乏会降低术后辅助化疗的疗效。
指南提示, Ⅰ 期结肠癌行根治性手术后 5年生存率高达90%以上[5], 很难再从辅助化疗中获益。目前针对Ⅰ 期根治术后患者多采用随诊观察即可。本次研究纳入的病例中包含了5例Ⅰ 期患者, 但同时均伴有复发高危因素(1例术后病理可见神经、脉管浸润, 1例术前肠梗阻, 4例送检淋巴结少于12枚), 他们均接受了术后辅助化疗。指南推荐这部分患者可在根治性术后行局部放疗以减少复发风险, 但未推荐辅助化疗。医生可能是由于过度谨慎或希望通过辅助化疗降低患者的焦虑情绪, 对该部分患者添加了辅助化疗。
对于低危Ⅱ 期患者, 指南指出不予化疗, 采用单纯随访观察或考虑使用卡培他滨、 5-FU/LV 辅助化疗。根据 MOSAIC 试验[6, 7, 8]及使用奥沙利铂后可能的远期后遗症, 专家组认为 FOLFOX、XELOX方案不适合用于无高危因素的Ⅱ 期患者辅助治疗。本次研究共纳入23例低危Ⅱ 期结肠癌患者, 其中20例患者术后采用了联合奥沙利铂的方案化疗, 不符合指南推荐内容。分析原因可能是医生未对Ⅱ 期结肠癌患者进行仔细区分, 或者对患者接受根治术的规范严谨性持怀疑态度, 出于谨慎考虑, 对该部分患者添加化疗, 也不排除患者有强烈术后化疗意愿左右了医生的决策。
高危Ⅱ 期患者, 包括:T4(Ⅱ B、Ⅱ C 期)、组织学分化差(3/4级, 不包括高度微卫星不稳定性者)、脉管浸润、神经浸润、肠梗阻、肿瘤部位穿孔、切缘阳性或情况不明、切缘安全距离不足、送检淋巴结不足12枚。此类患者化疗方案主要包括5-FU/LV、卡培他滨、FOLFOX、卡培他滨/奥沙利铂(CapeOX)或 FLOX 方案[9, 10]。部分病例还可选择定期观察随访, 而不做术后辅助化疗。此外, 对于Ⅱ 期结肠癌是否需要术后辅助化疗, 在做临床决策时需要考量的另一个重要信息就是微卫星不稳定性。在2011-2015年NCCN指南中, 将70岁以下患者和Ⅱ 期结肠癌患者推荐行DNA错配修复蛋白或微卫星不稳定检查。具有高度微卫星不稳定的Ⅱ 期患者可能预后较好, 且不会从5-FU的辅助化疗中获益[11, 12, 13]。本次研究共包含86例Ⅱ 期结肠癌患者, 其中64例为Ⅱ 期伴高危因素结肠癌患者。仅有3例患者行DNA错配修复蛋白检测, 随着基因检查技术的逐渐普及, 建议医生可完善患者的相关检查。
在本次研究纳入的164例结肠癌患者中, 83例抗肿瘤药物给药剂量低于指南推荐, 4例抗肿瘤药物给药剂量高于指南推荐, 主要表现为XELOX方案奥沙利铂联合用药低于推荐剂量135 mg/m2, FOLFOX方案氟尿嘧啶给药剂量低于指南推荐。尤其对于体表面积大的患者, 给药剂量不足现象更加明显, 体表面积是决定化疗药物剂量的基本参考因素, 部分病例缺少患者体表面积, 说明抗肿瘤药给药剂量科学性不足。本次调查中发现部分患者在治疗过程中体质量发生了较大变化, 但抗肿瘤药物给药剂量未及时调整, 从而导致了抗肿瘤药物剂量过大或剂量不足。给药剂量过大可导致患者对化疗的不耐受性增加, 甚至增加患者的病死率。剂量不足可使化疗敏感肿瘤患者的首次化疗失败。因此, 考虑药物安全性的同时也不应忽视其有效性[ 14]。
根据《NCCN结肠癌临床实践指南(2018 v1版)》及 2018年卫健委颁布的《中国结直肠癌诊疗规范(2017版)》, 对于高危Ⅱ 期和Ⅲ 期结肠癌术后辅助治疗方案的表述为:术后6个月内完成全部辅助化疗, 可选方案包括:mFOLFOX6、CapeOX、FLOX、5-FU/LV及卡培他滨单药。研究表明:规范化足剂量、足疗程进行结肠癌的术后辅助化疗, 可使Ⅱ 期伴高危及Ⅲ 期结肠癌患者的死亡风险、复发风险显著降低。
本次研究纳入的164例结肠癌患者中仅有 22.7%的患者完成了6个月的标准方案足剂量辅助化疗, 超过 40%的患者未完成指南推荐的化疗周期即停止辅助化疗。究其原因, 可能是患者的宣教工作做得不好, 患者并不知晓术后足周期辅助化疗对于降低疾病复发风险的帮助, 也不能排除患者在获得治疗方案后选择就近治疗而未被本次调查所跟踪, 或患者因经济压力主动要求中断化疗。还有可能与医生认为辅助化疗已获得良好根治效果, 已达到降低复发风险的目的而缩短不能耐受化疗的周期相关。此外, 还有超过15%的患者由于不能耐受化疗毒副反应未能完成既定的化疗周期, 这部分未完成足周期化疗的患者具有潜在的复发高风险, 应给予密切观察随访。
本次研究纳入的164例结肠癌患者中多在术后4~8周内开始辅助化疗, 有54.3%的患者在术后4周内行辅助化疗, 超过90%的患者在术后6周内行辅助化疗。研究表明:手术后辅助化疗的开始时间是影响患者无病生存期的独立预后因子, 手术距首次化疗的时间越短, 患者获取的生存受益越大, 即术后辅助化疗时间每拖后4周, 其总生存期将减少14%[ 15]。
本次研究将分布于肿瘤化疗科与非肿瘤化疗科的164例患者分别从治疗方案选择合理率、足剂量化疗比例、足疗程化疗比例、6个月内完成既定化疗周期数比例4个方面进行对比。调查研究发现, 以上4个指标, 非肿瘤化疗科均全面落后于肿瘤化疗科。分析其原因主要包括:①非化疗科对术后辅助化疗重视不够; ②受限于专业差别, 对结肠癌辅助化疗的最新进展了解不足; ③鉴于对化疗过程中出现药物毒副反应的担忧, 随意下调药物剂量、调整化疗方案、缩短化疗疗程、延长化疗周期时间间隔; ④未仔细采集患者的病史及评估术后病理分期, 按照固有用药习惯制定化疗方案等。因此, 对于结肠癌应更加强调专科专治; 医生应注重诊疗指南最新进展的业务学习; 对于化疗过程中出现的毒副反应, 应积极规范化治疗, 尽量避免因毒副反应轻易中断化疗[16]。
结直肠癌术后辅助治疗不同于晚期患者的姑息化疗, 其首要目的在于根治、降低复发率和延长复发时间。术后辅助治疗具有严格的适应证及实施规范, 具体体现为:严格按照指南及大型临床试验结果选择辅助化疗方案; 足剂量、足疗程给予化疗; 不轻易“ 改良” 化疗方案; 不将具有争议的临床研究进展用于辅助化疗; 积极预防和治疗不良反应, 防止其干扰辅助化疗计划的开展; 避免过度治疗或治疗不足等。总之, 对于结直肠癌的辅助化疗, 应本着尊重指南的原则, 方案的制定及调整均需有充分循证医学证据支持, 多方位多角度共同确保辅助化疗方案安全、有效、合理地实施。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|