作者简介:
彭晓潇(1992-),女,四川乐山人,在读硕士研究生,从事肺癌免疫治疗研究。
目的 探究检测非小细胞肺癌血浆外泌体PD-L1(exosomal PD-L1,ePD-L1)的可行性,并明确其与肿瘤组织PD-L1表达水平的关系。方法 选取2种人肺腺癌细胞系H226(PD-L1弱阳性)、H1975(PD-L1强阳性)为实验组,1种人乳腺癌细胞系MCF-7(PD-L1阴性) 为对照组,细胞系培养后以超高速离心法分离细胞培养液中的外泌体,同时收集细胞裂解液,以外泌体特异性蛋白标志物CD9为标记,采用蛋白质免疫印迹法检测各细胞系释放的外泌体、PD-L1和ePD-L1含量,分析PD-L1与ePD-L1表达水平的相关性。结果 H1975和MCF7细胞系外泌体检测到较强CD9表达, H226细胞系分泌的外泌体CD9水平很低。MCF7、H226和H1975细胞系PD-L1表达水平分别为阴性、弱阳性、强阳性,ePD-L1表达水平分别为阴性、阴性、强阳性。结论 血浆ePD-L1水平受肿瘤组织本身PD-L1表达水平和其外泌体释放量的双重影响,ePD-L1表达呈阳性时,可反应肿瘤组织PD-L1表达水平;而ePD-L1检测呈阴性时,应以肿瘤组织PD-L1的检测结果为准。
Objective The aim of this study was to investigate the potential of using plasma exosomal PD-L1 (ePD-L1) as a biomarker for non-small cell lung cancer(NSCLC).Methods Two NSCLC cell lines, H226 (low-expressed PD-L1) and H1975 (high-expressed PD-L1) and one breast cancer cell line MCF7 (PD-L1 negative) were selected for this study. The exosomes secreted by cells into culture medium were separated by high-speed centrifugation, and the cell lysate was also collected. CD9 was used as a marker for exosomes detection. The exosome-released PD-L1 expression level and the ePD-L1 level were detected by Western Blot.Results H1975 and MCF7 cell lines showed stronger CD9 expression level compared to H226 cell line. H1975 cell line with stronger PD-L1 expression showed higher ePD-L1 level compared to H226 cell line. PD-L1 negative MCF7 cell line was also found to be ePD-L1 negative.Conclusion Plasma ePD-L1 expression is regulated by the expression level of PD-L1 in tumor cells and the secretion level of exosomes from tumor cells. ePD-L1 expression can be an indicator for the expression level of PD-L1 in tumor tissues.
随着Pembrolizumab、Nivolumab、Atezolizumab等程序性细胞死亡受体-1(programmed death-1, PD-1)/程序性细胞死亡受体-配体1(programmed death-ligand 1, PD-L1)抑制剂系列研究结果的陆续公布, 免疫治疗获得美国食品药品监督管理局(Food and Drug Administration, FDA)批准和美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)指南推荐(Ⅰ 类证据), 成为晚期驱动基因阴性非小细胞肺癌(non-small cell lung cancer, NSCLC)一线治疗的选择之一, 但目前对一线免疫单药治疗仍严格限制在肿瘤组织PD-L1高表达[肿瘤比例分数(tumor proportion score, TPS)≥ 50%]的患者。
毋庸置疑, 肿瘤组织PD-L1表达水平是目前PD-1/PD-L1抑制剂疗效预测的重要生物标志物之一。目前PD-L1检测采用肿瘤组织标本, 其取材方式属有创操作。此外, 肿瘤组织PD-L1表达水平本身存在时间和空间的异质性[1], 小的活检标本和手术切除标本诊断PD-L1表达水平的不一致率可达18%~48%[2, 3, 4]。
而外泌体直接来源于肿瘤细胞, 其表面可携带原始细胞的受体或配体。已有动物实验证明, 表达PD-L1的细胞可分泌同样携带PD-L1的外泌体[5]。目前, 外泌体PD-L1(exosomal PD-L1, ePD-L1)的研究刚刚起步, 刘云鹏教授团队的研究证明, 多种胃癌细胞系可以分泌ePD-L1, 其含量与细胞PD-L1的表达水平呈正相关, 并且与患者肿瘤T分期和免疫治疗的预后相关[6]。在头颈癌中也有其与免疫治疗预后相关的报道[7]。在肺癌领域, 尚未有ePD-L1与原肿瘤细胞PD-L1表达水平或与免疫治疗预后相关的报道。因此, 本研究旨在明确NSCLC血浆ePD-L1检测的可行性, 并探究NSCLC肿瘤细胞PD-L1与其ePD-L1表达水平的关系。
人肺癌细胞系H226(PD-L1弱阳性)、H1975(PD-L1强阳性)、人乳腺癌细胞系MCF7(PD-L1阴性)均购于美国模式培养物集存库(American type culture collection, ATCC)。CD9兔多克隆一抗及PD-L1(28-8)兔多克隆一抗购于英国Abcam公司, 羊抗兔辣根过氧化物酶二抗购于美国LI-COR公司。
1.2.1 实验分组
对照组为PD-L1表达阴性的人乳腺癌细胞株MCF7, 实验组为PD-L1表达弱阳性的H226和PD-L1表达强阳性H1975人肺腺癌细胞系。
1.2.2 细胞培养
MCF7细胞系培养基成分配比:10%胎牛血清, DMEM培养基, 100 U/mL 青霉素, 0.1 mg/mL链霉素。H226和H1975细胞系培养基成分配比:10%胎牛血清, RPMI 1640培养基, 100 U/mL青霉素, 0.1 mg/mL链霉素。培养条件:37℃, 5% CO2。3种细胞系分别培养于10 cm培养皿中, 同步扩大培养至6盘细胞量。
1.2.3 细胞培养上清液超速分离外泌体
收集细胞培养基上清液, 转移至50 mL离心管中; 离心机提前4℃预冷, 300 g离心20 min, 弃沉淀, 上清液转移至新的50 mL离心管中。4℃, 2 000 g离心20 min, 弃沉淀, 上清液转移至新的50 mL离心管中。4℃, 10 000 g离心30 min, 弃沉淀, 上清液转移至与超速离心配套的离心管内, 即获得外泌体原液。外泌体原液(不足时)用PBS缓冲液补充至标准体积(距离心管口1 cm左右), 注意配平, 于超速离心机150 000 g离心70 min, 弃上清液。将离心后所得的外泌体沉淀用200 μ L PBS充分洗涤, 并补充至标准体积, 再次离心, 弃上清液。向外泌体沉淀物中加入细胞裂解液充分混匀, 冰上裂解10 min。将外泌体裂解液转移至新的1.5 mL离心管中。
1.2.4 细胞裂解、沉淀收集
向培养皿中加入PBS, 轻轻摇晃皿底, 洗去培养基残留。吸走PBS, 在皿底加入适量0.25%胰蛋白酶, 置于37℃消化至细胞变圆、脱离皿底。加入含有FBS的培养基终止消化, 并吹打混匀细胞。将细胞悬液转移至15 mL离心管中, 300 g离心5 min, 弃上清液。向细胞沉淀中加入适量PBS吹打洗涤, 再次300 g离心 5 min, 弃上清液。向洗涤后的细胞沉淀中加入细胞裂解液, 冰上混匀、静置30 min, 裂解细胞。离心机预冷至4℃, 8 000 g离心10 min, 将细胞裂解液上清液转移至新的1.5 mL离心管中。
1.2.5 蛋白定量
将蛋白定量BSA标准品按说明书倍比稀释。取外泌体及细胞裂解液10 μ L, 分别加入96孔板中, 每孔加入300 μ L G250染液。酶标仪读数, 计算标准曲线及样品浓度。每个样品至少2次重复。
1.2.6 Western Blot检测蛋白表达(PD-L1和外泌体膜蛋白标志物CD9)
配置12%的蛋白胶, 将ePD-L1与细胞沉淀PD-L1样品分别上样。采用湿转方式, 100 V转膜70 min, 5%脱脂奶粉室温封闭1 h。将膜置于4℃摇床, 30~50 rpm, 一抗孵育过夜(一抗采用0.5%BSA稀释, CD9稀释比为1:500, PD-L1稀释比为1:100)。室温摇床, 30~50 rpm, 二抗孵育1 h(二抗采用0.5%BSA稀释, 稀释比为1:10 000)。按1:1比例配置ECL显色液, 将显色液均匀涂到膜表面, 避光反应1 min左右, 将膜置于Tanon自动曝光仪曝光。
1.2.7 结果判读
结合样品类型, 依据Western Blot条带强弱差异, 对外泌体PD-L1表达量进行判断。
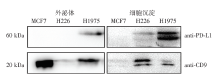
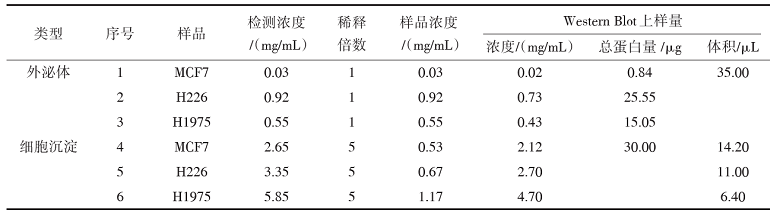
同样量的细胞培养液进行超高速离心, 分离得到的外泌体蛋白量差异较大, 见表1。同时, H1975和MCF7细胞系外泌体样品中能检测到较强外泌体特异性蛋白标志物CD9, 但是H226分泌的外泌体CD9水平很低, 见图1。该结果证明各NSCLC细胞系均能分泌可被检测到的外泌体, 但外泌体量可能不同。
| 表1 外泌体及细胞沉淀蛋白上样量 |
H1975细胞系分泌的外泌体中可检测到PD-L1。同时, 此细胞系的细胞裂解液中也检测到高表达的PD-L1(图1)。以上结果初步证明, 高表达PD-L1的细胞系分泌的外泌体中可携带PD-L1。
H226细胞系的细胞裂解液中检测到了PD-L1, 但是表达水平较低, 其分泌的外泌体中没有检测到PD-L1(图1)。根据结果2.1, H226分泌的外泌体CD9水平很低。因此, ePD-L1阴性检测结果可能由细胞系本身PD-L1水平较低和其分泌的外泌体含量少共同导致。
MCF7作为阴性对照细胞系, 无论在细胞裂解液还是外泌体中均不能检测到PD-L1(图1)。
PD-1/PD-L1免疫检查点抑制剂已成为晚期驱动基因阴性NSCLC患者的重要治疗选择之一。多项临床试验表明其在驱动基因阴性的PD-L1高表达(TPS≥ 50%)晚期NSCLC一线、二线治疗中优于传统化疗[8, 9, 10]。但并非所有PD-L1高表达的患者都能从抗PD-1/PD-L1治疗中获益, 甚至可能存在疾病超进展的风险[11]。有效免疫治疗的关键是筛选优势人群。
从机制上来说, PD-1/PD-L1免疫检查点抑制剂直接与肿瘤组织PD-L1或T细胞表面PD-1结合, 阻断肿瘤细胞PD-L1与T细胞表面PD-1结合, 从而恢复免疫系统的监视功能[12]。因此, PD-L1表达水平可能是重要的疗效预测标志之一。但由于其表达存在时间和空间异质性, 并且其检测需要侵入性手段来获取肿瘤组织, 造成了临床应用上的困难。外泌体直接来源于原肿瘤细胞, 带有原始细胞表面的受体或配体。在NSCLC中, 其是否能反映原肿瘤组织的PD-L1表达水平仍未确定。因此, 本研究明确了NSCLC血浆ePD-L1检测的可行性, 并在此基础上证明了PD-L1表达阳性的细胞系可释放携带的PD-L1外泌体。但由于其含量受细胞本身PD-L1表达水平和外泌体释放含量的双重影响, ePD-L1阴性检测结果可能由细胞系本身PD-L1水平较低和其分泌外泌体含量少共同导致。因此, 当PD-L1检测呈阴性, 应以肿瘤组织PD-L1的检测结果为准。
外泌体作为液体活检的一部分, 在癌症诊断和疗效监测方面具有巨大的潜力[13]。外泌体检测技术作为组织PD-L1检测补充的可行性及优势在于:第一, 外泌体起源于细胞膜的内陷, 其产生早期胞内体, 进一步发展成为多泡小体, 多泡小体在细胞内分子马达的牵引下与细胞表面融合, 最终分泌出去[14]。因此, 从理论上说, 外泌体具有原始细胞表面的受体或配体, 表达PD-L1的肿瘤细胞可分泌同样携带表达PD-L1的外泌体; 第二, 其广泛存在于患者的外周血中, 不需要通过有创的方式来获取肿瘤组织, 避免侵入性活检的风险, 同时可多次取样, 更有利于对疾病的动态检测; 第三, 外泌体检测从全身循环的血液中取材, 在一定程度上可以克服肿瘤异质性给检测带来的误差, 反映个体整体的免疫功能情况。
检测ePD-L1对于了解个体免疫微环境也存在优势。首先, ePD-L1本身具有活性, 可以和CD8+T细胞表面的PD-1直接结合, 从而抑制T细胞增殖并减弱它分泌细胞因子和杀伤肿瘤细胞的功能[15]。其次, 既往文献报道, 肿瘤微环境中游离形式的PD-L1除了ePD-L1还有可溶性PD-L1(soluble PD-L1, sPD-L1)[16]。而ePD-L1与sPD-L1相比, 其形式更稳定, 不易被蛋白水解酶水解, 可更强烈地诱导T细胞凋亡[6]。
在2017年Theodoraki教授对头颈部肿瘤的研究中, ePD-L1水平被证明与疾病的分期、淋巴结转移和疾病的活动情况相关。阻断ePD-L1与PD-L1阳性T细胞的结合可以减轻免疫抑制[7]。随后在对胃癌患者的研究中, 刘云鹏教授团队证实多种胃癌细胞系可以分泌ePD-L1, 其含量与细胞PD-L1的表达呈正相关, ePD-L1高表达胃癌患者的总生存期短于低表达组(20.73个月 vs.28.8个月, P=0.021), 并且ePD-L1可诱导T细胞凋亡[6]。在转移性黑色素瘤的患者外周血中也同样检测到ePD-L1, 其表达水平与干扰素-γ 水平相关, 并且在抗PD-1治疗过程中动态变化。在治疗早期, ePD-L1升高幅度可作为肿瘤细胞对T细胞再激活的适应性反应指标, 可依据该指标将临床应答者与无应答者分层。在肺癌和乳腺癌细胞外泌体也可检测到PD-L1的表达[15]。此外, 有研究证明, 在黑色素瘤和肺癌中, 疾病完全/部分缓解的患者治疗前后平均外泌体PD-L1 mRNA水平明显下降[(830.4± 231.3)拷贝数/mL vs. (242.5± 82.5)拷贝数/mL, P=0.016][17]。但该研究中接受免疫治疗的总人数仅18人, 其中肺癌8人。PD-L1 mRNA表达受多方面因素调控, 其能否真正反应个体PD-L1表达水平有待进一步验证。目前尚未见NSCLC中有关ePD-L1与原细胞PD-L1表达水平或免疫治疗预后相关的报道。
本研究与既往研究虽然在方法和思路上有所不同, 但都同样证明了ePD-L1检测的可行性并探讨了其与肿瘤细胞PD-L1表达水平的关系。在临床实践中, 当患者肿瘤组织可及性较差时, 血浆ePD-L1检测或可作为肿瘤组织PD-L1表达水平的初筛。在ePD-L1表达呈阳性时, 可反映肿瘤组织PD-L1表达水平; 反之, 在ePD-L1检测呈阴性时, 应以肿瘤组织PD-L1的检测结果为准。本研究与既往研究不同之处在于:第一, 直接检测ePD-L1蛋白而不是外泌体PD-L1 mRNA, 更真实地反映ePD-L1表达水平; 第二, 在NSCLC的细胞系上证实了ePD-L1水平受肿瘤组织本身PD-L1表达水平和其外泌体释放量的双重影响, 为以后ePD-L1检测结果的解读奠定基础。
本研究存在以下局限性:首先, 本研究只是基于细胞系的研究, 在将来的研究中需要使用NSCLC患者外周血进行这一结果的验证; 其次, Western Blot方法属半定量检测技术, 难以将ePD-L1水平量化。
综上, 本研究验证了NSCLC中ePD-L1检测的可行性, 证明了PD-L1表达阳性的细胞系可释放携带PD-L1的外泌体。但由于其含量受细胞本身PD-L1表达水平和外泌体释放含量的双重影响, 对ePD-L1检测结果应谨慎解读。在ePD-L1表达呈阳性时, 可反映肿瘤组织PD-L1的表达水平; 反之, 当ePD-L1检测呈阴性时, 应以肿瘤组织PD-L1表达水平为准。在未来, 我们可以采用灵敏度更高且可量化的蛋白质检测技术, 如蛋白质质谱技术等来检测NSCLC患者血浆ePD-L1。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|