| 徐泽锋,副主任医师,硕士研究生导师现任中国医学科学院血液病医院(血液学研究所)骨髓增生异常综合征及骨髓增殖性肿瘤诊疗中心副主任医师。中国抗癌协会血液肿瘤专业委员会青年委员会委员,中国抗癌协会血液肿瘤专业委员会骨髓增生异常综合征/骨髓增殖性肿瘤工作组专家委员会委员;天津抗癌协会老年肿瘤专业委员会委员;中国老年医学学会血液学分会第一届委员会骨髓增生异常综合征工作委员会副秘书长。长期从事骨髓增生异常综合征及骨髓增殖性肿瘤的临床与基础研究工作。多项相关研究成果在SCI(《Blood》及《Leukemia》)期刊上发表。作为项目负责人分别承担1项国家自然科学基金面上项目及中华医学会分子生物学临床应用研究专项资金项目。先后参与完成国家自然科学基金,卫生部基金,天津市自然科学基金(重点项目),国家教委博士点基金,新世纪优秀人才支持计划等项目。已在SCI及国内核心期刊发表论文40余篇,参与编纂专业书籍7部。获2015年教育部科学技术进步二等奖,2015年中华医学科技奖三等奖。 |
Szuber N, Vallapureddy RR, Penna D, et al. Myeloproliferative neoplasms in the young:Mayo Clinic experience with 361 patients age 40 years or younger[J]. Am J Hematol, 2018, 93(12): 1474- 1484.
2b。
过去报道, 小于40岁的年轻骨髓增殖性肿瘤(myeloproliferative neoplasms, MPN)的发病率有上升趋势。约20%MPN, 特别是真性红细胞增多症(polycythemia vera, PV)和原发性血小板增多症(essential thrombocytosis, ET)患者的发病年龄小于40岁。现有的大多数数据以及当前的传统预测模型均来自老年患者, 无法准确反映年轻患者的预后情况。现有的针对年轻MPN患者的研究表明, 相较于年长患者, 年轻MPN患者相对为惰性病程, 生存率更高。但大规模、成熟的数据仍然明显缺乏。
回顾性分析过去50年, 361名初诊年龄不超过40岁的MPN患者的预后标志物和长期生存随访状况。
• 研究条件:美国罗切斯特梅奥诊所的患者数据。
• 研究时间:数据收集截止时间为2018年4月。
• 研究方法:单中心、回顾性临床研究。
• 研究对象:1967-2017年确诊的18~40岁之间的MPN患者。
• 评价指标:①采用二代测序技术检测突变基因(ASXL1、SRSF2、U2AF1和U2AF1Q15), 确定原发性骨髓纤维化(primary myelofibrosis, PMF)的潜在预后相关因素。②使用传统的预后模型对患者进行风险管理, 包括:年龄、白细胞计数、PV患者静脉血栓事件、ET国际预后积分系统(international prognostic score for ET, IPSET)、PMF国际动态预后积分系统(dynamic international prognostic scoring system, DIPSS)。③总生存率(overall survival, OS)。从诊断到死亡(未删失)的时间, 或最后一次随访(删失)时分别利用纤维化转化、原始细胞转化和首次血栓事件作为未删失变量的无骨髓纤维化生存期(myelofibrosis-free survival, MFFS)、无白血病生存期(leukemia-free survival, LFS)和无血栓事件生存期(thrombosis-free survival, TFS)。
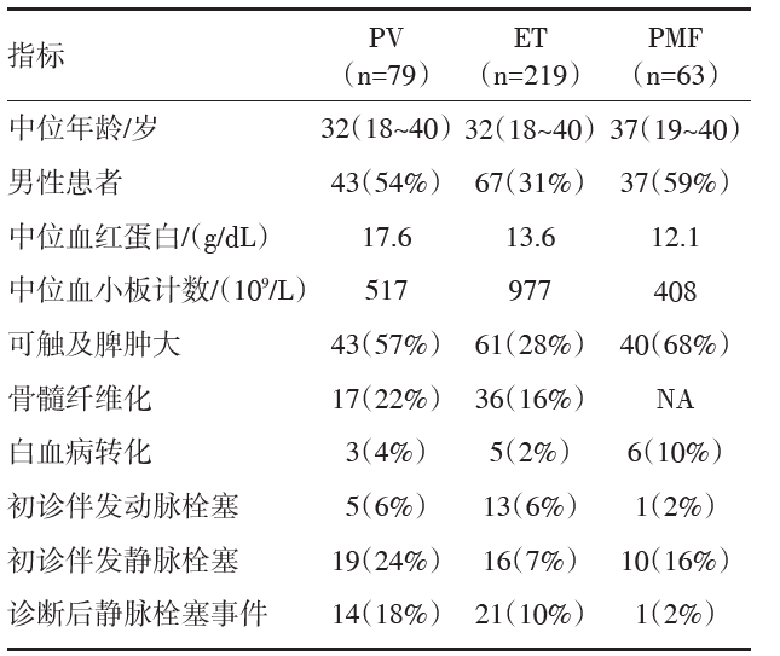
共诊断MPN患者3 023例, 其中361例为年轻(年龄≤ 40岁)MPN患者, 占总MPN发病人数的12%, 其中PV 79例、ET 219例、PMF 63例(见表1); 比较的研究对象包括980名41~60岁和1 682名60岁以上患者。
年轻PV患者中位血红蛋白和血小板计数与老年患者相比无显著性差异(P=0.13和P=0.14); 但年龄≤ 40岁患者白细胞增多(> 25× 109/L)、脾肿大较年长患者(41~60岁和> 60岁)更常见(57% vs. 32% vs. 21%, P< 0.001)。纤维化转化发生率为22% vs. 25% vs. 10%(P< 0.001), 白血病转化发生率相当(4% vs. 5% vs. 3%, P=0.4)。年轻患者诊断时伴发动脉事件的发生率更低(6% vs. 8% vs. 21%, P< 0.001), 但病程中静脉血栓形成发生率更高(诊断时24% vs. 11% vs. 12%, P=0.01; 诊断后18% vs. 15% vs. 12%, P=0.2)。
| 表1 361例年龄≤ 40岁MPN各亚型患者概况 |
年轻ET患者中位血红蛋白与年长患者无显著差异(P=0.07)。年轻的ET患者(≤ 40岁)与年长患者(41~60岁和> 60岁)相比, 血小板计数明显更高(977 × 109/L vs. 875× 109/L vs. 848× 109/L, P< 0.001); 1 000 × 109/L以上者为44% vs. 29% vs. 29%, P< 0.001。更多年轻患者诊断时可触及脾肿大(28% vs. 15% vs. 13%, P< 0.001)。年轻ET患者更多为正常染色体核型(P=0.03)和CALR基因阳性(P < 0.001)。纤维化转化发生率为16% vs. 16% vs. 9%(P< 0.001), 而白血病转化率在各亚组间相当(2% vs. 5% vs. 3%, P=0.1)。年轻患者动脉事件明显减少(P< 0.001)。
年轻PMF患者(≤ 40岁)相比于年长患者(41~60岁和> 60岁)血红蛋白值更高(12.1 g/dL vs. 10.7 g/dL vs. 10 g/dL), 输血依赖率较低(13% vs. 24% vs. 38%)、中位血小板计数较高(408× 109/L vs. 248× 109/L vs. 206× 109/L), 血小板计数< 100 × 109/L较少(5% vs. 20% vs. 25%); 白细胞计数较低(7× 109/L vs. 8× 109/L vs. 9.5 × 109/L)且白细胞增多(≥ 11× 109/L)不常见(27% vs. 36% vs. 44%), 白细胞> 25× 109/L(5% vs. 11% vs. 17%)或外周血原始细胞≥ 1%(24% vs. 49% vs. 51%)、中位乳酸脱氢酶水平(371 U/L vs. 491 U/L vs. 518 U/L)、体质性症状(16% vs. 26% vs. 32%)较低, 差异均有统计学意义。年轻患者合并基因突变更多见, CALR突变率48%, JAK2突变率39%, CALR突变患者的发病率低, JAK2突变患者的发病率则随着年龄的增长而增加(P< 0.001)。白血病转化率分别为10% vs. 10% vs. 9%(P=0.9)。年轻受试者诊断时动脉血栓事件较少(2% vs. 6% vs. 13%, P< 0.001)。NGS数据揭示高危突变的显著聚集性, ASXL1、SRSF2、U2AF1突变发生率分别为19% vs. 40% vs. 45% (P=0.005)、6% vs. 8% vs. 18%(P< 0.001)、3% vs. 11% vs. 19%(P=0.004)。综上, 大多数年轻患者, 无论MPN亚型如何, 都属“ 低风险” 类别; 而“ 高危” 人群主要局限于年龄较大的人群(P< 0.001)。
Kaplan-Meier生存曲线分层分析显示, 三个年龄亚组(≤ 40岁、41~60岁、> 60岁)的中位OS分别为PV组37年、22年和10年, ET 组35年、22年和11年, PMF 组20年、8年和3年。各年龄段间OS差异有统计学意义P< 0.001。
PV患者中, 动脉血栓形成史是唯一显著影响OS的变量(风险比=20, 95%可信区间 2.3~167, P< 0.001)。多变量分析中, 异常染色体核型是MFFS的一个显著风险因素(风险比=24.2, 95%可信区间3.9~187, P=0.001)。ET患者中, 白细胞增多(> 25× 109/L)是LFS的一个独立预测因子(风险比=56, 95%可信区间2.2~1414, P=0.02)。在PMF中, SRSF2 (风险比=42, 95%可信区间3.5~1068, P=0.005)和ASXL1(风险比=9.7, 95%可信区间1.4~190, P=0.02)突变是OS的独立预测因子, 体质症状(P=0.004)和ASXL1突变(P=0.02)为多元分析中LFS的独立预测因素。
与老年患者相比, 年轻MPN患者显示出更优的生存期和较低危的遗传学背景。
近十余年来经典的Ph阴性MPN在诊治上取得了显著进展, 明确了JAK2V617F、CALR、MPL基因突变在Ph阴性MPN诊断和预后的意义, 提出了最新的PV、ET和PMF的WHO(2016)诊断标准, 并先后建立相应的预后积分系统。无论PV的预后积分系统、ET国际预后积分系统(IPSET)还是PMF预后积分系统(包括IPSS、DIPSS、DIPSS-PLUS和MIPSS70)中, 年龄60岁以上均是不良预后因素之一。在诊断Ph阴性MPN时的中位年龄在60岁左右, 根据2008年美国国立癌症研究院的数据, 年龄小于40岁的患者占MPN的6.6%; 因此上述MPN预后积分系统基本上都是基于老年患者群体上提出的。国际上已有年龄小于40岁的MPN患者生存预后不同于老年患者的文献报道, 但缺乏大样本量、长期随访、完整数据资料的年轻MPN患者的研究。
在我国多个较大样本量的MPN研究均表明, 我国Ph阴性MPN患者的发病年龄低于国外的研究报道, 年轻患者在Ph阴性MPN中所占比例更高:一项1 648例Ph阴性MPN研究中, 年龄小于40岁患者占19.9%[1]; 一项816例PV患者的研究中, 诊断时的中位年龄是53岁(18~86岁), 低于国外报道的中位年龄[2]; 在两项746~970例ET患者的研究中, 年龄≤ 60岁患者的比例为74%, 高于国外报道的年轻患者在ET中的比例[3, 4]; 在两项642~1 305例PMF患者的研究中, 年龄≤ 65岁患者比例为80.1%~82%, 远高于国外报道的年轻患者占PMF患者比例[5, 6]。因此, 对于年轻MPN患者临床特征和预后因素的研究在我国显得更为重要, 具有显著的临床意义。我国既往有小样本量年轻MPN的临床特征与预后研究报道:一项对125例年龄≤ 40岁ET患者的研究结果表明, 与既往报道的整体ET人群相比, 年轻ET患者的JAK2V617F突变阳性率低、CALR突变阳性率高; 年轻ET患者严重血栓事件的发生率低(14.4%); 多因素分析表明, JAK2V617F突变、既往血栓史及白细胞计数≥ 12.0× 109/L为年轻ET患者血栓事件的独立危险因素[7]。一项对56例年龄≤ 45岁PMF患者的研究结果表明, 血红蛋白< 100 g/L和有体质性症状是年轻PMF患者的不良预后因素[8]。我国尚缺乏大样本量的三种Ph阴性MPN疾病年轻患者的临床特征和预后因素的比较研究。
因此, 与既往研究报道相比, 本研究具有以下特点:①本研究是迄今为止时间跨度最长(约50年)、临床资料完善且同时涵盖PV、ET和PMF三种MPN疾病的大样本量的比较研究; ②本研究证实了PV、ET和PMF三种MPN疾病年轻患者的生存预期显著高于老年患者; ③本研究证实了与PV和ET患者相比, PMF患者在任何年龄组的生存时间均显著缩短; ④本研究全面地分组分析了年龄≤ 40岁的年轻MPN患者的OS、MFFS、LFS和TFS的影响因素:年轻PV患者中, 血栓史是影响生存的不良预后因素, 异常染色体核型是进展为骨髓纤维化的不良预后因素; 年轻ET患者中, 白细胞计数> 25× 109/L是进展为白血病的独立的不良预后因素; 年轻PMF患者中, SRSF2突变和ASXL1突变是影响生存的独立不良预后因素, 有体质性症状和ASXL1突变是进展为急性白血病的独立不良预后因素。上述研究结果表明, 年轻MPN患者的生存期显著延长, 且PV和ET患者的生存期显著高于PMF患者, 因此MPN患者的准确诊断显得尤为重要, 尤其对于年轻患者; 本研究对于年轻MPN患者的生存预后评估可能是迄今为止最可靠的结果, 为不同疾病的年轻MPN患者的准确预后评估和治疗策略制定提供了最新的资料。
当然, 本研究也存在一些不足:①本研究是单中心的回顾性研究, 其结果有待于多中心的前瞻性研究予以证实; ②本研究纳入的是年龄≥ 18岁的成年MPN患者, 其结果是否适用于年龄< 18岁的MPN患者, 有待于进一步研究予以证实; ③由于入组患者的时间跨度长, 本研究中并非所有患者均进行了驱动基因(JAK2、CALR和MPL)和非驱动基因(SRSF2、ASXL1、U2AF1、IDH1/2、EZH2等)突变检测, 可能对结果带来偏倚; ④在WHO(2016)诊断标准中, 已将PMF分为纤维化前(pre-fibrotic)期/早(early)期PMF和明显纤维化(overt fibrotic)期PMF, 并提出了相应的诊断标准[9]。既往已有多项研究表明, 纤维化前期PMF患者的白血病转化率和死亡率均不同于ET和明显纤维化期PMF, OS和LFS介于后二者之间[10, 11]。因此, 对于年轻PMF患者进行准确的分型诊断, 有助于对其预后进行更准确的评估, 但本研究并未对PMF患者进行分型诊断, 有待于今后进一步进行亚组分析; ⑤随着MPN治疗的进展, JAK抑制剂已应用于骨髓纤维化患者, 多个研究表明芦可替尼可显著延长骨髓纤维化患者的OS, 并使骨髓纤维化患者的骨髓纤维化程度改善或稳定[12, 13, 14]。因此, JAK抑制剂的应用将改变骨髓纤维化患者的预后, 对PMF患者是否应用JAK抑制剂治疗进行分层研究, 有助于对年轻PMF患者提出更佳的治疗时机和策略。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|