马红(1972-),女,山东淄博人,主任医师、教授,医学博士,硕士研究生导师,研究方向为肥胖与糖尿病。
目的 系统评价高脂饮食与小鼠/大鼠肠道微生态结构改变的相关性。方法 计算机检索PubMed、EMBASE、Cochrane 图书馆、中国生物医学文献数据库、中国知网、维普期刊数据库、万方数据库,查找关于高脂饮食与肠道微生态相关性的随机对照研究。对纳入的研究利用RevMan 5.3进行Meta分析。结果 共纳入研究15篇,皆是随机对照实验研究。Meta分析结果表明,高脂饮食小鼠/大鼠肠道双歧杆菌的含量减少(标准化均数差-4.08,95%可信区间-6.10~-2.05, P=0.000 1);高脂饮食对小鼠拟杆菌水平变化无明显差异(标准化均数差-0.5,95%可信区间-1.73~0.72, P=0.42),而高脂饮食的大鼠内拟杆菌明显减少(标准化均数差-1.46,95%可信区间-2.58~-0.35, P=0.01);同时肠道内乳酸杆菌的含量减少(标准化均数差-4.52,95%可信区间-7.39~-1.52, P<0.002);而肠道肠杆菌含量增加(标准化均数差3.93,95%可信区间0.53~7.32, P=0.02)。结果也表明高脂饮食后小鼠/大鼠体质量增加(标准化均数差3.74,95%可信区间2.81~4.67, P<0.000 01);血浆总胆固醇(标准化均数差3.52,95%可信区间2.39~4.65, P<0.000 01)及甘油三酯(标准化均数差1.87,95%可信区间1.14~2.60, P<0.000 01)在高脂饮食后均显著升高。结论 高脂饮食可导致小鼠/大鼠肠道微生态结构的改变。肠道微生态结构改变可能在肥胖、高脂血症等代谢性疾病的发生中发挥重要作用。
Objective A meta analysis was made to review the relationship between high fat diet and the changes of intestinal microecology in mice/rats systematically.Methods Databases included PubMed, EMBASE, the Cochrane Library, China Biology Medicine disc, China National Knowledge Infrastructure, VIP database and Wanfang database were searched to collect the randomized controlled studies on the correlation between high fat diet and intestinal microecology. The meta analysis was performed using the RevMan 5.3.Results All of the 15 studies were randomized controlled trials. The results of meta analysis showed that intestinal bifidobacteria decreased after high fat diet (SMD -4.08,95%CI -6.10~-2.05, P=0.000 1). There was a decrease in intestinal bacteroides in mice/rats after high-fat diet (SMD-0.5,95%CI -1.73~0.72, P=0.42; SMD -1.46, 95%CI-2.58~-0.35, P=0.01), and there was a significant decrease in intestinal lactobacillus as well(SMD -4.52,95%CI -7.39~-1.52, P<0.002). However, there was an increase in intestinal enterobacteriaceae in mice/rats after high-fat diet(SMD 3.93, 95%CI 0.53~7.32, P=0.02). Also, the results showed that the weight of mice/rats increased after high-fat diet(SMD 3.74, 95%CI 2.81~4.67, P<0.000 01). Concomitantly, the plasma total cholesterol (SMD 3.52,95%CI 2.39~4.65, P<0.000 01) and triglyceride (SMD 1.87, 95%CI 1.14~2.60, P<0.000 01) in the mice/rats increased significantly after the high fat diet.Conclusion High fat diet can lead to the change of intestinal micro ecological structure in mice/rats. The change of intestinal micro ecological structure may play an important role in the pathogenesis of metabolic diseases such as obesity and hyperlipidemia.
众所周知, 病从口入, 不健康的饮食不仅可引起消化系统症状, 高脂、高盐、高糖饮食还可导致肥胖、脂肪肝、高血压、糖尿病等多种代谢性疾病的发生。随着人们经济生活水平的提高, 肥胖症的发病率越来越高, 已成为严峻的公共卫生危机之一。肥胖症是指体内脂肪堆积过多和(或)分布异常、体质量增加, 是遗传、环境等多种因素相互作用所引起的慢性代谢性疾病。2014年, 世界卫生组织报告显示, 全球有超过19亿的成年人超重(18岁及以上), 这些人中超过6亿是肥胖者。仅2013年统计的全球5岁以下儿童超重或肥胖者就达0.42亿[1]。据统计从2010年开始每年全球死于超重、肥胖及其相关疾病的人超过了340万人[2]。我国肥胖症患病率也迅速上升, 因此肥胖已成为困扰人类健康的最受关注的代谢性疾病之一。
目前肠道菌群(肠道微生态结构)与代谢性疾病(肥胖、高脂血症、2型糖尿病等)的相关性研究日益受到了关注。人体胃肠道可容纳100多万亿种的细菌并构成了肠道微生物群。肠道微生物丛被定义为肠道内的小生物群或其基因组, 其内的细菌数量是人体细胞的10倍, 通过调节机制使这些微生物定植和生存在宿主机体内, 并构成一个共生关系[3]。人类宿主提供营养丰富的环境给肠道微生物丛, 反过来, 肠道微生物丛提供了人类自己无法完成, 但又是机体不可或缺的功能, 如代谢功能(结肠发酵和短链脂肪酸相关的生产), 保护功能(加强抗外源性或机会病原体定植, 抗菌肽分泌)及构造功能(肠上皮和免疫系统的成熟)[3]。
近年来, 国内外展现较多有关高脂饮食对肠道菌群结构影响的研究, 然而各研究目前在结论上存在争议, 所以我们决定做一项Meta分析, 探索高脂饮食与肠道微生态结构改变的相关性, 为开展相关临床研究与治疗提供参考和帮助。
计算机检索PubMed、EMBASE、Cochrane 图书馆、CNKI、VIP、CBM 和Wanfang 数据库, 查找关于高脂饮食与小鼠/大鼠肠道微生态结构改变相关的随机对照研究(randomized controlled trial, RCT), 检索时间均为建库至2017年1月23日。英文检索词包括“ Obesity、 Obese、Diets、 High Fat、High Fat Diet、 Microbiota、Intestinal Microbiom、Intestinal Micro ecology、Intestinal Micro flora、Gastrointestinal Microbiomes、Mice、Rats” 。中文检索词包括 “ 肥胖、高脂饮食、肠道微生态、肠道微生物丛、肠道菌群、小鼠、大鼠” 。手工检索相关会议论文、科技报告及杂志。
1.2.1 纳入标准
(1)研究类型为RCT, 无论是否采用分配隐藏法和盲法; (2)研究对象为小鼠/大鼠, 其种类和性别不限; (3)干预措施:高脂饮食控制, 不严格限制饮食成分组成; (4)实验组和对照组的基线资料比较差异无统计学意义; (5)有提供足够的数据信息, 可以进行Meta 分析。
1.2.2 排除标准
(1)非RCT的文献; (2)重复报道的文献; (3)报道信息太少或数据不完整以至于无法采用的文献; (4)自身对照试验研究; (5)通过各种渠道未能获得全文; (6)原始研究中的数据, 本研究无法采用者。
数据由2位研究者独立提取, 提取过程是双盲的, 提取内容包括:第一作者、出版年份、样本量、研究对象的特征、干预措施等。分析结局指标包括:肠道菌群(乳酸杆菌、拟杆菌、双歧杆菌变化)和血脂水平变化。各结局指标采取原文献定义的数据。
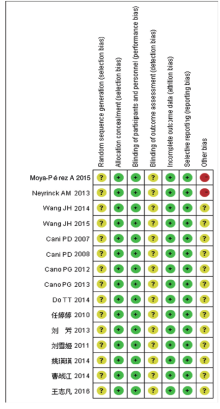
按照Cochrane 偏倚风险评估工具(5.3版), 对纳入研究的文献分别作出“ 低偏倚风险(low risk)” 、“ 不清楚(unclear risk)” 、“ 高偏倚风险(high risk)” 的判断。对纳入文献的方法学质量进行评价, 评价内容包括:(1)随机序列产生(选择偏倚); (2)分配方案是否隐藏(选择偏倚); (3)对研究者和受试者施盲(实施偏倚); (4)研究结局的盲法评价(测量偏倚); (5)结局数据的完整性(随访偏倚); (6)是否选择性报告结果(报告偏倚); (7)是否有其他偏倚来源(其他偏倚)。
采用Cochrane协作网提供的RevMan 5.3软件进行Meta分析。对于连续型变量采用标准化均数差(standardized mean difference, SMD)及其95%可信区间(confidence interval, CI)表示效应指标分析结果, 以α =0.05为检验水准。各纳入研究结果间采用异质性检验, 根据I2判断异质性大小, I2≤ 25%为低度异质性, 25%< I2< 50%为中度异质性, I2≥ 50%为高度异质性。若各纳入研究结果同质性好(P> 0.1, I2< 50%), 采用固定效应模型进行Meta 分析, 反之则采用随机效应模型进行Meta 分析。本文的文献由于干预时间的不同及小鼠品种的原因, 异质性差异过大, 故使用随机效应模型进行Meta分析。研究对异质性大的结局指标进一步根据研究对象品种(小鼠或大鼠)或标本来源(粪便或盲肠内容物)的不同进行亚组分析。对于无法合并的指标进行描述性分析, 整合结果。
同时采用敏感性分析探索研究中的异质性来源, 删除偏倚度较高的文献, 用于检测Meta分析结果的稳定性。
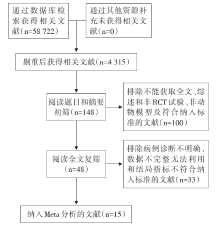
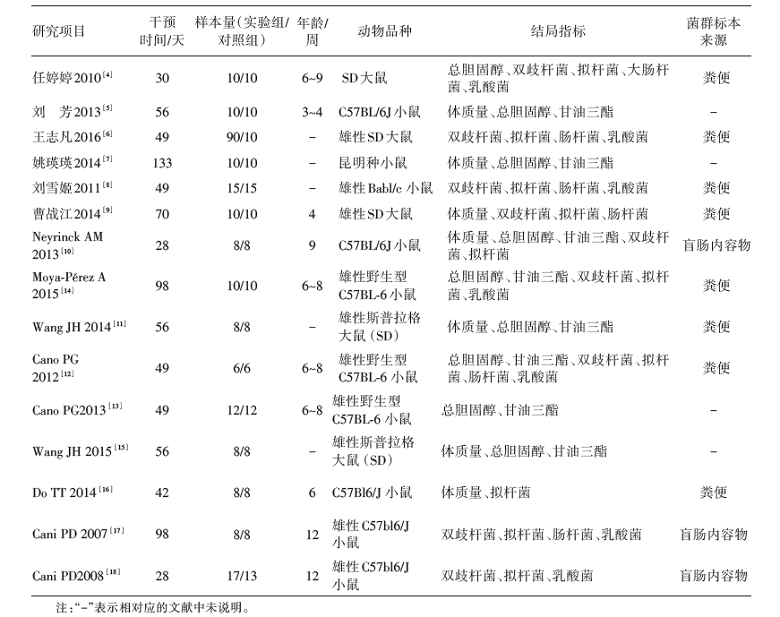
根据纳入标准和质量控制要求, 剔除不符合要求的文献, 文献筛选流程见图1。最终纳入15 篇研究文献[4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18], 中文文献6篇, 英文文献9篇, 文献共纳入366个研究对象, 其中实验组230例, 对照组136例。各项研究的干预措施均为实验组给予高脂配方、对照组给予普通配方。纳入文献的一般情况见表1。
| 表1 纳入文献的一般情况-4座位的带型 |
所有文献均未描述随机分配方法及随机数字产生的方式, 但均提及随机分配, 所以选择性偏倚均是未确定的。因该研究为动物模型, 故不存在分配隐藏及实施偏倚的问题。所有文献均未提及是否对评价者实施盲法, 故测量偏倚均不清楚。所有预先申明的结局都已报告, 故无报告偏倚。所有文献均无失访、脱失样本量, 故无随访偏倚。因有2篇纳入的文献在实验过程有行口服葡萄糖耐量试验(oral glucose tolerance test, OGTT), 导致结果异质性较大, 故该2篇文献的其他偏倚为高风险, 其余文献未说明其他影响因素, 故为不清楚。综上, 纳入的文献2篇为高偏倚风险, 其余13篇均为不清楚。具体见图2。
将高脂饮食所致肠道微生物丛(双歧杆菌、拟杆菌、肠杆菌、乳酸菌)含量改变、体质量、血浆总胆固醇及甘油三酯变化量7项结局指标所获证据按GRADE系统进行分级, 其证据质量分别为低级和中等, 其中中等的有:双歧杆菌、体质量、血浆总胆固醇、血浆甘油三酯, 低级的有:拟杆菌、肠杆菌、乳酸菌。
2.4.1 双歧杆菌
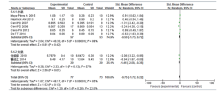
共8篇文献研究双歧杆菌变化量, 共纳入受试对象238例, 实验组161例, 对照组77例。文献存在一定的异质性, 亚组分析结果表明:95%CI横线大部分落于森林图无效线左侧, 所以实验组效应量小于对照组, 高脂饮食组肠道双歧杆菌含量较普通饮食组少, 且差异均有统计学意义(排泄物:SMD-4.45, 95%CI -7.63~-1.27, P=0.006; 盲肠内容物:SMD -3.51, 95%CI -6.03~-0.99, P=0.006; 合并SMD -4.08, 95%CI -6.10~-2.05, P=0.000 1)。见图3。异质性检验结果提示, 异质性并非检测标本来源的差异。另外, 敏感性分析显示:单个研究所占权重相当, 排除单个研究后, 异质性均未见明显下降。
2.4.2 拟杆菌
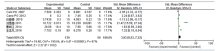
共8篇文献研究拟杆菌变化量, 共纳入受试对象150例, 实验组77例, 对照组73例。文献存在较大的异质性, 亚组分析结果表明:高脂饮食组肠道双歧杆菌含量较普通饮食组少, 其中小鼠一组的差异无统计学意义(SMD -0.5, 95%CI -1.73~0.72, P=0.42), 大鼠一组的差异有统计学意义(SMD -1.46, 95%CI -2.58~-0.35, P=0.01), 汇总后差异无统计学意义(SMD -0.75, 95%CI -1.72~0.22, P=0.13)。见图4。异质性检验结果提示, 异质性可能来源于研究对象的差异, 但不能完全解释。
2.4.3 肠杆菌
共6篇文献研究肠杆菌变化量, 共纳入受试对象198例, 实验组139例, 对照组59例。文献的异质性检验结果认为各研究之间存在高度异质性(I2=97%, P< 0.000 01), 遂使用随机效应模型分析, 结果提示SMD为3.93, 95%CI为0.53~7.32, 这表明高脂饮食可引起小鼠/大鼠肠道肠杆菌含量增加, 差异有统计学意义(P=0.02)。见图5。
2.4.4 乳酸杆菌
共8篇文献研究乳酸杆菌变化量, 共纳入受试对象244例, 实验组164例, 对照组80例。文献存在较大的异质性, 亚组分析结果表明:高脂饮食组肠道乳酸杆菌含量大部分较普通饮食组少, 两组的差异均有统计学意义(小鼠:SMD -3.26, 95%CI -5.86~-0.65, P=0.01; 大鼠:SMD -6.53, 95%CI-11.55~ -1.52, P=0.01; 合并:SMD -4.52, 95%CI -7.39~-1.52, P< 0.002)。见图6。亚组分析时各组异质性仍很大, 提示该项指标的异质性并非由于研究对象的差异所致。
2.4.5 体质量
共7篇文献研究体重变化量, 共纳入受试对象124例, 实验组62 例, 对照组62例。文献的异质性检验结果认为各研究之间存在异质性(I2=50%, P=0.06), 故应用随机效应模型进行分析, SMD 合并效应量为3.74, 95%CI 为2.81~4.67, 这表明高脂饮食可引起小鼠/大鼠体质量增加, 差异有统计学意义(P< 0.000 01), 见图7。由于该结果异质性大, 对纳入研究进行敏感性分析, 在排除了Neyrinck AM 2013[10]的研究后, 异质性明显下降(I2=23%, P=0.26), 其余单个研究所占权重相当, 排除其余单个研究后, 异质性均未见明显下降, 对异质性较大的Neyrinck AM 2013[10]研究进一步细读原文, 发现该研究在实验第3周对所有实验的研究对象行OGTT试验, 考虑此项干扰因素可能为该项研究异质性偏大的来源。
2.4.6 血浆总胆固醇
共9篇文献研究血浆总胆固醇变化量, 共纳入受试对象164例, 实验组82 例, 对照组82例。文献存在一定的异质性, 亚组分析结果表明:高脂饮食组血浆总胆固醇较普通饮食组明显增加, 且两组差异均有统计学意义(小鼠:SMD 4.67, 95%CI 3.05~6.29, P< 0.000 01; 大鼠:SMD 1.96, 95%CI 1.27~2.66, P< 0.000 01; 合并SMD3.52, 95%CI 2.39~4.65, P< 0.000 01)。见图8。结果提示, 分组后小鼠一组的异质性仍较大, 对该亚组进一步行敏感性分析后, 发现排除Moya-Pé rez A 201514]及Neyrinck AM 2013[10]两项研究后, 异质性明显下降(I2=0%, P=0.81), 其余的单个研究所占权重相当, 排除单个研究后, 异质性均未见明显下降, 对异质性较大的研究进一步细读原文发现, Moya-Pé rez A 2015[14]及Neyrinck AM 2013[10]两项研究分别于实验第13周及实验第3周对所有试验的研究对象进行了OGTT试验, 因OGTT试验对血浆胆固醇的波动可能会产生一定的影响, 因此考虑OGTT试验可能为这两项研究异质性偏大的主要来源。综上, 本项指标异质性主要来源于研究对象的不同。
2.4.7 甘油三酯
共8篇文献研究血浆甘油三酯变化量, 共纳入受试对象144例, 实验组72 例, 对照组72例。文献存在一定的异质性, 亚组分析结果表明:高脂饮食组血浆甘油三酯较普通饮食组明显增加, 且差异均有统计学意义(小鼠:SMD 2.12, 95% CI 1.14~3.10, P< 0.000 1; 大鼠:SMD 1.26, 95% CI 0.48~2.03, P=0.002; 合并SMD 1.87, 95%CI 1.14~2.60, P< 0.000 01), 见图9。分组后小鼠一组的异质性仍较大, 因各项研究所占权重相当, 排除单个研究后, 异质性均未见明显下降, 遂无法进一步行敏感性分析。
研究表明肥胖与较低的微生物多样性相关, 表现为肠道微生物菌群的转变, 例如硬壁菌门含量的增加和拟杆菌门含量的减少, 肥胖者的肠道微生物丛能更有效从食物中获取能量。另外, Neyrinck等[10]的研究表明对于啮齿类动物和人类通过食用富含益生元的膳食碳水化合物能够调整肠道微生物丛组成, 并减少炎症反应、葡萄糖耐受不良、胰岛素抵抗、肥胖和2型糖尿病[10, 19, 20, 21]。肠道微生物丛能够干扰和调节多种宿主的代谢和免疫学传播路径, 它们中的一些菌群能够调节肠道和其他组织如肝脏[22, 23, 24]及脂肪组织的相互联系[22, 25]。有关的动物实验证明肠道微生物能通过影响能量的吸收、炎症反应和神经内分泌系统来调节体质量变化[26]。人类的观察性研究显示, 双歧杆菌数量的减少和肥胖的发展有一定的关系[26]。而且, 在前期研究中已证明, 实验动物使用富含益生元或益生菌的饮食方案干预, 能够使肠道中双歧杆菌数量增加, 肠道中双歧杆菌数量的增加能进一步改善与肥胖相关的代谢紊乱和免疫功能下降[13, 26]。
本研究共纳入15项RCT, 系统评价了高脂饮食小鼠/大鼠肠道微生态结构变化、体质量、血浆总胆固醇和甘油三酯变化量的结局指标。根据Cochrane偏倚评价手册评价结果, 15个纳入研究[4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18] 中2篇为高偏倚风险, 13篇为不清楚。高脂饮食所致肠道微生态结构改变及对肥胖和高胆固醇血症形成的影响依据所获证据按GRADE系统评级后, 其证据质量分别为低级和中等。由于相关的文献较少, 本研究将同为啮齿类的小鼠和大鼠作为研究对象纳入, 其中研究小鼠的有10篇文献[5, 7, 8, 10, 12, 13, 14, 16, 17, 18], 研究大鼠的有5篇[4, 6, 9, 11, 15]。小鼠是哺乳动物中体型最小的, 新生鼠仔一般约1.5 g, 45天体质量可达18 g以上; 大鼠的新生鼠体质量一般5~6 g, 45天体质量常常可达180 g以上, 生长较小鼠迅速, 目前国内外尚未见相关数据比较两者在肠道微生态结构及血脂水平方面差异性的文献报道, 这是本研究的局限性之一。另外, 纳入的文献中, 10篇有肠道菌群相关的结局指标, 其中有7篇[4, 6, 8, 9, 10, 14, 16]肠道微生物标本来源于粪便, 3篇[10, 17, 18]标本来源于盲肠内容物。由于本研究纳入文献的研究对象样本量相对不足, 各研究观察时间不一致, 观察环境不同, 研究对象的品种、年龄及干预量不一, 导致各研究质量之间存在差异, 不同的研究结论可能不一致, 因此本研究在进行资料合并时, 存在结局指标异质性较大的问题。根据各结局指标异质性偏大及单位不同的问题, 我们对纳入的各项结局指标均使用SMD合并效应量。在行亚组分析时, 对于肠道微生物群均分别按照研究对象(小鼠/大鼠)和标本来源(粪便/盲肠内容物)进行亚组分析, 并选取数据合并后异质性相对小的一种分法纳入分析。
本研究结果显示, 高脂饮食可引起小鼠/大鼠肠道微生物丛结构的改变, 其中, 亚组分析显示:高脂饮食后粪便及盲肠内容物中双歧杆菌含量减少; 无论小鼠还是大鼠, 高脂饮食后乳酸杆菌含量均减少, 血浆总胆固醇和甘油三酯水平升高。高脂饮食还可引起小鼠/大鼠肠杆菌的含量增加, 体质量也明显增加。
目前, 国内外研究报道的高脂饮食改变肠道微生态结构, 从而导致代谢紊乱的机制主要有以下几方面:一方面, 高脂饮食可改变肠道菌群组成(主要为双歧杆菌减少), 增强肠壁通透性, 使细菌细胞壁产物脂多糖大量释放入血浆, 引起血浆脂多糖水平升高, 进而使脂多糖与CD14/TLR4复合体结合增加, 激活巨噬细胞, 从而导致炎症反应、胰岛素抵抗等代谢紊乱[28, 29]; 另一方面, 通常人体摄入碳水化合物后, 未吸收部分在结肠可通过双歧杆菌等菌群生成中间产物(乳酸盐等) , 再通过产丁酸菌及拟杆菌等酵解生成短链脂肪酸, 如丁酸、丙酸、乙酸等, 参与机体代谢, 其中短链脂肪酸介导的G蛋白偶联受体(GPR43)激活后, 可抑制脂肪细胞中的胰岛素信号转导, 使脂肪组织中的脂肪堆积得到抑制, 并促进脂肪及葡萄糖在其他组织中代谢。当高脂饮食引起肠道菌群紊乱时(双歧杆菌、拟杆菌等减少), 短链脂肪酸生成减少, 可促进脂肪堆积, 增加胰岛素抵抗[30, 31]; 短链脂肪酸可能具有促进肠道肽分泌的作用, 当短链脂肪酸生成减少时, 肠道L细胞分泌胰高血糖素样肽-1减少, 从而降低胰岛素的敏感性[32]。而且, 短链脂肪酸还具有降低食欲的作用, 这可能是通过调节大脑弓状核内神经元的活动起作用的, 所以当高脂饮食引起短链脂肪酸减少时, 可导致食欲增强, 进食量增加[30]。
综上所述, 本研究Meta分析结果显示, 高脂饮食可引起小鼠/大鼠肠道微生物丛结构的改变, 其中益生菌(双歧杆菌、乳酸杆菌)含量下降, 常规共生菌(肠杆菌)含量增加, 并伴有肥胖、高脂血症(血浆总胆固醇、甘油三酯水平上升)等代谢紊乱的发生。通过饮食结构的调整, 从而改变肠道微生态的结构, 可能会成为治疗肥胖及相关代谢性疾病的一个新策略。
由于本研究数据的局限性, 其分析并不能阐明其原理, 还需要大量高质量、大样本量、设计良好、多中心的临床随机对照研究来进一步完善验证。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|