作者简介:
张国淳(1978-),男,广东潮州人,医学博士,副主任医师,主要研究方向为乳腺癌的多学科综合治疗。
毋庸置疑, 肿瘤治疗已经逐渐进入精准医疗的大时代[1]。与之相应的是, 乳腺癌新的诊疗模式的转换过程也体现出同样的时代烙印, 并成为过去十余年间各种相关研究的内生性驱动力, 推动了诊疗理念的根本性转换— — 曾经的追求最大可耐受治疗已经被现有的实现最小有效治疗所取代, 并继续向个体化精准治疗稳步前进[2]。其成败的关键则在于指导临床决策的引导系统能否建立。
作为重要的实体肿瘤, 乳腺癌的诊疗决策长期依赖于TNM分期。然而, 这种传统的乳腺癌分期体系, 大体上基于对肿瘤临床解剖特征的描述, 并不能反映早期乳腺癌在生物学上客观存在的异质性。于是, 在解剖分期的基础之上, 引入并整合描述乳腺癌的生物学信息体系, 进行更加准确的分类与分型, 使之形成预后分期体系, 则是精准治疗临床决策的科学演进路线[3]。过去十余年以来, 其进程大致可以梳理成分子分型及多基因表达谱检测两个重要的阶段。
伴随着乳腺癌分子生物学的深入发展, 对于肿瘤细胞受体状态的研究也获得了长足的发展。采用免疫组化及原位杂交技术, 可以对乳腺癌细胞的三种重要受体及核增殖指数进行量化, 进而实现乳腺癌的分子分型。这一阶段完成并且成为标准体系的标志是2011年形成的St. Gallen专家共识[4]。在这一版的共识中, 根据雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、人表皮生长因子受体2 (human epidermal receptor 2, HER2)及Ki-67这4个指标的不同组合状态分类, 最终确定了乳腺癌的4个分子亚型, 分别为luminal A型、luminal B型、HER2阳性型和三阴性型。同时, 共识明确提出分子分型与预后及疗效预测相关, 确立了各种亚型的基本治疗策略, 例如在HER2阳性型中为化疗联合靶向治疗, 在三阴性型中为化疗, 而在激素受体(hormone receptor, HR)阳性型中则为内分泌治疗或联合化疗。分子分型的最终明确, 标志着乳腺癌诊疗模式正式跨进了“ 个体化治疗” 的阶段。
分子亚型的应用虽然已经成功地将乳腺癌由单一疾病细分为几种重要的亚型, 并为诊疗决策提供了重要依据, 但事实上它离真正的精准治疗仍有很大的差距, 原因在于少数亚型的分层体系显然无法精准地描述肿瘤之间因大量基因差异性表达所导致的巨大异质性。同时, 对于早期可手术乳腺癌而言, HR阳性HER2阴性亚型比例很高, 占所有乳腺癌总例数的60%以上[5], 其预后及治疗的需求客观上存在着很大的进一步分层的空间, 绝非一两种亚型的分类就可以满足个体化治疗的需要。正是上述这种对精准化分层的进一步需求, 使多基因检测(multi-gene assay, MGA)在过去十年中得到了长足的发展, 形成了乳腺癌精准个体化治疗的重要进程。
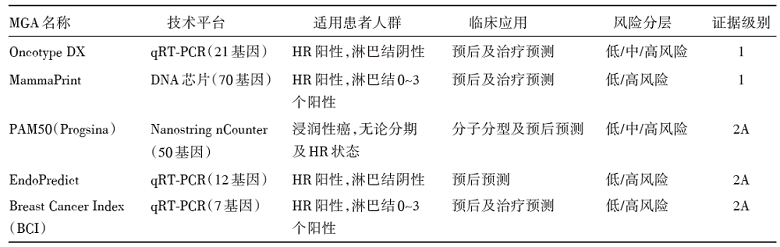
MGA的目的是在分子分型的基础上, 进一步整合乳腺癌内在的分子生物学信息, 从而达到区分同一亚型特别是ER阳性乳腺癌的不同预后并进行疗效预测, 以指导进一步的辅助治疗决策。其基本思路是, 在乳腺癌肿瘤组织标本中检测与肿瘤细胞抗凋亡、生化、增殖、血管滋养、转移等相关的信号通路中若干个代表性基因的表达水平, 进行量化后, 建立相应的数学模型, 以预测患者的预后, 同时检测疗效的预测效能。目前在早期可手术乳腺癌, 主要检测的多基因表达谱有21个基因的Oncotype DX[6]、70个基因的MammaPrint[7]、12个基因的EndoPredict[8]、7个基因的BCI[9]以及50个基因的Prosigna[10]。除了Prosigna的指征人群不区分ER状态之外, 其余4个主要的MGA的指征人群均为ER阳性HER2阴性的早期乳腺癌。这些MGA工具的开发, 均以回顾性研究为起始, 后续再进行大规模的前瞻性临床研究设计的验证, 其可靠性也得到了国内外各种指南的背书。早在2008年, NCCN指南已经把21基因Oncotype DX列为辅助治疗临床决策的重要依据, 而10年之后的2018年, NCCN指南进一步列入后续4种MGA[11], 见表1。第八版的AJCC肿瘤分期中, 在保留了传统解剖学分期的同时, 也把21基因检测列为预后分期的Ⅰ 类证据, 标志着乳腺癌分期全面进入了解剖学与生物学整合的新时代[12]。今年更新的2019年中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)乳腺癌诊疗指南, 也推荐Oncotype DX和MammaPrint检测, 以减少过度治疗, 推进个体化治疗的实践[13]。
| 表1 NCCN指南纳入的早期乳腺癌MGA[11] |
MGA的应用人群主要是HR阳性HER2阴性的早期可手术乳腺癌患者。以21基因检测为例, 其应用主要有两方面, 一是用于对预后的预测, 二是用于对特定治疗手段(化疗或内分泌治疗)获益程度的预测。
以TAILORx研究为例, 21基因检测Oncotype DX得到的风险评分(risk score, RS)在0~10分者, 定义为低风险患者, 其远期复发风险仅为4%。而RS在11~25分的患者, 内分泌治疗之外的化疗并不能使患者获益。RS在16~25分的患者中, 年龄小于50岁的患者可以在化疗中获益。对于RS大于31分的高风险患者, 化疗可以明显降低复发风险。至于RS在26~30分的中风险患者能否避免化疗则未有可靠的循证医学证据, 需要临床医生谨慎考虑临床决策[14]。这样的决策过程, 把HR阳性HER2阴性的患者根据预后进行了更进一步的复发风险分层, 并根据分层结果就个体患者进行化疗额外获益程度的预测, 既可以使需要化疗的患者获得充分的治疗, 又可以使不需要化疗的患者避免了额外化疗带来的毒性及经济负担, 从而达到了个体化治疗的目的。其它MGA的临床应用也大致如此, 在此不再赘述。
最近有一篇荟萃分析对早期可手术HR阳性乳腺癌的MGA进行了成本效益分析[15]。纳入了31项研究, 总共有12 202例患者纳入了分析。涉及的MGA有21基因、70基因、50基因和12基因。主要研究指标是对比检测与不检测患者化疗的使用率、毒性、复发率以及费用进行了比较。结果发现, 与不做检测相比, 21基因及50基因的检测明显降低了5%~10%的化疗使用率, 而70基因与12基因检测则增加了3%的使用率。与不做检测相比, 应用MGA结果来引导临床决策的患者中, 总体的远处转移与预期值相比则减少了29%, 化疗引起的第二原发肿瘤发生率也相应地减少了。因此, 在MGA的导航下, 个体化辅助治疗既要避免部分低危患者的过度治疗也要为高危患者提供充分的治疗基本目标是可以实现的。在MGA的引导下, 乳腺癌诊疗的临床决策已经比较接近个体化精准治疗了。
MGA为早期可手术乳腺癌个体化治疗的临床决策提供重要的引导作用的同时, 也带来了一些有待解决的问题。首先是检测费用的可负担性及其成本效益的问题。前面提及的荟萃分析在肯定了MGA的意义及前景的同时, 也对患者的治疗总费用进行了测算。结果发现, 与未行MGA的患者相比, 行21基因检测的患者, 总体治疗费用明显下降, 有较好的成本效益。然而, 其它的3项MGA的患者中, 预测的总体费用却反而上升了。这与检测本身的费用较高、可负担性差有关, 也与不同检测项目本身对临床决策的影响有关, 因为并非所有的MGA都能够大幅度减少化疗的使用。
其次, 在中国的现实状况下的应用也存在着一些困难。目前为止, 仅有70基因检测在中国获得批准, 其它基因检测尚未在中国上市。然而, 不菲的检测费用, 是广泛开展应用的一大障碍。另一个容易被忽视的问题是, 中国人群乳腺癌的基因表达及突变位点与西方人群相比, 存在着明显的差异。在中国患者中直接应用MGA工具的分层标准是否合适还需要进一步的探讨。
随着二代测序(next generation sequencing, NGS)技术的迅速兴起, 在高通量的条件下对肿瘤基因表达的研究已经变得很容易实现, 区区十数个至数十个基因的小组合所包含的信息量已经显得不足。基于NGS甚至三代测序的高通量更大panel的MGA已经成为研究的方向之一。同时, 考虑到中西方乳腺癌患者基因表达背景的差异, 在中国人群中开展基因检测组合的设计及验证, 直接获得中国人群的循证医学证据, 将会是MGA的另一个发展方向。
当代科学发展犹为迅猛, 大大缩短了理论形成到实际应用之间的时间距离, 短短十余年间所取得的进展已经足够彻底改变过往一个多世纪所形成的治疗模式。在大胆拥抱乳腺癌诊疗新理念与新技术的同时, 也要善于思考并克服其问题与不足, 推动精准医学的不断发展。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|