| 王树森,中山大学肿瘤医院乳腺癌单病种首席专家,内科乳腺病区主任、主任医师、博士研究生导师。国家肿瘤质控中心乳腺癌质控专业委员会委员,中国乳腺癌筛查与早诊早治指南专家委员会委员,国家卫生健康委员会乳腺癌合理用药指南专家委员会委员,中国研究型医院协会乳腺癌专业委员会副主任委员,中国抗癌协会乳腺癌专业委员会常务委员,中国临床肿瘤协会乳腺癌专业委员会常务委员,中国抗癌协会肿瘤临床化疗专业委员会青委会副主任委员,广东省胸部肿瘤防治研究会乳腺癌专业委员会主任委员,广东省抗癌协会乳腺癌专业委员会副主任委员,广东省医师协会乳腺专科工作委员会副主任委员,广东省抗癌协会化疗专业委员会副主任委员。作为主要研究者主持了多项一、二及三期临床研究,承担国家自然科学基金重点项目/面上项目、广东省自然科学基金多项,发表SCI论文30余篇。重点研究方向:乳腺癌侵袭转移的分子机制,节拍化疗在乳腺癌治疗领域的应用,年轻乳腺癌的基因组学及临床诊治。 |
Reviewer's address:Department of Medical Oncology,Sun Yat-senUniversity CancerHospital,Guangzhou510060,China
Sparano JA, Gray RJ, Makower DF, et al. Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer[J]. N Engl J Med, 2018, 379(2):111-121.
1b。
21基因复发风险评分测定(Oncotype DX, Genomic Health)是一种通过测定特定乳腺癌基因, 为激素受体阳性、腋窝淋巴结阴性的乳腺癌患者提供预后预测信息的模型, 评分分值为0~100。当复发风险评分较高时(≥ 31, 或≥ 26), 预测患者接受辅助化疗可获益。当复发风险评分较低(0~10)时, 提示患者10年内的远处复发率极低并且不大可能受辅助化疗的影响。然而, 大部分复发风险评分中等的患者是否能够从辅助化疗中获益尚不明确。
探究21基因复发风险评分中等的患者从辅助化疗中获益的情况。
• 研究条件: 美国国家癌症研究所、东部肿瘤协作组等研究机构共同参与的国际临床注册研究TAILORx (Clinical Trials.gov NCT00310180)。
• 研究起止时间:2006-04-07至今。
• 研究方法:多中心、Ⅲ 期、随机对照临床试验。
• 研究对象:经活检证实为激素受体阳性、人表皮生长因子受体2(human epidermal growth factor 2, HER2)阴性, 腋窝淋巴结阴性, 年龄18~75岁, 并且根据美国国家综合癌症网络(National Comprehensive Cancer Network , NCCN)指南建议或考虑化疗的女性乳腺癌患者。
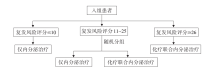
• 干预措施:干预措施和流程如图1所示。
• 评价指标:主要研究终点指标为无侵袭性疾病生存率(invasive disease-free survival), 定义为无侵袭性疾病复发、第二原发癌或死亡。次要研究终点指标为远处及局部无复发生存率、总生存率。
研究共纳入9 179名符合条件的患者, 其中6 711(69%)例患者复发风险评分为11~25, 这些患者被随机分配至仅接受内分泌治疗或接受化疗联合内分泌治疗。结果发现仅接受内分泌治疗组中患者的复发情况并不高于接受辅助化学联合内分泌治疗的患者。在长达9年的随访时间内, 两个治疗组的无侵袭性疾病生存率相似(内分泌治疗组 vs. 化疗联合内分泌治疗组:83.3% vs. 84.3%), 远处转移复发率(94.5% vs. 95.0%)及患者的总生存率(93.9% vs. 93.8%)也相近。进行亚组分析发现, 在≤ 50岁、复发风险评分为16~25的亚组中, 进行化疗联合内分泌治疗比单独内分泌治疗组远处复发率更低(P=0.004)。
在激素受体阳性、HER2阴性、腋窝淋巴结阴性并且具有中等21基因复发风险评分的乳腺癌患者中, 尽管≤ 50岁亚组人群可能从辅助化疗获益, 在总体人群中, 单独辅助内分泌治疗与化疗联合内分泌治疗相比具有相似的疗效。
米兰系列研究奠定了辅助化疗在乳腺癌综合治疗中的地位, 蒽环紫杉类药物的出现进一步提高了乳腺癌辅助化疗的疗效。但是辅助化疗的效能较低, 相当一部分的早期乳腺癌患者并不能从辅助化疗中获益。选择出能从辅助化疗中获益的患者是提高辅助化疗效能最为重要的环节。乳腺癌分子分型的到来为精准化疗带来了一缕曙光。研究发现, 对比三阴型和HER2阳性型, 管腔型乳腺癌对化疗反应率相对低, 从化疗中的获益非常有限。因此早在2013年St Gallen共识已经指出, 只有部分管腔A型的患者应考虑辅助化疗, 而管腔B型的绝大部分患者需行辅助化疗。可以说, 分子分型初步筛选出可免除化疗的部分人群。
随着基因检测时代的到来, 多基因技术分析很好地将管腔型高复发风险与低复发风险的患者区分开来, 为患者个体化、精准化辅助化疗提供了客观依据。其中基于NSABP B14和B20开发和验证的21基因复发风险评分在多个研究中证实了低复发风险的患者总体预后好, 从辅助化疗中获益有限, 单纯的辅助内分泌治疗即可达到98%以上的10年无复发生存。高复发风险评分的患者复发率较高, 因此也是能从辅助化疗中获益最大的人群, 对于这群患者, 辅助化疗和辅助内分泌治疗均是十分重要的治疗手段。而关于复发风险中危的患者是否能免除化疗或从化疗中获益呢?这就是TAILORx研究要回答的关键问题。
研究入组激素受体阳性、HER2阴性、无淋巴结转移的早期乳腺患者, 所有患者进行21基因复发风险评分, 评分为中等风险的患者(6 711例, 69%)随机分配为单纯内分泌治疗组或化疗联合内分泌治疗组, 主要的研究终点指标为无浸润性疾病生存率。结果显示在总人群中两组的无侵袭性疾病生存率和总生存率无明显差异。亚组分析发现年龄、化疗、复发风险评分有明显的交互作用, 年龄≤ 50岁、复发风险评分为16~25分的患者可从辅助化疗中得到获益, 化疗主要获益在减少远处转移事件的发生, 9年的绝对获益在16~20分组和21~25分组分别为1.6%和6.5%。亚裔人群(272例)并未发现存在种族异质性, 亚裔中等风险的患者不能从辅助化疗中获益。
TAILORx研究为约85%的激素受体阳性、HER2阴性早期乳腺癌患者(21基因低复发风险、大部分中等复发风险)免除辅助化疗提供了最高水平的证据。这项大型的前瞻性研究再次证实21基因复发风险评分模型可应用于临床, 为激素受体阳性、HER2阴性早期乳腺癌患者提供个体化的辅助治疗选择, 也为乳腺癌个体化治疗添上了浓重的一笔。基于此研究, 2019年V1版NCCN指南将21基因检测作为1类证据推荐, 认可了其预测辅助化疗及判断预后的价值。其他多基因检测工具, 包括已在国内上市的MammaPrint、12基因EPClin、50基因(PAM50)等等, 均可帮助判断患者的复发风险和预后, 其证据级别从1类至2A类不等。中国更新的CSCO指南中, 考虑到中国人群数据较少, 部分符合入组条件的患者也可考虑21基因复发风险评分或70基因进行辅助治疗前的复发风险评分的评估。结合到我国乳腺癌患者淋巴结转移比例相对高、大部分为绝经前等情况, 中国医生在临床上应合理地选择基因检测工具、合理地解读多基因检测报告, 为中国乳腺癌患者提供更具特色的个体化治疗。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|