作者简介:
肖刘牛(1991-),男,湖北襄阳人,硕士研究生,主要研究方向为结直肠癌规范化诊疗。
目的 系统评价Ⅱ期结直肠癌根治性手术后化疗与临床预后和相关危险因素之间的关联。方法 通过检索数据库,纳入从2007年3月至2018年3月所有符合纳入标准的、有关Ⅱ期结直肠癌根治性术后化疗的研究,用RevMan 5.3软件进行森林图分析,探讨术后化疗及化疗方案对总生存率和无复发生存率的影响,并详细分析伴有相关危险因素患者术后化疗与预后的关联。结果 共20篇文献纳入研究,累计289 684例患者。Meta分析合并结果显示,Ⅱ期结直肠癌患者根治性术后常规化疗,对总生存率无明显提高(比值比=0.98,95%可信区间0.84~1.16, P=0.85),对无复发生存率无明显提高(比值比=0.85,95%可信区间0.69~1.05, P=0.13)。相关危险因素的分析,将T4期、低分化或未分化、伴肠梗阻或肠穿孔、伴淋巴/血管或周围神经浸润、伴不充足淋巴结检出数的患者纳入研究,结果提示伴有相关危险因素的患者,术后化疗均可显著提高临床疗效( P<0.05)。以5-氟尿嘧啶为主的术后常规化疗方案中,奥沙利铂的加入对总生存率无显著提高(比值比=0.99,95%可信区间0.80~1.22, P=0.92),但对无复发生存率有显著提高(比值比=0.81,95%可信区间0.68~0.96, P=0.02)。结论 Ⅱ期结直肠癌患者根治性术后,若无相关危险因素,无需常规化疗。伴有相关危险因素的Ⅱ期结直肠癌患者,建议术后化疗。奥沙利铂+5-氟尿嘧啶+亚叶酸钙(FOLFOX)化疗方案,虽然无法提高总生存率,但是可以显著提高无复发生存率,控制术后复发。
Objective The purpose of this study is to evaluate the association of postoperative adjuvant chemotherapy and clinical prognosis, as well as the relative risk factors.Method Case-control studies assessing the postoperative adjuvant chemotherapy and clinical prognosis or relative risk factors for stage Ⅱ colorectal cancer were searched from databases between March 2007 and March 2018. Overall survival (OS), recurrence-free survival (RFS) were calculated and systematically analyzed by forest plot in RevMan 5.3.Result 20 case-control studies which covered a total of 289 684 patients were contained in this meta-analysis. The result of this study indicated that regular postoperative adjuvant chemotherapy for stage Ⅱ colorectal cancer would not improve OS(OR=0.98,95%CI 0.84~1.16, P=0.85)or RFS(OR=0.85,95%CI 0.69~1.05, P=0.13). However, when relative risk factors taken into consideration, such as T4 stage, poor differentiation or undifferentiation, intestinal obstruction or perforation, lymph or vascular or peripheral nerve invasion, inadequate sampled lymph nodes, patients would significantly benefit from postoperative adjuvant chemotherapy as a whole( P<0.05). For the chemotherapy regime, adding of Oxaliplatin into conventional 5-Fluorouracil would not affect the OS(OR=0.99,95%CI 0.80~1.22, P=0.92), but do improve RFS(OR=0.81,95% CI 0.68~0.96, P=0.02), which significantly decrease the postoperative recurrence.Conclusion For stage Ⅱ colorectal cancer patients, after curative operation, chemotherapy does not need to apply routinely, but need to use in those with risk factors. Although Oxaliplatin+5-Fluorouracil+Leucovorin (FOLFOX) does not significantly improve OS, the better RFS suggests a better control of postoperative recurrence.
结直肠癌是由内在基因和外在环境共同作用下形成的一种异质性疾病[1], 由于生活方式和饮食习惯的改变, 中国结直肠癌的发病率也有逐年上升的趋势, 目前正以年均4.2%的速度增长[2]。所有的结直肠癌患者中, TNM分期为Ⅱ 期(T3N0M0~T4N0M0)的患者, 根治性切除术后是否需要化疗, 以及化疗方案的选择目前仍是最具有争议性的话题。一方面, Ⅱ 期结直肠癌, 肿瘤已突破肠壁的固有肌层, 达浆膜下层甚至肠壁全层; 另一方面, Ⅱ 期结直肠癌, 无区域淋巴结侵犯及远处转移[3, 4]。随着Ⅱ 期结肠癌肿瘤浸润深度的增加, Ⅱ 期结肠癌患者的5年总生存率在60%左右, 且有20%的患者经历了术后复发[5]。术后化疗可以清除肉眼不可见的肿瘤微病灶, 有效地抑制肿瘤循环灶的生长。Ⅱ 期结直肠癌患者中, 大约75%接受了单纯手术治疗, 而剩余25%的患者在是否应该接受化疗之间摇摆不定[6]。有关Ⅱ 期结直肠癌根治性术后的危险因素, 不同指南的覆盖范围也层出不穷, 美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)定义的危险因素包括:T4期, 低分化或未分化, 伴肠梗阻或肠穿孔以及不充足的淋巴结检出数; 欧洲医学肿瘤学会(European Society for Medical Oncology, ESMO)在ASCO基础上增加了伴淋巴、血管或周围神经浸润的危险因素; 美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)在ESMO基础上又添加了伴手术切缘阳性的危险因素, 并在低分化或未分化组中排除了微卫星不稳定性(microsatellite instablity, MSI)亚组[7]。在术后化疗方案的选择上, Ⅱ 期结直肠癌, 是否需要同Ⅲ 期一样, 术后规范地使用6个月的FOLFOX方案:奥沙利铂+5-氟尿嘧啶(5-Fluorouracil, 5-Fu)+亚叶酸钙(Leucovori, LV), 这些问题目前仍然存在争议[7]。本研究旨在利用荟萃分析的方法, 探讨Ⅱ 期结直肠癌术后化疗与总生存率(overall survival, OS)和无复发生存率(recurrence-free survival, RFS)的关系, 探索伴有常见危险因素的Ⅱ 期患者能否从化疗中获益, 并在化疗方案与临床预后方面做进一步研究。
1.1.1 纳入标准 ①所有入选文献均包含根治性手术后行相关化疗组。②所有纳入分析的研究对象, 均为根治性术后病理诊断TNM分期为Ⅱ 期(T3-4N0M0)的患者。③研究对象按照术后是否进行化疗分为化疗组(手术+化疗组)和单纯手术组, 跟踪随访不同组间的预后。④研究对象按照化疗方案的不同分为FOLFOX组和FULV组(5-Fu+LV), 跟踪随访不同组间的预后。
1.1.2 排除标准 ①研究对象仅含有根治性手术后试验组预后资料, 而无对照组预后资料。②研究对象的预后资料为比例模型或预后曲线, 无法统计具体数据。③研究对象为Ⅱ 期和Ⅲ 期结直肠癌混合患者, 无法从中清楚提取具体Ⅱ 期患者的临床资料。
检索数据库包括PubMed、EMBASE、Web of Science、Cochrane 图书馆以及中国知网(CNKI), 检索时间限制为近10年(2007年3月至2018年3月), 筛选有关Ⅱ 期结直肠癌术后化疗与临床预后、危险因素以及化疗方案的研究。检索词包括“ 结肠癌” 、“ 直肠癌” 、“ 术后化疗” 、“ Ⅱ 期” ; 英文包括“ colorectal neoplasm” 、“ postoperative adjuvant chemotherapy” 、“ stage Ⅱ ” 、“ early stage” 。为避免查漏文献, 对入选的文献进行二次扩大检索, 将符合条件的参考文献纳入研究。
所有数据分别由两名检索人员(肖刘牛和朱丽)根据检索策略独立完成, 最后与第三人(陈颖铭)共同讨论决定纳入的研究资料, 以表格的形式将提取的数据进行归纳整理。数据包括如下内容:第一作者, 出版年限, Ⅱ 期患者数量, 化疗方案, 预后指标, 不同相关危险因素等。
运用 RevMan 5.3软 件, 采 用 二 分 类 变 量 Mantel-Haenszel法, 随机效应模型, 效应指标选择比值比(odds ratio, OR)及其95%可信区间(confidence interval, CI)进行分析, 异质性检验I2≤ 50% 且 P> 0.10认为相关研究异质性较小; 反之, 认为异质性较大, 尝试找出异质性来源。以P≤ 0.05认为差异有统计学意义。文献质量评价, 采用“ 偏倚风险图” 和“ 偏倚风险总结图” , 对于选择偏倚、实施偏倚、测量偏倚、随访偏倚、报告偏倚以及其他偏倚进行偏倚风险评估, 评估效应包括:低风险、未知风险和高风险。
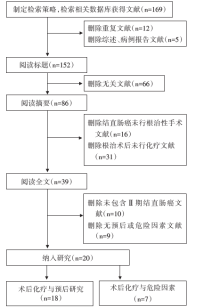
初检相关文献169篇, 其中PubMed共检出45篇, EMBASE共检出42篇, Web of Science共检出59篇, Cochrane图书馆共检出8篇, CNKI共检出15篇。通过进一步删除重复、综述或病例报告17篇后; 剩余152篇通过阅读标题及摘要, 删除与本研究无关或未包含Ⅱ 期结直肠癌化疗数据的文献共113篇; 剩余39篇文章, 详细阅读全文及参考文献进行再次筛选, 最终纳入20篇[9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28]研究做进一步荟萃分析。其中18篇[9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 25, 26, 27, 28]包含化疗与相关预后的研究, 7篇[18, 19, 20, 21, 22, 23, 24]包含化疗与相关危险因素的研究。具体检索流程见图1。
共20篇文献累计289 684例患者纳入研究, 其中最早的文献发表于2007年[21], 最新的文献发表于2018年[16]。18篇有关术后化疗与临床预后的研究中, 13篇涵盖了Ⅱ 期结直肠癌根治性术后化疗OS的预后指标[10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22], 8篇涵盖了RFS的预后指标[9, 11, 12, 13, 14, 15, 18, 22]; 按照化疗方案的不同(FOLFOX vs. FULV), 3篇涵盖了OS的预后指标[25, 27, 28], 4篇涵盖了RFS的预后指标[25, 26, 27, 28]。纳入的7篇有关术后化疗与危险因素的研究, 将伴有危险因素患者按照术后化疗与否分组, 分别统计各组复发或死亡人数。各研究对象的临床特点见表1。
| 表1 纳入文献的基本特征 |
2.3.1 术后化疗与OS和RFS的关系
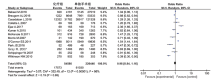
13篇文献分析了术后化疗与OS的关系, 结果显示Ⅱ 期结直肠癌患者术后常规化疗, OS无显著提高(OR=0.98, 95%CI 0.84~1.16, P=0.85)。见图2。8篇文献分析了术后化疗与RFS的关系, 结果显示Ⅱ 期结直肠癌术后常规化疗, RFS无显著提高(OR=0.85, 95%CI 0.69~1.05, P=0.13)。见图3。
2.3.2 伴有相关危险因素的患者术后化疗与临床预后的关系
2.3.2.1 T4N0M0
6篇文献报道了有关Ⅱ 期结直肠癌中分期为T4N0M0的肿瘤术后化疗与临床预后的研究, 结果提示, 肿瘤浸润深度达肠壁全层至浆膜外的T4期肿瘤, 术后化疗可以显著降低复发率和死亡率(OR=0.59, 95%CI 0.35~0.99, P=0.04)。见图4。
2.3.2.2 低分化或未分化
5篇文献涵盖了有关Ⅱ 期结直肠癌患者术后病理检查显示低分化或未分化, 术后化疗与临床预后的研究, 结果提示, 分化程度低的Ⅱ 期肿瘤, 术后化疗可以显著提高临床预后(OR=0.55, 95%CI 0.34~0.90, P=0.02)。见图5。
2.3.2.3 伴肠梗阻或肠穿孔
5篇文献覆盖了有关伴肠梗阻或肠穿孔的Ⅱ 期结直肠癌, 术后化疗与临床预后的研究, 结果提示, 肿瘤造成了肠梗阻或肠穿孔的患者, 术后化疗可以明显改善临床预后(OR=0.41, 95%CI 0.22~0.77, P=0.006)。见图6。
2.3.2.4 伴淋巴、血管或周围神经浸润
4篇文献报告了有关Ⅱ 期结直肠癌伴有淋巴、血管或周围神经浸润, 术后化疗与临床预后的关联, 结果提示, 伴有淋巴、血管或周围神经浸润的Ⅱ 期结直肠癌, 术后化疗可显著降低复发或死亡(OR=0.47, 95%CI 0.22~0.98, P=0.04)。见图7。
2.3.2.5 伴不充足的淋巴结检出数
4篇文献探讨了有关Ⅱ 期结直肠癌患者手术淋巴结病检数不足, 术后化疗与临床预后的研究, 结果提示, 伴有不充足淋巴结检出的患者, 术后化疗可明显改善临床预后(OR=0.54, 95%CI 0.40~0.72, P< 0.000 1)。见图8。
2.3.3 化疗方案与OS和RFS的关系
3篇文献对比了FOLFOX方案与FULV方案, 在Ⅱ 期结直肠癌患者术后化疗对OS的影响, 结果提示, 奥沙利铂的加入对于OS无显著影响(OR=0.99, 95%CI 0.80~1.22, P=0.92), 见图9。4篇文献对比了有关FOLFOX方案与FULV方案, 在Ⅱ 期结直肠癌患者术后化疗对RFS的影响, 结果显示, FOLFOX与FULV相比显著降低术后复发(OR=0.81, 95%CI 0.68~0.96, P=0.02), 见图10。
2.3.4 纳入文献的质量评价
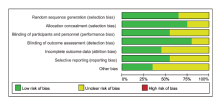
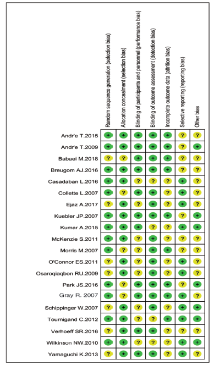
根据Cochrane偏倚风险评价图, 将20篇纳入的文献进行偏倚风险评估, 整体上文献多数为“ 低风险” 或“ 未知风险” 。相关危险因素的研究, 均未采用盲法, 但均对预先申明的研究结果进行了详细报道。其中9篇[14, 16, 17, 18, 21, 25, 26, 27, 28]文献报道了有关失访或退出记录。见图11和图12。
目前TNM分期为T3N0M0~T4N0M0的Ⅱ 期结直肠癌患者, 能否从术后化疗中获益的问题, 在不同领域之间仍然存在争议。Benson 等[29]于2004年发表了ASCO关于Ⅱ 期结肠癌术后化疗研究的Meta分析, 结果提示常规化疗对整体预后无明显提高。Deming等[30]于2015年在Ⅱ 期直肠癌患者的管理方面, 详细听取不同学科的会诊建议。在根治性术后化疗方面, 外科医生选择与患者共同商讨的方法, 让患者选择其一:(1)积极接受放化疗来获得可能较好的临床预后; (2)即使有微肿瘤灶的潜在风险, 也拒绝行辅助治疗, 避免可能的化疗毒副作用。放射科医生建议若患者术前接受了新辅助放化疗, 根治术后若无合并症, 可考虑行后续放化疗。肿瘤科医生则建议即使临床预后无法确定, Ⅱ 期患者仍然可考虑行3个月的短期术后化疗。近期Tang 等[31]在2018年发表了有关可根治性切除结肠癌术后化疗的综述, 在Ⅱ 期结肠癌方面提示:常规术后30周的5-Fu化疗可以显著提高OS, 降低复发率; 不建议加用奥沙利铂联合化疗; 伴有高危因素患者建议术后行6个月疗程的化疗。
有关Ⅱ 期结直肠癌高危因素分子机制与术后化疗的研究, 结果同样也是层出不穷。其中DNA错配修复缺失(deficient DNA mismatch repair, dMMR)及DNA错配修复正常(proficient DNA mismatch repair, pMMR)相关的MSI已经用于早期患者的化疗选择。Kawakami 等[32]在2015年发表了DNA错配修复(MMR)在结直肠癌化疗中应用的综述, 提示dMMR常出现于Ⅰ 、Ⅱ 期肿瘤中, 有较好的临床预后, 且术后化疗不会带来显著获益; pMMR常出现于Ⅲ 、Ⅳ 期肿瘤中, 临床预后较差, 但术后化疗可显著降低复发率和死亡率。早期结直肠癌中, 约8%~14%患者存在原癌基因B-Raf(BRAF)突变, 且突变表位多位于BRAF V600E位, 突变体呈现显著的侵袭转移倾向, 针对BRAF V600E突变体的丝裂原激活蛋白激酶信号通路(mitogen-activated protein kinase signaling pathway, MAPK)的靶向化疗药物(维罗非尼或达布非尼), 目前正处于试验阶段[33]。Ⅱ 期结直肠癌中, 免疫源性PD-L1基因高表达的患者, 呈现较高的MSI特性, 常规术后化疗反而显著降低了RFS[34]。同样, 当基因组学显示基因hERG1(human Ether-à -go-go-Related Gene 1)表达阳性且Glut1(Glucose transporter 1)表达阴性的Ⅱ 期结直肠癌患者, 术后化疗显著降低了OS[35]。
本研究在Ⅱ 期结直肠癌术后化疗方面, 分别讨论了常规整体化疗与临床预后、伴有不同危险因素化疗与临床预后的关联, 并对比了不同化疗方案之间的预后差异。我们发现Ⅱ 期结直肠癌患者, 可从根治性手术中明显获益, 虽然术后有大约1/4患者出现复发[29], 但是整体上无需常规行术后化疗。对于所有Ⅱ 期结直肠癌患者行术后常规化疗, 会出现过度治疗的情况, 造成医疗资源的浪费, 增加患者暴露于潜在化疗毒副作用的风险。然而, 对于术后病理检查提示有高危因素的患者, 包括T4期, 低分化或未分化, 伴肠梗阻或肠穿孔, 伴淋巴、血管或周围神经浸润和不充足的淋巴结检出数者, 若上述风险中出现任何一项, 均建议行术后化疗。在术后化疗方案的选择方面, 可参照Ⅲ 期结直肠癌, 选择标准化FOLFOX化疗, 虽然FOLFOX对于OS无明显提高, 但在降低术后复发方面, 起到了明显作用。
异质性讨论中, 有关Ⅱ 期结直肠癌整体术后化疗与OS的研究异质性较大(I2=96%, P< 0.000 01), 考虑到纳入文献的时间年限跨度较长, 随着手术方式的不断进步, 化疗药物剂量的不断规范, 患者的总生存率存在明显差异。而有关T4N0M0与临床预后的研究, 同样存在较大异质性(I2=82%, P< 0.000 1), 敏感性分析中, 若排除Verhoff等[24]有关T4期术后化疗与临床预后的研究, 异质性显著下降, 考虑到该研究纳入的T4期患者化疗疗效较好, 死亡风险在化疗组较低的因素。
本研究存在以下缺点:①仅在病理检查层面, 讨论了高危因素术后化疗与临床预后的关联, 未在分子或基因层面加以细分, 未将不同的基因亚组所造成的临床预后考虑在内。②将近10年的文献研究合并分析, 未设置具体的时间区域亚组, 因临床技术的提高或新型化疗靶向药物应用, 所带来的临床预后改善, 未考虑在内。③偏倚风险方面, 文献的不同方面呈现“ 未知风险” , 无法准确评估相关的风险偏倚。
Ⅱ 期结直肠癌患者, 根治性手术后, 可参考术后病理检查, 针对个体的不同情况酌情进行后续化疗。若相关危险因素均不存在, 可考虑定期观察随访; 若伴有相关危险因素之一, 在征询患者同意的情况下, 可行术后化疗。术后化疗建议FOLFOX化疗方案, 能够有效地控制术后的远期复发。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|