[编者按] 疾病的正确诊断和合理治疗是患者和医务工作者共同的心愿。在广东省人民医院肿瘤中心, 吴一龙教授指导临床医生应用循证医学理论进行肿瘤的多学科综合治疗, 开展临床病例讨论。讨论会上各学科共同围绕一个病例或一个病种进行会诊, 临床、病理、B超、放射影像等资料齐全, 除相关科室提前准备的中心性发言外, 到会人员各抒己见, 气氛热烈。参会人员受益匪浅, 提高了对疑难病例的诊治水平。为了将他们的诊治经验传播出去, 让更多的临床医生获益, 我刊开辟“ 循证病例讨论” 栏目, 希望广大医务工作者关注此栏目。
患者, 陈某, 54岁, 因“ 外院发现肝内占位病变1周” 入院。患者1周前无明显诱因出现上腹部隐痛, 无腹胀、腹泻、呕吐、里急后重, 无胸闷气促、头痛头晕, 最近体质量未见明显改变。至当地医院就诊, 彩超显示:①肝左叶稍高回声, 转移瘤待排; ②门静脉左支低回声光团填充, 考虑癌栓形成可能; ③腹膜后多发低回声包块, 考虑转移瘤可能。既往史无特殊, 无酗酒史。
体格检查:T 36.9℃, P 95次/分, R 20次/分, Bp 99/78 mmHg, 体质量53 Kg, 身高170 cm, 体表面积1.60 m2, PS=0, 全身浅表淋巴结未触及, 头面部无水肿, Horner征阴性, 上腔静脉综合征阴性。皮肤黏膜无黄染, 无皮下出血点, 无肝掌、蜘蛛痣。上腹部轻度压痛、反跳痛, 肝肋缘下1 cm, 脾无肿大, 腹部平坦, 移动性浊音阴性。神经系统检查无异常。
入院后辅助检查:
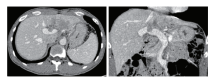
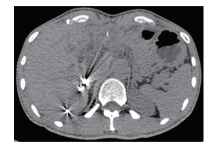
上腹部增强CT(2017-11-21):肝左叶不均匀低密度灶, 增强扫描呈不均匀强化, 门脉期强化明显减退; 门静脉左支及主干癌栓侵犯。见图1。
血常规:白细胞 5.65× 109/L, 中性粒细胞比值0.566, 血小板 132× 109/L, 红细胞5.09× 109/L, 血红蛋白 157 g/L。肝功能:谷丙转氨酶 244 U/L, 谷草转氨酶 156 U/L, 血清白蛋白 47.6 g/L, 血清总胆红素 15.8 μ mol/L, 凝血酶原时间 13.4秒。血生化未见明显异常。肿瘤指标:甲胎蛋白(alpha fetal protein, AFP) 19 888.00 ng/mL, CA-125 10.22 U/mL, CA19-9 28.77 U/mL。乙肝两对半:HBsAg(+), Anti-HBs(-), HBeAg(-), Anti-HBe(+), Anti-HBc(+)。
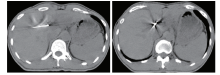
入院后治疗:①口服索拉非尼(400 mg BID); ②予博路定抗病毒治疗; ③行门静脉粒子植入术(2017-11-23)+肝动脉腔内栓塞术(2017-11-27), 见图2及图3。
术后影像学复查:
2018-01-08上腹部增强CT显示:肝癌介入术后改变, 术区软化灶形成, 病灶右侧缘仍见异常强化灶, 考虑活癌灶; 门静脉左支及主干癌栓形成, 范围较前缩小。2018-03-07上腹部增强CT显示:肝癌介入术后改变, 病灶坏死范围较前增大, 仍可见少量环形强化。2018-10-16上腹部增强CT显示:术区未强化低密度灶较前增大, 病灶右侧缘团片状强化灶。
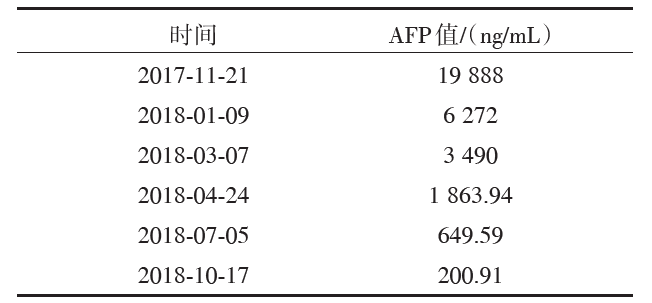
患者术后AFP变化情况见表1。
| 表1 患者术后AFP变化情况 |
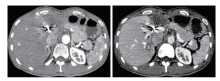
2019-03-26复查上腹部增强CT显示:术区未强化低密度灶基本同前, 病灶右侧缘团片状强化灶基本同前, 见图4。
2019-03-25实验室检查情况:血常规、肝肾功能、血生化无明显异常。肿瘤指标:AFP 571.33 ng/mL, CA-125 11.23 U/mL, CA19-9 13.70 U/mL。
陈猛(介入科医师):患者诊断为肝细胞癌BCLC C期, 门静脉左支及主干癌栓形成, 予口服索拉非尼靶向药物、门静脉癌栓(portal vein tumor thrombus, PVTT)放射性粒子植入术、肝动脉腔内栓塞术等治疗, 目前患者影像学资料由于伪影存在, 疗效评价存在一定问题, 最新复查AFP表达水平较前有明显升高趋势。提出讨论要点:(1)目前如何评价患者的疗效; (2)下一步治疗方案:①是否可行外科切除?②靶向治疗药物是否需要调整?(3)目前该患者能否从免疫治疗中获益?(4)其他治疗手段的应用。
许荣德(介入科副主任医师):结合患者影像学表现及病理检查结果, 患者肝细胞癌(BCLC C期)诊断明确, 根据《2017年中国肝恶性肿瘤诊疗规范》及NCCN指南, 该患者采取了以靶向治疗(索拉非尼)为基础的综合介入治疗(PVTT放射性粒子植入术+经肝动脉腔内栓塞术), 目前患者增强CT提示门脉主干癌栓较前缩小, 肝左叶肿瘤病灶未见明显强化。但AFP存在升高趋势。患者放射性粒子植入术后, 放射性伪影对影像诊断造成较大影响, 目前是否有更有效的方法对放射性粒子后患者进行疗效评估?
旁述:PVTT粒子植入术使用放射性粒子碘125(radioactive seed iodine-125, 简称碘粒子), 术前借助放射治疗计划系统(treatment planning system, TPS)进行剂量及范围规划, 术中在CT/MRI引导下穿刺植入肿瘤病灶, 可持续低剂量地辐射γ 射线, 使肿瘤组织近距离遭受最大程度的杀伤, 而正常组织不损伤或仅有轻微损伤, 从而达到治疗目的。多数研究表明, 植入放射性粒子能有效抑制PVTT进展, 延长患者的生存期[1, 2, 3]。
马冬(肿瘤内科主任医师):AFP表达水平是否可作为肝恶性肿瘤的疗效评价指标之一?还是与其他实体肿瘤疗效评价方法一致, 以影像学表现为主要标准?
陈晓明(介入科主任医师):肝恶性肿瘤介入术后常用改良实体瘤疗效评价标准(modified response evaluation criteria in solid tumors, mRECIST) 进行评价, 其金标准仍然是 CT 或MRI, AFP严格意义上不能作为肝恶性肿瘤的疗效评价指标, 仅是动态观察的肿瘤指标。但目前国内外研究普遍认为AFP表达水平与肿瘤发展情况显著相关, 包括近年新兴的循环肿瘤DNA、循环肿瘤细胞等新型“ 液体活检” 技术, 均未有证据证明其比AFP特异性及敏感性高。传统影像学方法(CT、MRI、PET-CT等)对微小病灶的检测均存在一定的局限性, 而且该患者为放射性粒子植入术后, 在常规影像学检查中不可避免地存在伪影, 严重影响影像学诊断的准确性, 所以当该患者AFP出现升高趋势时, 更应该注意患者是否存在疾病进展。
旁述:实体瘤的疗效评价标准主要使用RECIST 或mRECIST标准。RECIST 强调测量病灶本身最大径; 而mRECIST重点评估动脉期强化病灶(即存活肿瘤)的情况, 以排除坏死肿瘤的干扰, 常用于肝恶性肿瘤介入治疗后的疗效评价。
王秋实(放射科主任医师):患者最近复查了增强CT, 由于放射性碘粒子伪影存在, 无法正确评估PVTT及肝左叶肿瘤病灶强化情况, 结合患者AFP动态变化情况, 目前该患者疗效评价仍存在疑问。
吴一龙(肿瘤学教授):目前放射性粒子植入术在恶性肿瘤综合治疗中的应用越来越广泛, 但放射性粒子植入术后使用增强CT评价治疗疗效存在严重伪影干扰问题, 是否有其他影像学检查方法可代替?这是亟待解决的临床问题。
王秋实:目前使用MRI、PET-CT等影像学方法对粒子植入术后的患者疗效评价均存在一定的干扰。但可以在影像系统软件上对影像进行处理, 尽量减少伪影干预。
杨衿记(肺内科主任医师):超声造影能否对这类患者的疗效评价提供更有价值的参考?
许荣德:目前超声造影在肝恶性肿瘤疗效的评价中应用甚少, 肝动脉造影可能比超声造影更有价值。肝动脉造影在肝恶性肿瘤诊断的敏感性及特异性比增强CT高, 且数字减影血管造影技术下放射性粒子不会产生伪影即对造影图像不会造成明显影响。但肝动脉造影是有创检查, 重复性较差。
吴一龙:AFP作为肝恶性肿瘤的诊断指标之一, 目前关键问题在于AFP表达水平升高, 是否能够证明肝恶性肿瘤有进展?对于此类患者, 是否应该给予提前干预?
陈晓明:AFP表达水平升高仅能对肝恶性肿瘤进展提供一定的参考意义。临床上对于AFP升高患者, 应警惕肝癌原发灶的进展、血管侵犯或远处转移灶形成。对于影像学上无法明确进展者, 应密切动态监测患者的AFP表达情况及影像学检测的改变。
吴一龙:是否需要对该患者进行干预, 这涉及到循证医学的问题。目前我们医生面临一个很大的误区, 就是常常有医生使用一个有效率很低的方法去处理一个未知的危险因素。目前虽然该患者AFP表达水平升高, 是否有一个确实是有效的方法使其表达水平降低?
马冬:目前评价肿瘤疗效的RECIST 或mRECIST标准均是以影像学为基础的评价方法。患者影像学上暂未看到进展, 暂时不考虑更换靶向药或者增加其他辅助治疗。但我现在最关注的是, 目前该患者的病灶在介入治疗后得到有效控制, 外科切除治疗能否让患者获益?
殷子(普外科医师):根据中国《2017年原发性肝癌诊疗规范》, 该患者属于Ⅲ B期, 推荐的一线治疗方法有经动脉化学栓塞(transcatheter arterial chemoembolization, TACE)、全身治疗(索拉非尼/FOLFOX4等)、手术切除、放疗(外放疗、内放疗)。根据《2018年肝细胞癌合并PVTT多学科诊治中国专家共识》, 手术切除是肝癌合并PVTT Ⅰ 、Ⅱ 型患者的首选并有可能获得根治机会的方法(证据级别Ⅱ b, A), 原发病灶可切除、PVTT Ⅲ 型患者可根据情况选择手术、TACE或放疗降期后行手术切除(证据级别Ⅱ a, B)。目前国内外尚未有文献数据支持该类患者外科手术能够明显改善患者的总生存期(overall survival, OS)。
旁述:目前常用的PVTT分型是在90年代由程树群教授提出的程氏分型(Cheng's classification), 程氏分型依据PVTT侵犯门静脉范围分为四型:Ⅰ 型, 癌栓侵犯肝叶或肝段的门静脉分支; Ⅱ 型, 癌栓侵犯至门静脉左支或右支; Ⅲ 型, 癌栓侵犯至门静脉主干; Ⅳ 型, 癌栓侵犯至肠系膜上静脉; 另外, 微血管癌栓归为Ⅰ 0型。根据相关影像学表现, 该患者PVTT分型为Ⅲ 型。目前学界对伴有PVTT形成肝恶性肿瘤的治疗尚未达成共识。根据欧美国家提出的经典的肝恶性肿瘤BCLC分期, 该患者属于BCLC C期, NCCN指南不推荐外科治疗作为一线治疗方法。但根据亚洲地区相当部分的学者近年研究, 认为肝癌合并PVTT患者的外科手术机会可能大于欧美国家既往所认可的标准。
马冬:在欧美国家, PVTT患者均纳入为BCLC C期, 进行以索拉非尼为主的靶向治疗。但目前亚洲学者都会将其作为一独立分支进行深入研究。对于一个初治的患者, 可根据其Child-pugh分级、PVTT分型等情况分为可手术与不可手术, 前瞻性地给患者相应的治疗措施。这需要多学科的共同参与, 包括外科、介入科、放疗科、影像科等学科。
谢松喜(放疗科副主任医师):同意马主任意见。目前外照射放疗治疗PVTT已经有较多研究证明其安全性及有效性。该患者粒子植入术后15个月仍未出现进展, 疗效的确惊人。但影像学提示该患者粒子植入术后10个月出现了粒子迁移现象, 迁移的粒子是否会对肝脏正常组织有影响?
旁述:根据《肝细胞癌合并PVTT多学科诊治中国专家共识(2018版)》, 原发灶可切除的PVTT Ⅰ 或Ⅱ 型患者首选手术治疗, PVTT Ⅲ 型患者可根据癌栓情况选择手术、TACE或放疗降期后再手术切除; 肝癌原发灶不能切除则PVTT Ⅰ 、Ⅱ 、Ⅲ 型患者首选放疗+TACE, PVTT Ⅳ 型患者根据实际情况行放射治疗和系统药物治疗。根据《原发性肝癌诊疗规范(2017年版)》, 放疗是Ⅲ A期和Ⅲ B期肝恶性肿瘤推荐治疗方法之一, 放疗包括外放疗和内放疗, 放射性粒子植入属于内放疗。
许荣德:粒子发生迁移的最主要原因是病灶缩小、灭活, 导致粒子脱落原植入灶。放射性碘粒子的半衰期为2~3个月, 在粒子术后10个月, 放射性粒子基本已经失去放射性, PVTT病灶缩小灭活后随着血液流动到达肝内其他部位, 不会对正常肝脏组织造成不利影响。
旁述:植入瘤体内的碘粒子可在人体内迁移[4], 通常经过人体正常腔道及间隙或穿刺针道脱离原植入灶。见图5。
殷子:该患者在综合介入治疗后病灶情况稳定, 门静脉主干癌栓明显缩小, 进一步行外科切除后应该能够延长患者的OS。
马冬:如果外科手术无法根治性切除, 以后可继续给予介入、放疗等补救措施。
吴一龙:我们讨论问题不能局限于“ 能不能做” , 而要聚焦于“ 做了之后会怎么样” 。对于该患者, 外科切除后, OS到底能提高多少?这是一个必须要回答的问题。我们可以将所有肝恶性肿瘤合并PVTT的患者集中起来进行多学科病例讨论, 制定出PVTT的治疗方案。
陈晓明:目前并没有循证医学证据证明此类患者能从外科切除中获益。
吴一龙:总体来说, 此患者的治疗方法基本上按照指引进行, 且患者的治疗效果很好, 我们要善于总结经验。对于肝恶性肿瘤合并PVTT的患者, 我们可以集中起来规范化治疗, 然后总结出属于我们自己的临床经验和数据。
总结今天的病例讨论, 该患者诊断为肝细胞癌(BCLC C期), Child-pugh A级, PS=0分。目前采用以靶向治疗(索拉非尼)为基础的综合介入治疗, 复查CT可见门静脉主干癌栓明显缩小, 但AFP有升高的趋势; 由于放射性粒子伪影的存在, 疗效评估存在一定问题。可先行PET-CT明确肝外是否有转移, 行肝动脉造影明确肝内病灶是否存在供血动脉。暂不考虑更换靶向药等治疗措施, 待排除肝外转移后, 可行外科切除术或继续当前的介入综合治疗。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|