作者简介:
毛铁波(1994-),男,浙江慈溪人,在读博士研究生,主要研究方向为胰腺癌炎癌转化分子机制、胰腺癌分子分型与精准治疗。
胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)是目前恶性程度最高的肿瘤之一。2018年胰腺癌全球发病人数超过45万例, 死亡人数超过43万例[1], 其死亡与发病人数的比值超过0.9, 在所有常见瘤种中位列第一, 目前胰腺癌总体5年生存率仅约5%, 据估计, 到2030年胰腺癌在美国将成为仅次于非小细胞肺癌的第二大肿瘤相关死因[2]。胰腺作为一个重要的兼具内分泌和外分泌功能的器官, 由于发生恶性转变时具有高神经侵袭能力、致密的胰腺间质和乏血管特点、免疫抑制微环境、影响消化乃至全身功能的胰腺脏器损伤等恶性特点, 即使接受了手术治疗的早期、交界性或局部进展期胰腺癌患者, 其5 年生存率也仅有15%~20%[3], 因此, 尽管手术是当前唯一能治愈胰腺癌的手段, 要提高胰腺癌患者的临床疗效、改善预后, 很大程度上依赖于全身系统性的治疗。
胰腺癌的全身治疗主要依赖于5氟尿嘧啶(5 Fluorouracil, 5-FU)类药物和吉西他滨为主的治疗方案, 包括亚洲人群使用的替吉奥(S-1)、 FOLFIRINOX(5-FU+亚叶酸钙+伊立替康+奥沙利铂)和 AG (白蛋白紫杉醇联合吉西他滨)方案; 近年来, 以改良FOLFIRINOX(modified FOLFIRINOX, mFOLFIRINOX)方案(无氟尿嘧啶推注)用于术后辅助治疗和PARP抑制剂奥拉帕利在具有胚系 BRCA 基因突变且一线铂类方案化疗无进展的转移性胰腺癌患者中的维持治疗的成功为代表, 胰腺癌的综合治疗在术后辅助治疗、维持治疗以及新辅助治疗各方面均获得了极大的进展, 甚至实现了从无到有的突破。这些建立在诸多大型随机对照试验(randomized control trial, RCT)基础上的进展和突破, 在给胰腺癌的新药研究指明一大方向的同时为临床治疗提供了更多方案选择:围手术期的全身治疗、基于生物标志物的靶向维持治疗……极大程度完善并拓展了胰腺癌综合治疗的模式。
1985年, 国际多中心随机临床试验GITSG[4]的结果提示, 以5-FU药物化疗联合放疗显著延长了患者的中位总生存期(overall survival, OS; 21个月 vs. 10个月, P=0.03), 在其后的30多年, ESPAC3比较5-FU/亚叶酸钙和吉西他滨的疗效, JASPAC带来亚洲人群更佳的S-1以及ESPAC4引入吉西他滨联合卡培他滨化疗, 但伴随手术条件和方案的改善和提高, 胰腺癌传统的辅助化疗并未带来实质性进展和治疗效果上的实质性改善。
2018年, PRODIGE/UNICANCER研究[5]将先前用于转移性胰腺癌一线治疗的 FOLFIRINOX 方案应用到经R0/R1切除且体能状况良好的患者中, 获得了前所未有的成功:在mFOLFIRINOX方案以降低血液毒性和腹泻等副作用的情况下, 这项国际、多中心、随机的Ⅲ 期试验研究获得了目前为止最长的OS:中位随访33.6个月, 与吉西他滨治疗组相比, mFOLFIRINOX治疗组中位无病生存期和OS均较长, 中位无转移生存期更长, 为30.4个月; 而吉西他滨组为17.0个月; mFOLFIRINOX治疗组3年无病生存率也较高, 为39.7%, 而吉西他滨组只有21.4%。同时也应该注意到, 该研究纳入的患者均为体能状态良好的 R0或 R1切除患者, 这对胰腺癌的早期诊断和如何提高R0切除率提出了较高的要求。但该研究依然在安全性可耐受范围内为胰腺癌患者带来了新的选择, 也为临床实践提供了高级别的证据。
PRODIGE-Ⅲ 研究[6]和MPACT研究[7]分别将FOLFIRINOX和AG方案治疗带入到晚期胰腺癌的标准治疗中, FOLFIRINOX标准方案和AG方案分别带来了11个月和8.5个月的中位OS, 缓解率分别为31.6%和23%。真实世界研究的系统评价中, 两个方案分别为一线时疗效没有显著差异[8](中位OS:AG vs. FOLFIRINOX = 14.4 个月vs. 15.9 个月), FOLFIRINOX方案的中位OS和无进展生存期(progression-free survival, PFS)均较 AG 方案稍长, 但其不良反应也相对更重。基于循证医学证据, 这两个治疗晚期胰腺癌的标准方案都能为患者带来最大程度的获益, 在临床应用中应综合考虑患者的体能状态、注意骨髓细胞抑制和神经损害等不良反应进行选择。
由于晚期胰腺癌治疗方案选择的匮乏, 联合靶向治疗是近年来探索与研究的一大热点与重点, 尽管吉西他滨单药治疗是转移性胰腺癌的标准治疗方法, 多个吉西他滨联合靶向治疗的随机Ⅱ 、Ⅲ 期试验均未能获得成功。吉西他滨联合EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)厄洛替尼的组合仅得到12 天的生存获益, 对于大多数患者并没有实际意义[9]; VEGFR2、RET 和 EGFR的多靶点TKI凡德他尼(Vandetanib) 在ViP 研究中联合吉西他滨也未能改善局部进展或转移性胰腺癌患者的生存状况[10]。提示我们在今后的研究中, 通过生物标志物筛选对 EFGR 抑制剂更加敏感的胰腺癌人群可能更有意义。
2019年Golan 等[11]开展的 POLO 研究基于前期研究结果— — 具有胚系 BRCA 基因突变的转移性胰腺癌患者一线接受铂类药物化疗往往效果较野生型的患者更好— — 结合 PARP 抑制剂较好的安全性, 将针对 BRCA 基因突变的 PARP 抑制剂应用到胰腺癌的维持治疗中并取得了成功。研究采用了两个严苛且重要的纳入标准:具有胚系 BRCA 基因突变且须在一线铂类药物方案标准治疗过程中未出现进展, 研究中共有 21.7%(43/198) 的患者在一线治疗中出现进展而无法随机化。POLO 研究奥拉帕利维持治疗组获得7.4 个月的中期PFS, 同时带来了生存获益, 与安慰剂组相比, 奥拉帕利使疾病进展的风险降低了47%(风险比=0.53); 1年后, 接受奥拉帕利治疗的患者中有33.7%没有出现疾病进展, 而接受安慰剂的患者为14.5%。
POLO 研究作为一项大型 Ⅲ 期临床研究完成了 2018 年开启的胰腺癌“ 维持治疗” 的突破, 同时也开启了胰腺癌基于生物标志物个体化治疗的时代; 但是目前研究以46%的成熟度尚未显示出OS的获益, 最终的OS结果将以69%的成熟度分析。
尽管由于胰腺癌的免疫抑制微环境和低肿瘤突变负荷而被认为对免疫疗法具有抗性, 破坏这种免疫抑制网络并促进免疫细胞抗肿瘤活性仍可能提供新的治疗机会。现有免疫检查点抑制剂单药治疗胰腺癌的临床研究并未获得成功。
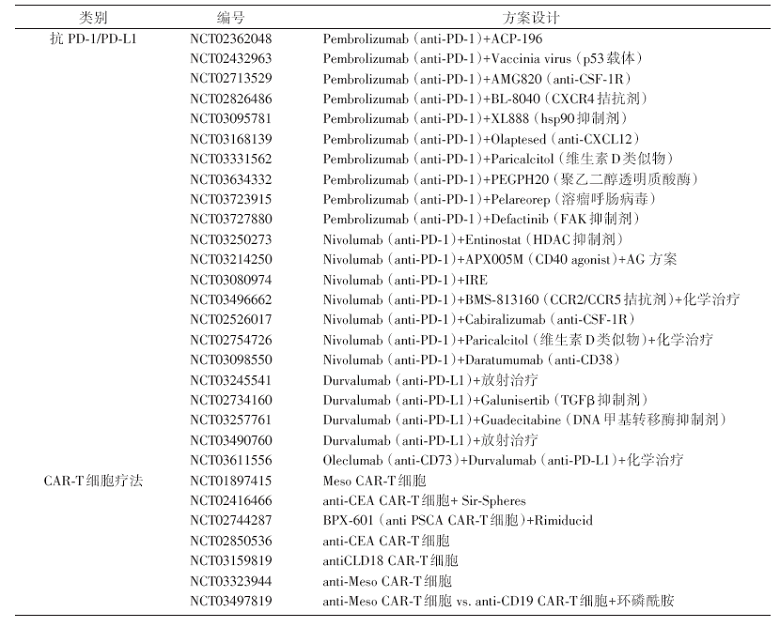
通过诱导或增强肿瘤特异性T细胞应答, 包括增加抗原特异性应答(如通过疫苗接种)、改善肿瘤相关抗原的T细胞识别(通过T细胞受体选择或设计)以及靶向免疫抑制性肿瘤微环境提示胰腺癌免疫治疗依旧存在希望。在临床研究中, 免疫治疗联合靶向胰腺癌间质的细胞毒药物可能提高治疗效果, 在转移性胰腺癌患者中加入免疫检查点抑制剂联合治疗具有潜在作用, CAR-T细胞疗法也提供了未来利用免疫应答的替代方法, 大量的相关临床研究结果值得期待, 见表 1。
| 表1 胰腺癌抗 PD-1/PD-L1和 CAR-T细胞免疫治疗临床研究 |
在胰腺癌提高手术切除率和改善患者预后的进程中还有两大难关:大约 20%的患者在诊断时为交界可切除的胰腺癌(borderline resectable pancreatic cancer, BRPC)[12], 这部分患者如何提高治愈率可能成为关键; 即使接受了手术治疗的早期、交界性或局部进展期胰腺癌患者, 其5年生存率也依然仅有15%~20%, 全身治疗成为了不可或缺的一部分。BRPC容易侵犯肠系膜血管, 36%~64%的患者无法达到R0切除[13], 且基于其亚临床转移发生较早的特点, 术前放化疗可能会带来获益。
FOLFIRINOX 方案自 2011 年被用于晚期胰腺癌患者的标准一线治疗以来, 给体能状况良好的患者带来了明显的生存获益。但患者的中位OS仍不理想。在将 FOLFIRINOX 方案改良后用于辅助治疗的同期, 有相当一部分前瞻性和回顾性研究将此方案应用于BRPC患者的术前全身化疗中, 为BRPC的新辅助治疗提供了一系列颇具价值的临床证据。2016年Katz等[14]将mFOLFIRINOX 方案联合卡培他滨化放疗用于新辅助治疗, 作为第一个评估 BRPC 新辅助治疗的多中心前瞻性研究, 该单臂研究在化疗、放疗和手术时间的选择上进行了探索, 最终68%的患者进行了手术, 但超过80%的患者依然需要血管切除。Janssen等[12]对BRPC的FOLFIRINOX方案的新辅助治疗状况进行了系统评价, 纳入了8项前瞻性研究和16项回顾性研究共313例接受FOLFIRINOX治疗的BRPC患者, 患者手术切除率为67.8%, R0切除率为83.9%, 患者中位OS为22.2个月(95%可信区间 18.8~25.6个月), 患者中位PFS为18.0个月(95%可信区间14.5~21.5个月)。针对BRPC的新辅助治疗确实带来了临床改善, 但依旧需要更多进一步的RCT提供证据支持。
相比其他瘤种, 尽管在过去的三十几年, 胰腺癌患者的临床结局没有得到令人满意的改善。在近年来的临床前研究的支持下, 现在更倾向于认为PDAC是一种全身性疾病。因此对于早期疾病人们开始了新辅助治疗的探索, 通过新辅助放化疗, 提高手术切除率、改善患者预后; 辅助治疗和转移性胰腺癌的姑息治疗在近年来获得了长足的进步, 在现有药物选择不多的情况下, 通过剂量调整、组合药物、方案变换等不断探索, 填补了胰腺癌综合治疗中如新辅助治疗、辅助治疗的很多空缺。但在未来在针对胰腺癌及其微环境分子生物学特征的研究不断深入, 基因组与多组学数据不断交织扩展的新时代, 胰腺癌的新药研究将迈入快速发展的新阶段, 为胰腺癌治疗提供源源不断的机遇和希望, 尤其以POLO研究为开端, 基于分子标志物的个体化治疗和基于分子分型的精准治疗正在成为可能, 胰腺癌患者的治疗前景终将改变。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|