马冬,广东省人民医院肿瘤内科主任、主任医师。从事肿瘤内科工作30年,对各种实体肿瘤的诊治有丰富的临床经验,尤其擅长消化系统肿瘤和老年常见恶性肿瘤的多学科综合治疗。兼任中国临床肿瘤学会(CSCO)胰腺癌专家委员会委员、CSCO肿瘤营养治疗专家委员会委员,中国医师协会结直肠癌专业委员会委员,广州抗癌协会副理事长、大肠癌专业委员会主任委员,广东省抗癌协会癌症康复与姑息治疗专业委员会副主任委员、胃癌专业委员会常务委员、靶向与个体化治疗专业委员会常务委员,广东省医学会肿瘤分会常务委员、消化肿瘤学分会常务委员,广东省健康管理学会肿瘤防治委员会副主任委员,广东省药学会肿瘤用药专家委员会副主任委员。承担多项国内和国际多中心临床研究项目,主持和承担多项省级科研课题,主编和参加编写《胰腺癌临床实践—争论与共识》、《消化系肿瘤循证化疗治疗学》、《肿瘤中西医治疗学》和《实用消化系肿瘤学》等多部专著。
Golan T, Hammel P, Reni M, et al. Maintenance Olaparib for germline BRCA-mutated metastatic pancreatic cancer[J]. N Engl J Med, 2019, 381(4):317-327.
1b。
一小部分转移性胰腺癌患者具有胚系BRCA1或BRCA2的基因突变。多聚二磷酸腺苷核糖聚合酶(poly adenosine diphosphate-ribose polymerase, PARP)抑制剂奥拉帕利对于该人群具有抗肿瘤效应。
研究奥拉帕利对具有胚系BRCA1或BRCA2基因突变的转移性胰腺癌且一线含铂方案化疗后无进展患者的作用。
• 研究条件:包括美国、德国等12个国家119个中心参加的研究(NCT02184195)。
• 研究时间:2015年1月至2019年1月。
• 研究方法:多中心、随机、双盲、安慰剂对照、Ⅲ 期临床试验。
• 研究对象:诊断明确的≥ 18岁转移性胰腺癌患者, 有胚系BRCA1或BRCA2基因突变, 具备正常的器官和骨髓功能。一线接受含铂方案化疗持续至少16周无进展。
• 干预措施:随机接受奥拉帕利或匹配安慰剂。患者在末次一线化疗后的4~8周开始随机接受奥拉帕利或匹配安慰剂(3∶ 2比例)维持治疗, 奥拉帕利300 mg每次, 每日两次。
• 评价指标:主要终点指标是无进展生存期(progression-free survival, PFS), 次要终点指标包括总生存期(overall survival, OS)、第二无进展生存期(second progression-free survival, sPFS)等。
共筛选3 315例患者, 247例(7.5%)具有胚系BRCA(germline BRCA, gBRCA)突变。随机入组154例患者, 奥拉帕利组92例患者中有90例接受维持治疗, 安慰剂组62例患者中有61名接受安慰剂维持。在该分析数据截止时(2019年1月15日), 仍有30例患者接受奥拉帕利治疗, 8例患者接受安慰剂治疗。
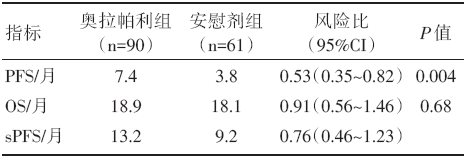
主要的评价指标分析是在154例患者的疾病进展(通过盲法独立的中心评价评估)或已经死亡(数据成熟度为68%)之后进行的。奥拉帕利组的中位PFS显著长于安慰剂组, 从6个月开始, 奥拉帕利组的生存率和无疾病进展的百分比是安慰剂组的2倍多。截止至分析数据当日, 奥拉帕利组有41例患者死亡, 安慰剂组有30例患者死亡。对数据成熟度为46%的OS及sPFS进行了计划中期分析, 结果显示两组的OS无明显差异, 奥拉帕利组的sPFS长于安慰剂组。详见表1。
| 表1 研究的主要结果 |
奥拉帕利维持治疗对具有胚系BRCA1或BRCA2基因突变、且含铂化疗无疾病进展的转移性胰腺癌, 有明显的PFS获益, 但OS获益并不明显。
据全球癌症数据库最新发布的数据显示:胰腺癌发病率居恶性肿瘤第11位, 死亡率居第7位。胰腺癌恶性度高、进展迅速、易于转移、治疗棘手, 约80%的胰腺癌确诊时已是局部晚期或者远处转移, 失去手术机会, 5年生存率不到10% [1]。
自1997年以来, 吉西他滨一直是晚期胰腺癌的一线标准治疗方案[2], 直至2011年之后FOLFIRINOX方案[3](氟尿嘧啶、亚叶酸钙、伊立替康、奥沙利铂)和 NG 方案[4](吉西他滨、白蛋白结合型紫杉醇)的引入, 用于晚期胰腺癌一线化疗的药物逐渐增加, 模式也从单药化疗进入了联合化疗。虽然这两个新生代化疗方案的有效率显著提高, 但毒副反应较大, 延长OS的获益仍然有限, 因此对新的有效药物和优化治疗模式(如维持治疗)的探索也从未停止。
近年来, 对晚期胰腺癌维持治疗的研究日益深入。2013年意大利一项随机开放性的Ⅱ 期临床研究[5], 接受6个月含吉西他滨化疗未进展的转移性胰腺癌患者, 使用舒尼替尼维持治疗(每组28 例), 结果发现维持组较观察组的6个月无进展生存率、疾病控制率均有明显提高, 2年生存率也有提高趋势。2018年ASCO报道了来自中国的一项晚期胰腺癌维持治疗的研究[6], 结果显示一线接受白蛋白紫杉醇联合S-1(AS)化疗后, 用S-1维持治疗可明显延长PFS、OS并提高1年和2年生存率, S-1维持治疗组的中位PFS为10.4个月, 中位OS 达到16.7个月。另一个Ⅱ 期临床研究(PRODIGE 35-PANOPTIMOX)显示[7]:经4个月FOLFIRINOX治疗未进展的转移性胰腺癌, 予5-氟尿嘧啶(5-Fluorouracil, 5-FU)/亚叶酸钙维持治疗也是有效可行的。尽管这些研究初步显示晚期胰腺癌维持治疗带来了一定的生存获益, 但尚未得到Ⅲ 期随机对照研究的进一步证实。
早期的研究发现, 携带gBRCA突变的转移性胰腺癌一线接受含铂方案的疗效显著优于野生型[8]; PARP抑制剂奥拉帕利对有gBRCA突变的乳腺癌、卵巢癌、胰腺癌等具有抗肿瘤活性并且安全性良好[9]。Ⅲ 期随机安慰剂对照的POLO研究正是基于上述研究背景而设计的, 该研究结果显示[10], gBRCA突变的转移性胰腺癌在一线含铂化疗之后, 使用PARP抑制剂奥拉帕利维持治疗, 对比安慰剂组显著延长了PFS接近1倍(7.4 个月vs. 3.8个月), 疾病进展风险降低了47%。1年和2年无进展生存率均为安慰剂组的2倍以上。并且奥拉帕利的安全性良好, 不良反应可控。虽然维持组PFS的获益没有最终转化成OS获益, 两组中位OS分别为 18.9个月和18.1个月, 但获得同样的中位OS, 维持组患者接受的后线治疗更少、有较高的生存质量。该研究是转移性胰腺癌第一项也是目前唯一一项基于生物标志物实施精准治疗获得成功的Ⅲ 期临床研究, 由此开启了晚期胰腺癌维持治疗的新纪元。
POLO研究结果表明在胰腺癌诊断时明确BRCA基因状态的重要性, 该研究将改变晚期胰腺癌的临床治疗模式, 但在临床实际应用中也需要考虑以下问题:(1)晚期胰腺癌后线治疗依然值得重视, POLO研究中奥拉帕利维持组只有48.9%进入后线治疗, 而安慰剂对照组有74.2%进入后线治疗, 维持治疗在PFS的获益没有转化为OS获益的原因, 是否由于对照组通过后线治疗弥补了一线治疗PFS的不足而OS得到延长, 还是奥拉帕利影响了后线治疗?(2)根据上述多个Ⅱ 期临床研究的结果, 假如对照组使用5-FU或S-1维持, 奥拉帕利是否还能获得PFS的优势?这需要更多临床研究的进一步验证。(3)除了单药维持治疗, 联合治疗是否可行?有研究发现gBRCA突变的胰腺癌往往伴有高肿瘤突变负荷和PD-1高表达, 奥拉帕利联合免疫检测点抑制剂[11]或联合其他靶向于DDR通路的药物如ATR抑制剂[12]等也值得探讨。(4)胰腺癌gBRCA突变率仅4%~7%, 且目前还缺乏简单有效的BRCA基因检测方法等因素制约了临床的应用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|