谢德荣,中山大学孙逸仙纪念医院肿瘤科主任、主任医师,从事肿瘤临床、教学和科研工作30多年,擅长消化道肿瘤化疗为主的综合治疗。兼任广州抗癌协会副理事长、化疗专业委员会副主任委员、肝胆胰肿瘤专业委员会主任委员;广东省抗癌协会化疗专业委员会副主任委员;广东省健康管理学会肿瘤防治专业委员会副主任委员;广东省医师协会肿瘤内科分会常务委员;中国南方肿瘤临床研究协会结直肠癌专业委员会常务委员。主持省部级课题4项,主持十一五科技攻关项目分课题1项。获广东省科技进步三等奖(R2)1项。
Chiorean EG,Cheung WY,Giordano G,et al. Real⁃world comparative effectiveness of nab⁃Paclitaxel plus Gemcitabine versus FOLFIRINOX in advanced pancreatic cancer: A systematic review [J]. Ther Adv Med Oncol,2019 May 19;11:1758835919850367.doi:10.1177/1758835919850367.
2a。
晚期胰腺癌(advanced pancreatic cancer, aPC)的治疗效果不佳, 5年生存率约为3%。单药吉西他滨是aPC的标准治疗方案, 但已证实疗效不如联合化疗方案如白蛋白紫杉醇联合吉西他滨(nab-Paclitaxel/Gemcitabine, nab-P/G)与FOLFIRINOX(氟尿嘧啶+亚叶酸钙+奥沙利铂+伊立替康)。社区治疗中肿瘤科医师对瘦弱的转移性胰腺癌(metastasis pancreatic cancer, mPC)患者倾向于选用nab-P/G作为一线治疗, 而对年轻男性患者倾向于选用FOLFIRINOX。然而, 选择nab-P/G或FOLFIRINOX的依据尚不清楚。
至今为止, 没有头对头的随机对照临床试验直接比较nab-P/G与FOLFIRINOX在mPC或aPC中的疗效。
对mPC或aPC一线治疗方案进行真实世界研究的系统回顾。评估两种治疗方案的疗效、安全性和毒副作用。
• 研究方法:系统评价。
• 检索方法:在EMBASE和MEDLINE电子数据库内查找截止至2019年1月22日的文献, 并查找2019年胃肠道癌症研讨会的摘要, 对符合特定参数的mPC或aPC一线nab-P/G与FOLFIRINOX的病例进行真实世界回顾性研究, 其中排除放射治疗研究。
• 入选标准:研究包括对mPC或aPC患者一线治疗的真实世界回顾性分析, 直接比较nab-P/G和FOLFIRINOX的疗效。
• 评价方法:两名评价者分别对每个试验进行评价, 对研究质量使用纽卡斯尔-渥太华量表进行评估。
• 评价指标:包括有效性数据, 如总生存期(overall survival, OS)、无进展生存期(progression-free survival, PFS)等, 治疗持续时间或资源利用率和安全性结果。
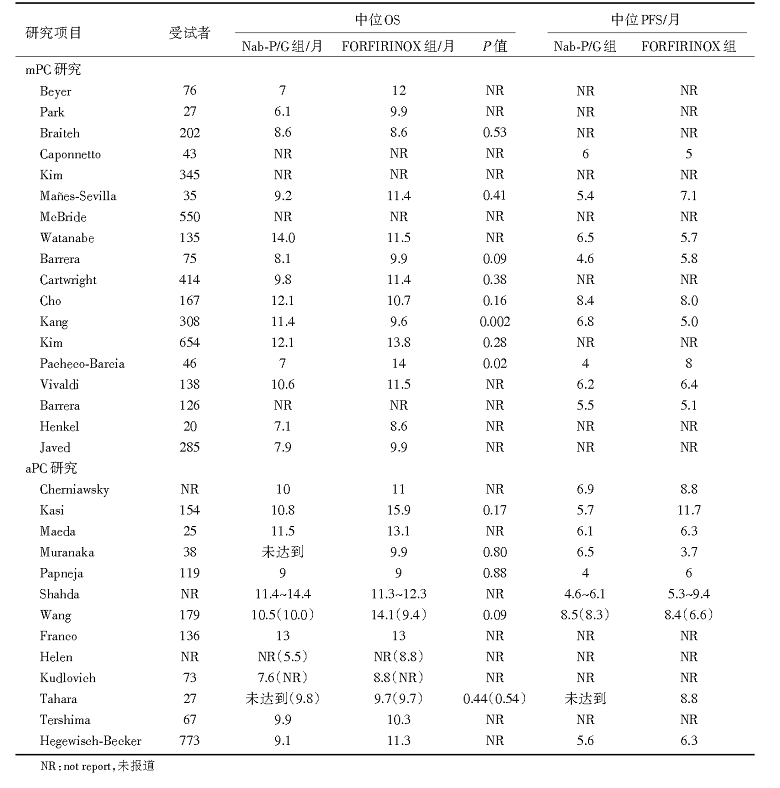
在最初筛选的818项研究中, 最终确定34项研究(21项mPC; 13项aPC)评估了6 915名接受nab-P/G或FOLFIRINOX方案治疗的胰腺癌患者。
nab-P/G和FOLFIRINOX的平均中位OS分别是14.4个月和15.9个月, 平均PFS分别是8.5个月和11.7个月。在14项有数据的比较中, 12项研究的OS差异没有统计学意义(P> 0.05); 1项研究报告nab-P/G组的OS高于FOLFIRINOX组(P=0.002), 1项研究报告FOLFIRINOX组的OS高于nab-P/G组(P=0.02), 详见表1。
| 表1 胰腺癌真实世界一线化疗疗效的结果 |
14项研究(2 205名患者)报告了安全性数据, 包括8个单中心机构研究。在大多数报告了安全性数据的单中心研究中, 3/4级中性粒细胞减少症(6项研究中的5项)和发热性中性粒细胞减少症(所有3项研究)的发生率FOLFIRINOX组高于nab-P/G组, 而7个研究周围神经病变的4个研究中, 3/4级周围神经病变的发生率FOLFIRINOX组高于nab-P/G组。
尽管在更多的研究中, FOLFIRINOX治疗组的中位OS轻微延长, 但其与nab-P/G组的差异并不具有统计学意义。因此, 有必要进行随机对照试验。毒性特征差异是治疗决策的关键性因素。
自1997年确立吉西他滨作为晚期胰腺癌标准一线治疗以来, 开展了很多临床研究, 但多数以失败告终, 仅少数几个研究取得阳性结果[1], 其中FOLFIRINOX、nab-P/G等联合方案明显优于吉西他滨单药而广泛应用于临床, 并成为目前晚期胰腺癌一线化疗的主流方案[2]。FOLFIRINOX、nab-P/G方案目前尚缺乏直接头对头比较的Ⅲ 期临床试验, 间接比较认为FOLFIRINOX方案优于nab-P/G方案[3], 但真实世界研究不可能严格按照Ⅲ 期临床研究的纳入及排除标准收治患者, 剂量也会作出不同的调整, 而剂量调整后疗效也可能出现下降[4]。因此, 间接比较的结果可能与真实世界研究的结果存在一定的差别。真实世界研究的结论很不一致[5, 6], 因此该研究系统评价了FOLFIRINOX、nab-P/G在晚期胰腺癌标准一线治疗的价值, 具有一定临床意义。
该系统评价共纳入34个研究, 涉及超过6 915例进展期及晚期转移胰腺癌患者, 对比nab-P/G和FOLFIRINOX的OS分别为14.4个月和15.9个月, 中位PFS分别为8.5个月和11.7个月。对其中14个研究进行安全事件比较, 发现3/4级中性粒细胞减少及中性粒细胞减少性发热的发生率FOLFIRINOX方案显著高于nab-P/G方案, 而3/4级外周神经毒性则多见于nab-P/G方案。其中5个研究对化疗后续的对症支持治疗(如应用集落刺激因子及抗生素、止吐及止痛、贫血治疗等)进行了比较, 发现nab-P/G方案所需要的对症支持治疗均少于FOLFIRINOX方案。4个研究还对比了药物经济学, 发现nab-P/G方案的每月费用少于FOLFIRINOX方案, 尤其在对症支持治疗方面的费用明显低于FOLFIRINOX方案。最后得出的结论是两个方案在生存期方面并没有显著差异, 而毒副反应及药物经济学等方面在治疗过程中需要重视。在缺乏Ⅲ 期随机对照研究的前提下, 该研究结论有一定的临床参考意义。
该系统评价检索方法科学, 有明确的纳入标准和排除标准, 有详细的文献检索策略, 能尽量做到查全查准, 对纳入文献进行质量评价, 结果可信。但仍存在不足之处:纳入文献质量参差不齐, 接近1/4研究质量评分不高; 纳入的部分研究样本例数太少(其中12个研究的样本量不足100例), 分析时亦无对样本数据作权重分析、按质量评分高低进行分层分析, 有可能造成结论偏倚。若仅对较大样本量(如共有16个研究大于100例, 其中7个研究在生存方面FOLFIRINOX优于nab-P/G, 3个研究为nab-P/G更为优胜, 3个研究显示两者生存相等, 另3个研究未报道生存情况)且研究质量较高的文献进行分析, 也许结论会有所不同, 基于上述不足, 非常有必要进行多中心、大样本的Ⅲ 期随机对照研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|