患者男性, 39岁, 2018-06-11因“ 右半结肠癌、肝转移灶切除术后1个月余” 入我院。2018年4月因“ 反复腹痛2个月余” 入当地医院, 腹部CT检查提示:①不除外结肠癌并累及浆膜层, 伴周围淋巴结转移可能; ②肝S6转移瘤(2个)。肠镜检查提示升结肠癌。2018-04-24 行“ 经腹腔镜右半结肠切除术+右肝结节切除+肝转移瘤射频消融术” 。术后病理提示:升结肠中分化腺癌, 部分(20%)为黏液腺癌, 可见神经束侵犯, 未见脉管癌栓, 淋巴结清扫9/34; 肝组织内见黏液腺癌组织。术后患者出现腹痛及发热, 行CT检查后考虑肝脏脓肿形成, 2018-05-14行“ 脓肿穿刺引流术” 。既往体健, 无吸烟史、饮酒史及肿瘤家族史。
体格检查:生命体征平稳, PS评分为0分。全身浅表淋巴结未触及, 头面部无水肿, Horner征阴性, 上腔静脉综合征阴性。皮肤黏膜无黄染, 无皮下出血点, 无肝掌、蜘蛛痣。右上腹部轻度压痛, 无反跳痛, 右侧腹部可见引流管, 已无明显引流液流出, 肝、脾无肿大, 腹部平坦, 移动性浊音阴性。神经系统检查无异常。
入院后辅助检查:
2018-06-11 PET/CT:结肠癌术后, 右半结肠缺失, 空肠-横结肠吻合, 符合术后改变; 右肺下叶结节, 肝S6结节, 肝门部、肠系膜区淋巴结, 糖代谢增高, 考虑转移性病变。18F-FDG-PET/CT体部扫描其它部位未见恶性肿瘤代谢影像。左肺上叶舌段小结节, 糖代谢未见增高。胰头前缘糖代谢增高, CT扫描未见异常, 考虑炎性病变。脑形态、结构及脑功能代谢未见异常。
外院手术标本病理会诊:升结肠组织, 可见异性腺体增生并呈浸润性生长方式, 有黏液湖形成, 黏液成分超过肿瘤的50%以上, 与周围结肠黏膜有移行过渡表现, 病变符合结肠黏液腺癌, 侵犯肠壁全层至浆膜下, 未突破浆膜层, 可见神经束侵犯, 未见脉管癌栓; 肝组织形态学符合结肠黏液腺癌肝转移; 结合影像学评估, 肿瘤分期为:pT3N2bM1b, Ⅳ B期; MSS型; K-RAS基因外显子2突变, N-RAS和BRAF基因为野生型。
血常规、肝肾功能、CEA、AFP、CA19-9、粪便常规(隐血)均未见异常。
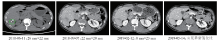
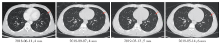
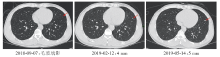
治疗过程:2018-06-16至2019-01-09行一线XELOX(卡培他滨+奥沙利铂)+贝伐珠单抗方案化疗8周期。4周期CT评价(2018-09-07):疾病稳定(stable disease, SD), 肝病灶缩小(22 mm× 20 mm), 未见淋巴结肿大, 右肺病灶增大1 mm(9 mm)。8周期CT评价(2019-02-12):SD, 肝病灶继续缩小(8 mm× 23 mm), 未见淋巴结肿大, 右肺病灶继续增大2 mm(11 mm)。2019-03-11开始2周期维持治疗:卡培他滨+贝伐珠单抗。维持治疗期间CT评价(2019-05-14):肺部病灶疾病进展(progression disease, PD), 肝脏未见明显转移灶、未见淋巴结肿大, 右肺病灶继续增大2 mm(13 mm, 增大62.5%)。2019-05-15开始予二线方案(伊立替康+雷替曲塞+贝伐珠单抗)治疗2周期。二线治疗2周期后PET/CT评价:肺部病灶继续PD, 肝脏未见明显转移灶、未见淋巴结肿大。患者肝脏和肺部病灶的CT图像见图1~图4。
徐飞(肿瘤内科医师):汇报病史特点:青年男性患者, 因“ 右半结肠癌、肝转移灶切除术后1个月余” 入院, 入院PET/CT提示为结肠癌术后伴肝肺同期转移, 在一线治疗中出现腹腔病灶(肝、淋巴结)逐渐缩小至消失, 肺部病灶逐渐增大, 并出现新病灶。提出讨论要点:(1)入院PET/CT显示的肝S6段、肝门部、肠系膜区淋巴结高代谢灶是否为转移灶?还是肝脓肿导致的炎症?(2)该患者在外院治疗前评估是否充分?如果我院首诊, 应该如何制定治疗策略?(3)对于转移性结肠癌患者, 转移灶切除的获益和时机?(4)目前是不是肺部转移灶的手术时机?
侯庆仪(核医学科副主任医师):由于2018-05-14行PET/CT时未补充肝脓肿穿刺引流的病史, 结合患者术前存在肝转移灶病史, 根据影像学表现, 首先考虑肝S6段、肝门部及肠系膜淋巴结为转移灶。但获知患者存在肝脓肿并穿刺引流的病史后, 再根据后续患者复查的影像学结果, 考虑上述病灶为炎性病变可能性更大。所以, 对于影像科医师, 采集病史的完整性非常重要。
徐飞:根据美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南, 对于怀疑有远处转移的结肠癌患者需进行以下评估:结肠镜、胸部/腹部/盆腔CT、血常规、CEA、肿瘤RAS基因状态、肿瘤错配修复(mismatch repair, MMR)或微卫星不稳定性(microsatellite instability, MSI)状态、PET/CT(经选择的部分有潜在可治愈机会的患者)、多学科讨论等。对于该患者, 术前未行胸部CT及相关病理学检查, 故该患者外院术前评估欠充分。
吴一龙(肿瘤学教授):美国NCCN指南引进中国后, 对于NCCN指南上建议的评估内容, 我们在具体临床实践中是怎么执行的?中国临床肿瘤学会(Chinese Society of Clinical Oncoloy, CSCO)结直肠癌诊疗指南中相应的部分是怎么指导临床实践的?中国相关肿瘤学科领域的专家在把国外指南引进国内的过程中, 是非常细致地将国外指南细则与国内实际情况相结合后, 再修订出适合国内临床实际的指南, 而不是简单照搬国外指南。而且在国内不同地区, 医疗条件存在巨大差异, 不可以用单一的、世界上“ 最激进” 的指南要求来评价当时的治疗方案是否正确。
旁述:根据2019年CSCO结直肠癌诊疗指南对于结肠癌诊断评估的Ⅰ 级推荐如下:全结肠镜检查+活检、胸部/腹部/盆腔增强CT、腹部平扫及增强MRI(CT不能确诊肝转移瘤)。对于PET/CT的推荐意见如下:临床怀疑转移但其他影像学检查无法确诊、或重大治疗决策前, PET/CT可用于发现可能转移灶, 从而避免过度治疗[1, 2, 3]; 但不推荐PET/CT作为结肠癌诊断的常规检查。
马冬(肿瘤内科主任医师):对于存在可切除转移灶的结肠癌患者, 切除转移灶是可以改善预后的[4, 5]。右半结肠癌同期远处转移比例较高, 治疗前的评估结果会影响治疗策略的制定。治疗前评估需从手术难度和患者病情两个角度评估。根据影像学评估, 该患者转移灶属于手术可切除的类型; 参考转移性结肠癌肝切除术后的临床风险评分系统, 该患者属于预后不良类型。根据欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)指南, 对于手术可切除但预后不良的患者, 应进行术前化疗。
谢淑飞(影像科副主任医师):根据多次CT评估结果, 考虑患者肝脏S6段病灶为术后炎症性改变。右肺下叶背段病灶、左肺上叶下舌段病灶缓慢进展; 左肺下叶背段病灶为8周期CT评价时的新发病灶。
马冬:结合整个治疗过程, 患者肝脏S6段及腹腔淋巴结并非转移灶, 在一线治疗过程中, 肺部病灶缓慢进展, 并出现新病灶; 综上所述, 该患者一线治疗是失败的。
杨学宁(肺科主任医师):该患者转移灶可评估为寡转移, 且进展缓慢, 同时对化疗耐药, 此时可以考虑手术切除肺部转移病灶。
潘燚(放疗科主任医师):在患者一线化疗失败的情况下可考虑立体定向体部放射治疗(stereotactic body radiation therapy, SBRT), 该治疗手段比手术的创伤性小, 而且疗效相当。
陈晓明(介入科主任医师):该患者在全身治疗的前提下, 可局部处理肺部病灶, 射频消融也是可选择的手段之一。
吴一龙:总结上述观点, 该患者一线治疗失败, 此时继续进行二线治疗有效率低, 在这种情况下需加入针对肺部转移灶的局部治疗。局部治疗的手段有以下几种可以选择:①手术; ②射频消融; ③SBRT。如何选择局部治疗手段需全面权衡每种手段的优缺点。上述三种方法, 局控率均非常高, 均可达80%以上。从创伤角度考虑, SBRT、射频消融均小于外科手术; 但外科手术有可以取到病理组织标本的优点。所以, 选择什么局部干预手段, 需综合考虑。
后记:考虑该患者肺部病灶为寡转移, 使用胸腔镜手术创伤小、恢复快, 手术完全切除病灶几率高, 同时可以获得病理标本。遂于2019-07-13在全麻下行经胸腔镜肺部病灶切除术, 术后病理:黏液腺癌, 符合结肠癌肺转移。待患者手术恢复良好后转入肿瘤内科继续行术后化疗。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|