作者简介:
夏武政(1983-) ,男,湖南株洲人,医学博士,主要研究方向为肝胆胰疾病的微创治疗和胰腺神经内分泌肿瘤的预防和治疗。
目的 检测PGAM1在胰腺神经内分泌肿瘤患者中的表达情况,评估其与临床病理特征和预后的关系。方法 采用免疫组化方法对71例胰腺神经内分泌肿瘤患者肿瘤组织中PGAM1免疫反应性进行检测。分别用实时荧光定量PCR(qRT-PCR)和Western blot检测肿瘤标本及其癌旁正常组织(n=24)的mRNA和蛋白水平。根据PGAM1免疫染色水平将胰腺神经内分泌肿瘤患者分为两组。分析研究PGAM1表达水平与患者临床病理特征和生存率的相关性。结果 qRT-PCR( P=0.017)和Western blot检测均显示胰腺神经内分泌肿瘤组织中PGAM1表达水平明显高于正常胰腺组织, 71例胰腺神经内分泌肿瘤标本免疫组化染色显示PGAM1蛋白主要定位于细胞质,PGAM1表达水平增高与肿瘤体积增大相关( t=3.65, P=0.025)。Kaplan-Meier生存曲线显示,PGAM1高表达的患者总生存率 ( P=0.019)和无进展生存率( P=0.049)均较低。结论 PGAM1高表达可能是胰腺神经内分泌肿瘤患者的一个潜在的预测预后的生物标志物。
Objective To identify overexpression of PGAM1 in patients with pancreatic neuroendocrine tumors (PNET) and evaluate its association with clinicopathological features and prognosis.Methods PGAM1 immunoreactivity in tumor tissues was determined by immunohistochemistry from 71 patients with PNET. The mRNA and protein levels were analyzed in cancer specimens and their corresponding para-tumor normal tissues (n=24) by qRT-PCR and Western blot, respectively. PNET patients were separated into two groups based on the immunostaining levels of PGAM1. Associations between PGAM1 levels and clinicopathological data, including patient survival, were investigated.Results Both qRT-PCR and Western blot assays showed that PGAM1 expression was increased in PNET tissues compared with normal pancreas tissues. Immunohistochemical staining of 71 cases of PNET specimens suggested that PGAM1 protein was mainly localized in the cytoplasm, and increased expression of PGAM1 was correlated with larger tumor size ( t=3.65, P=0.025). Kaplan-Meier survival curves indicated that patients with high expression of PGAM1 had a shorter overall survival ( P=0.019) and poorer disease-free survival ( P=0.049).Conclusions Our results suggested that PGAM1 may serve as a potential prognostic biomarker for PNET patients.
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors, PNET)是起源于胰腺神经内分泌细胞的肿瘤。虽然PNET被认为是一种相对罕见的疾病, 但在过去的20年中, PNET的发病率一直在快速增长。PNET占所有胰腺肿瘤的1%~3%, 是所有胃肠神经内分泌肿瘤中5年生存率最低的[1, 2, 3]。虽然PNET与其他胃肠神经内分泌肿瘤具有共同的历史特点, 但PNET在生物学行为、分子发病机制、临床特点以及对某些治疗的反应等方面存在诸多差异[4, 5]。相对于快速增长的发病率, 我们目前对PNET分子病理学的认识还不足以对其进行最佳的临床治疗。由于PNET的异质性, 其生物学和临床行为难以预测。此外, 虽然一些靶向药物已被用于治疗PNET, 如依维莫司和舒尼替尼, 但关键的目标分子尚未确定。
重新编程的能量代谢是癌症的一个特征, 也是肿瘤形成的一个关键因素[6]。Warburg效应是指肿瘤细胞主要通过有氧糖酵解产生能量的现象, 甚至在正常氧浓度的情况也是一样, 是肿瘤细胞中最具特征和最重要的代谢变化之一[7, 8]。磷酸甘油酸突变酶1(phosphoglycerate mutase 1, PGAM1)是一种代谢酶, 在糖酵解后期催化3-磷酸甘油酸转化为2-磷酸甘油酸, 从而推动糖酵解[9]。PGAM1是协调糖酵解和生物合成的关键酶。PGAM1在乳腺癌[10]、肺癌[11]、肝癌[12]和泌尿系肿瘤[13]中均发现过表达。这种表达上升通常与存活率低有关。PGAM1在PNET中的具体生物学作用尚未确定。在本研究中, 我们评估了71例接受根治性手术切除的PNET患者肿瘤组织中PGAM1的表达水平。探讨PGAM1与临床病理特征及预后的关系。
本研究选取2000年1月至2016年7月在广东省人民医院接受根治性手术切除的71例PNET患者的原发肿瘤组织及相应的癌旁正常组织。手术切除前未接受新辅助化疗、放疗或其他抗肿瘤辅助治疗的患者。手术中获取肿瘤组织。根据美国癌症联合委员会(AJCC)第七版分期系统和世界卫生组织2010年神经内分泌肿瘤分类系统对肿瘤的分期和病理特征进行评估。本研究方案经医院伦理委员会批准, 所有患者均签署知情同意书。
将手术切除的PNET标本用福尔马林固定并石蜡包埋, 制成4微米厚的切片, 采用标准方法进行染色。简单地说, 切片在二甲苯中脱蜡, 用分级乙醇再水合, 然后用0.3%过氧化氢处理, 用微波提取抗原。切片在12%的山羊血清中被阻断, 然后在4℃下用PGAM1抗体(Sigma, 多克隆兔抗体, 1:100)孵育过夜。在磷酸盐缓冲盐水中充分冲洗后, 切片用二抗(辣根过氧化物酶标记山羊抗兔)染色。信号用3, 3′ 二氨基苯并苯胺显色。PNET标本中PGAM1的表达水平由两位研究者独立检测, 他们根据细胞染色强度(0、1、2、3)和染色细胞百分比(0 ~ 100%)在随机选取的10个高功率场对切片进行评分。通过计算染色强度和染色程度的乘积, 采用半定量免疫组织化学(immunohistochemistry, IHC)评分, 得到每个标本最终的总分(区间为0~300分), 如我们之前的研究[14]所述。以所有病例IHC法评分的中位数作为截断值, 将所有患者分为低PGAM1表达组和高PGAM1表达组。
采用Trizol试剂(Takara, 日本)从24例患者的配对肿瘤组织和癌旁非癌组织标本中提取总RNA。总RNA使用PrimeScript RT试剂盒(Takara, 日本)进行反转录和定量实时PCR在 SYBR Premix Ex Taq Ⅱ (Takara, 日本)下操作。以GAPDH为内控, 检测PGAM1 mRNA水平, 引物序列如下:PGAM1正向:5′ -gtgcagaagagcgatccg-3′ , PGAM1反向:5′ -CGGTTAGACCCCCATAGTGC-3 ′ ; GAPDH正向:5′ - gtcggaggcaacatc-3′ , GAPDH反向:5′ -GTCC AAATGCGGGAACAG-3′ 。采用2-Δ Δ Ct法计算对比PGAM1在肿瘤组织和癌旁组织中RNA的表达水平。
所有数据均采用SPSS 17.0统计软件包进行处理。为比较组间临床病理特征, 分类变量采用卡方检验或Fisher确切概率法, 连续变量采用 t检验。以PGAM1 IHC评分中位数值分层, 生成总生存率(overall survival, OS)和无进展生存率(progression-free survival, PFS) 或者无病生存率(disease-free survival, DFS)的Kaplan-Meier曲线, 采用log-rank检验确定统计学意义。采用双侧检验, P≤ 0.05为差异有统计学意义。
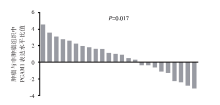
我们首先进行qRT-PCR检测PNET组织和配对癌旁正常组织(n=24, 新鲜冷冻组织)中PGAM1的mRNA表达。结果显示PNET组织中PGAM1 mRNA表达显著升高(P=0.017), 见图1(在肿瘤组织中, 相对于邻近的正常组织, 数据显示为多个。水平归一化为GAPDH, 表示为-Δ Δ CT)。接下来我们通过IHC法检测了71个PNET组织中PGAM1蛋白的表达情况。PGAM1免疫染色阳性的代表性图像如图2所示, 包括肿瘤细胞的弱、中、强表达。PGAM1阳性免疫染色显示, PGAM1主要定位于细胞质。总体上, 16例(22.5%)全阴性表达(评分=0), 26例(36.6%)肿瘤细胞呈弥漫性阳性染色超过80%, 5例(7.0%)评分为300分(100%肿瘤细胞呈强染色)。最后, 采用160分的中位数将所有样本分为PGAM1低表达组(n=36)和PGAM1高表达组(n=35)。
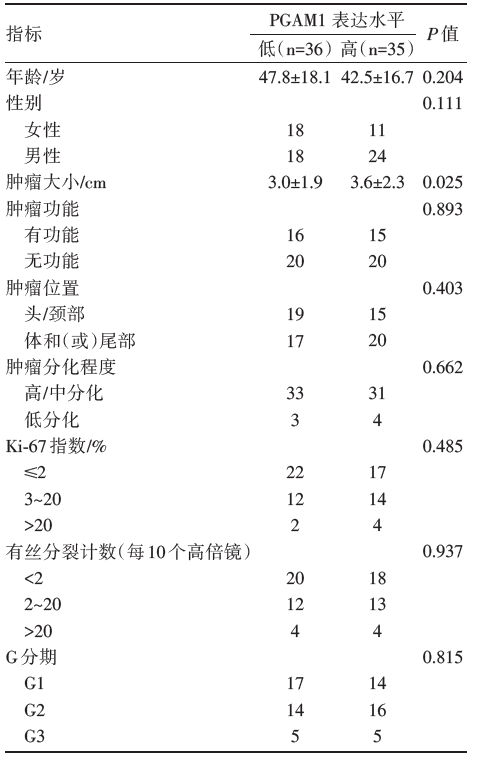
为了探讨PGAM1表达在PNET中的临床意义, 我们分析了PGAM1表达水平与相应患者临床病理特征的关系。如表1所示, PGAM1在PNET中的表达与肿瘤大小相关(t=3.65, P=0.025)。PGAM1表达水平与其他临床病理特征无相关性。
| 表1 PGAM1表达水平与临床特点的相关性 |
根据IHC评分的中位数将患者分为两组。log-rank检验的Kaplan-Meier曲线显示, 在所有患者中, 肿瘤标本PGAM1低表达的患者有较好的临床结局(OS的P=0.019, DFS的P=0.049), 见图3。由于G1(低分级)和G2(中分级)患者的临床病程比G3(高分级)患者更加不可预测, 我们进一步分析了PGAM1表达水平在G1和G2患者中的预后价值。Kaplan-Meier曲线显示, 在G1和G2 PNET患者中, PGAM1高表达组患者的OS (P=0.006, log-rank检验)和DFS (P=0.014, log-rank检验)明显较差, 见图4。这些数据表明PGAM1表达水平可能是预测PNET患者预后的一个指标, 尤其是G1和G2的患者。
PNET的发病率和患病率一直在稳步上升, 但PNET的进展和预后尚不清楚, 迫切需要为PNET的诊断、预后和治疗寻找新的分子靶点[15]。在本研究中, 我们观察到PGAM1过表达与PNET不良预后之间存在很强的相关性, 提示PGAM1可能成为PNET新的预后标志物。
癌细胞的糖代谢与许多正常细胞的糖代谢不同, 即使在正常的氧浓度水平下, 癌细胞糖代谢的主要特征是存在较高的需氧糖酵解率。糖酵解的增强使癌细胞能够满足它们对能量和增殖所需的生物合成材料的需求。PGAM1在糖酵解中占据一个独特的步骤。PGAM1过表达已在多种肿瘤细胞中发现, 并对肿瘤的进展提供代谢方面的支持[18, 19, 20]。最近的一项研究表明, PGAM1在协调糖酵解和合成代谢的过程中发挥着有趣而重要的作用[21]。Hitosugi等的研究表明, 抑制PGAM1在癌细胞中的表达不仅使糖酵解、磷酸戊糖通路的量和生物合成显著降低, 而且使细胞增殖和肿瘤生长减弱[22]。因此, PGAM1是糖酵解和生物合成途径中的关键分子靶点。
我们发现PGAM1的表达水平与PNET的总生存期和无进展生存期密切相关。世界卫生组织(WHO)将PNET分为三类:低分级(G1)、中分级(G2)和高分级(G3)。大多数PNET为G1级或G2级, 仅根据组织病理学标准预测G1、G2 PNET患者的预后及恶性潜能仍有困难[23, 24]。本研究还检测了PGAM1在G1/G2患者中的作用, 发现高表达PGAM1的G1/G2患者预后较差。这一发现可能有助于识别G1/G2患者的高危个体, 特别是那些具有相似临床病理特征的患者。
本研究存在一定的局限性。首先, 这是一项回顾性研究。其次, 本研究样本量不大, 因为PNET是一种罕见的肿瘤, 很难在一个中心获得一个大的队列。本研究的样本量难以达到Cox回归分析的标准建议。第三, 收集患者的时间跨度长, 随访项目也不是针对每一位患者都进行了长时间的标准化。上述限制对于单个中心来说是难以克服的。进一步的前瞻性多中心和分子机制的研究是必要的。
本研究首次将PGAM1表达水平作为PNET患者预后指标进行评估, 结果表明PGAM1表达水平与PNET患者预后密切相关, 需要进一步的研究来阐明其分子机制。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|