作者简介:
林辉(1987-),男,江西萍乡人,医学硕士,主要研究方向为肺及头颈部肿瘤的放射治疗。
目的 探讨靶向治疗时代全脑同步整合加量调强放疗对多发或大体积脑转移肺癌患者的疗效及安全性。方法 回顾性分析广东省人民医院放疗科58例非小细胞肺癌脑转移患者接受全脑同步整合加量调强放疗的疗效及毒副反应。结果 58例患者全部接受了全脑同步整合加量调强放疗,8例(14%)患者完全缓解,46例(79%)患者部分缓解,4例(7%)患者疾病稳定。全组中位颅内无进展生存期为15.9 个月,中位放疗后颅内无进展生存期为12.4 个月;中位总生存期为21.6 个月,中位放疗后总生存期为18.4 个月。有驱动基因初治脑转移组、有驱动基因继发脑转移组和无驱动基因脑转移组患者的放疗后颅内无进展生存期(9.0个月vs. 10.4个月vs. 13.9个月, P=0.166)及放疗后总生存期 (13.7个月vs. 20.9个月vs. 16.9个月, P=0.762) 无明显差异;有驱动基因继发脑转移组和无驱动基因脑转移组的颅内无进展生存期(12.5个月vs. 14.7个月 vs. 25.7个月, P=0.047)及总生存期(22.5个月vs. 17.6个月vs. 30.6个月, P=0.048)差于有驱动基因初治脑转移组,差异有统计学意义。早期毒性反应(CTC V4.0)Ⅰ度54例,Ⅱ度3例,Ⅲ度1例,无Ⅳ度反应。晚期毒性反应(RTOG)Ⅰ度55例,Ⅱ度3例,无Ⅲ、Ⅳ度反应。结论 全脑同步整合加量调强放疗对于肺癌多发或大体积脑转移患者具有较好疗效,毒副反应可耐受。
Objective In the era of targeted therapy, the efficacy and optimal dose of whole-brain radiotherapy+ simultaneous integrated boost (WBRT+SIB) for non-small cell lung cancer(NSCLC) patients with multiple or large volume brain metastases are unknown. This study analyzed the efficacy, safety and optimal dose of WBRT+SIB for NSCLC patients with multiple or large volume brain metastases.Methods Retrospective analysis was performed on the efficacy of WBRT+SIB in 58 patients with NSCLC brain metastasis in the Radiotherapy Department of Guangdong Provincial People's Hospital.Results 58 patients received WBRT+SIB, 8 patients (14%) achieved complete response(CR), 46 patients (79%) achieved partial response(PR), and 4 patients (7%) achieved stable disease(SD). The median intracranial overall survival(OS) was (21.6±2.5) months and post-radiotherapy OS (r-OS) was (18.4±2.4) months. There was no significant difference in post-radiotherapy intracranial progression-free survival(r-iPFS) and r-OS between mutant NSCLC with multiple brain metastases at time of diagnosis group, mutant NSCLC with multiple brain metastases after initial diagnosis and no mutant NSCLC with multiple brain metastases at time of diagnosis(9.0 vs. 10.4 vs. 13.9 months, P=0.166;13.7 vs. 20.9 vs. 16.9 months, P=0.762). The efficacy of intracranial-PFS(iPFS) and OS in no mutant NSCLC with multiple brain metastases at time of diagnosis and mutant NSCLC with multiple brain metastases after initial diagnosis, but worse than that in mutant NSCLC with multiple brain metastases at time of diagnosis group (12.5 vs. 14.7 vs. 25.7 months, P=0.047;17.6 vs. 22.5 vs. 30.6 months, P=0.048). Grade 1 acute toxicity(CTC V4.0) is reported in 54 cases, grade 2 in 3 cases, grade 3 in 1 case, no grade 4 case. Grade 1 late toxicity (RTOG) is reported in 55 cases, grade 2 in 3 cases, no grade 3 and grade 4 cases.Conclusion WBRT+SIB is effective in NSCLC patients with multiple or large volume brain metastases, with tolerable toxic and side effects.
最新的癌症调查研究显示非小细胞肺癌(non-small cell lung cancer, NSCLC)在我国发病率和死亡率最高[1], 其中20%~40%的患者在疾病进程中可能发生脑转移[2, 3]。在分子靶向治疗时代, 随着NSCLC治疗效果的提高脑转移发病率也明显提高[4, 5]。NSCLC合并脑转移的患者预后很差[6], 积极治疗后1年生存率仅为20%[7]。目前对于NSCLC脑转移患者的治疗手段主要有全脑放疗(whole brain radiotherapy, WBRT)、立体定向放射治疗(stereotactic radiosurgery, SRS)、手术治疗和靶向治疗。在靶向治疗时代前, WBRT是NSCLC多发脑转移患者的标准治疗方案。对于 1~3个颅内转移灶的患者, 单纯应用SRS较WBRT有更好的局部控制率[8]。靶向药物能透过血脑屏障, 在对颅外病灶控制的同时对脑转移瘤也有明确的疗效, 且可降低WBRT带来的毒副作用, 对于有驱动基因的肺癌脑转移患者, 靶向治疗是一种新的治疗方法。有文献报道对于单发的不能手术切除的患者, 行WBRT加SRS能明显提高生存率, 对于2~3个转移瘤的患者也推荐使用, 如肿瘤大于3 cm者并不适合行SRS治疗[9]。采用调强同步推量照射(simultaneous integrated boost, SIB)不但能提高靶区剂量分布的适形度和均匀性, 同时可以更好地降低脑部正常组织的受照射剂量, 尤其适合多个病灶、且肿瘤大于3 cm的患者[10]。SIB综合了WBRT和SRS两者的优点。理论上是一种疗效更佳、副作用更小的放射治疗方法。而对于大体积或多发转移瘤的患者, 选择全脑联合同步整合加量调强放疗(WBRT+SIB)能否提高疗效, 放疗与靶向治疗的顺序应如何安排都没有明确的答案。我院2013-2017年采用WBRT+SIB治疗肺癌多发脑转移患者, 取得较好疗效, 现报道如下。
本研究回顾性分析的2013年3月至2017年12月广东省人民医院放疗科58例NSCLC脑转移患者, 全部接受了WBRT+SIB治疗, 其中男性患者38例, 女性患者20例, 中位年龄51岁(25~82岁), 均经病理组织学或细胞学检查确诊为肺腺癌。所用标本都进行了驱动基因检测, EGFR突变检查采用DNA测序法或ARMS法, ALK融合基因检测采用FISH或IHC法。入组条件:PS 0~1分, 年龄大于18岁, 头颅增强MRI确认多发脑转移, 病灶数目不超过12个, 颅外病灶得到稳定控制(期望至少3个月生存)。排除标准:既往脑部接受过放疗和手术, 肿瘤内出血, 合并脑膜转移, 有中枢神经系统其他疾患, 妊娠, 脑干转移, 或靠近(≤ 6 mm)脑干、脊髓和视交叉。获得知情同意。
1.2.1 放疗方法
头部固定采用热塑成型膜无创固定, 行CT 模拟定位扫描。在 Eclipse(Varian Eclipse treatment planning system 8.6.23)治疗计划系统勾画正常器官(脑干、脊髓、视神经、视交叉、晶体、眼球和内耳)和肿瘤计划靶区(肿瘤区+3 mm), 计算所有转移灶的总体积。把患者的 MRI 图像和定位 CT 图像进行融合, 在 MRI的T1增强图像勾画肿瘤靶区。直线加速器采用Varian公司的 Trilogy 直线加速器, 配有60对多叶光栅(MLC), 单弧治疗时间 1~2 分钟。患者治疗之前行剂量验证和Cone-beam CT图像匹配和在线体位校正。采取6 MV的X射线, 全脑30 Gy+局部15~25 Gy(同步加量技术)/10 F, 全脑分割剂量3 Gy/F, 转移灶分割4.5~5.5 Gy/F, 每周5次。脊髓、脑干、视神经和视交叉照射剂量≤ 38 Gy, 晶体≤ 8 Gy。
1.2.2 靶向治疗方法
驱动基因阳性患者先服用靶向药物, 耐药后(出现颅内进展但颅外病灶稳定)给予放疗, 或者放疗后服用靶向药物。有EGFR突变的患者服用吉非替尼或厄洛替尼, 有ALK融合基因的患者服用克唑替尼。
评价标准:依据Response Assessment in Neuro-Oncology Brain Metastases (RANO-BM)统一标准判定, 疗效分为完全缓解(complete response, CR) , 部分缓解(partial response, PR), 疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。主要观察指标定义:颅内无进展生存期(intracranial progression-free survival, iPFS)为患者确诊脑转移进展时间, 将患者开始接受放射治疗后出现颅内进展的时间定义为放射治疗后颅内无进展生存期(post-radiotherapy iPFS, r-iPFS), 患者发现脑转移至死亡的时间设为脑转移后的总生存期(overall survival, OS), 患者开始接受放射治疗至死亡的时间设为脑放射治疗后的总生存期(post-radiotherapy OS, r-OS)。
急性放疗毒性反应根据CTC V4.0标准, 晚期反应根据RTOG中枢神经系统标准进行分级: Ⅰ 级, 有轻度的神经系统(nervous system, NS)症状, 无需药物治疗; Ⅱ 级, 有中度NS症状, 需门诊药物诊治; Ⅲ 级, 有严重NS症状, 需门诊或者住院药物诊治; Ⅳ 级, NS症状危及生命(例如不可控癫痫以及麻痹和昏迷等), 包含影像或者临床怀疑以及病理证实的放射坏死; Ⅴ 级, 死亡。
放疗期间每天观察病情变化, 包括呕吐和意识障碍情况, 每周查血常规和血生化1次, 治疗结束后3个月内每个月、1年内每3个月、2年内每6个月复查1次血常规和血生化。随访截止至2019年3月12日。
以SPSS 24.0软件分析, Kaplan-Meier用于估计生存函数, Tarone-Ware检验方法, P≤ 0.05为差异有统计学意义。
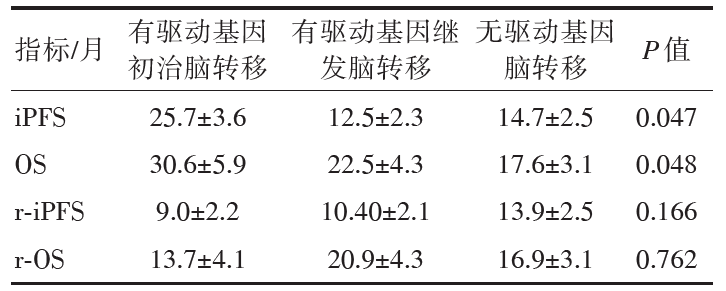
58例患者的基线情况见表1。其中3个以上转移病灶的患者有36例, 占比62%; 有EGFR基因突变或ALK基因融合的患者有28例(48%); 患者脑转移瘤平均体积(39.6± 28.1)cc。在中位随访时间13个月(3~56个月)后, 46例患者随访结束时已死亡。根据Lung-molGPA评分分层[11], 0~1分患者15例, 脑转移后平均生存时间(12.7± 2.3)个月; 1.5~2分患者27例, 脑转移后平均生存时间(23.6± 3.9)个月, 2.5~3分患者16例, 脑转移后平均生存时间(24.8± 5.0)个月, P=0.117。放疗期间的急性反应, 根据CTC V4.0标准评价, Ⅲ 度反应仅1例患者, Ⅱ 度反应3例患者, Ⅰ 度反应54例患者, 主要为Ⅰ 度乏力及呕吐反应, 急性毒性反应可接受。晚期反应根据RTOG中枢神经系统标准没有出现Ⅲ 度以上反应, 患者可耐受。58例患者在接受脑放射治疗后进行疗效评价, 8例(14%)患者CR, 46例(79%)患者PR, 4例(7%)患者SD。放疗后进展模式主要是病灶增多和增大, 放疗后仅放射野内复发患者有3例(5%), 29例(50%)患者出现颅内病灶增多, 26例(45%)患者颅内病灶控制良好, 脑部进展后有8例患者(都有基因突变)继续使用二线治疗, 其中有驱动基因初治脑转移组3例, 有驱动基因继发脑转移组5例。全组中位iPFS(15.9± 1.7)个月, 中位r-iPFS为(12.4± 1.7)个月。中位OS为(21.6± 2.5)个月, 中位r-OS为(18.4± 2.4)个月。完成放疗剂量45 Gy/10 F的有8例, 47.5 Gy/10 F的有18例, 50 Gy/10 F的有24例, 52.5 Gy/10 F的有4例, 55 Gy/10 F的有8例。其中放疗剂量45 Gy/10 F和55 Gy/10 F组脑部病灶控制较差, 放疗剂量52.5 Gy/10 F的患者获得最好控制时间, 放疗后脑部控制时间达到(20.2± 8.3)个月。四个剂量组的疗效差异有统计学意义, P=0.029, 见图1。有驱动基因初治脑转移组患者9例、有驱动基因继发脑转移患者19例、无驱动基因脑转移组患者30例。进一步分析发现有驱动基因初治脑转移组、有驱动基因继发脑转移组和无驱动基因脑转移组的r-iPFS(9.0个月vs. 10.4个月vs. 13.9个月, P=0.166)及r-OS (13.7个月vs. 20.9个月vs. 16.9个月, P=0.762)无明显差异; 有驱动基因继发脑转移组和无驱动基因脑转移组的iPFS(12.5个月vs. 14.7个月 vs. 25.7个月, P=0.047)及OS(22.5个月vs. 17.6个月vs. 30.6个月, P=0.048)差于有驱动基因初治脑转移组, 差异有统计学意义。见表2。
| 表1 患者基线特征 |
| 表2 肺癌脑转移患者脑转移瘤治疗脑部进展及生存情况 |
20%~40%NSCLC在整个疾病过程中出现脑转移[2, 3]。自从IPASS研究[12]发表以来, NSCLC尤其是有驱动基因患者的治疗效果有着明显提高。目前NSCLC患者随着生存时间的提高, 疾病过程中脑转移发病率也有明显提高[13], 而且以多发转移为主[14]。文献[15]提示对于有EGFR突变的NSCLC脑转移患者使用酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)治疗有效率可以达到50%以上, 比无突变患者有生存获益。WBRT+SIB在多发NSCLC脑转移患者中的疗效如何, 突变和无突变患者疗效有无差异目前无明确的临床数据。
有文献报道显示[16], 应用SRS治疗多发转移病灶的局部控制率可与寡转移灶类似。目前研究显示SRS能提高局部控制率, 最大分割剂量可以耐受单次24 Gy[17], 分次SRS的分割剂量较低, 可以保护脑干、视神经等重要器官, 适用于治疗脑干等部位病灶也适合治疗较大体积病灶, 可减少肿瘤周围正常组织的损伤。Routman等[18]分析了1 017例SRS患者的疗效, 研究显示对于转移病灶多于4个, 肿瘤体积大于10 cc的患者接受SRS效果获益不佳, 本研究81%的患者肿瘤体积超过15 cc, 中位r-OS明显较Routman等报道的接受SRS效果更佳。多个临床研究证实WBRT可以减少颅内新发病灶的发生率, WBRT+SIB兼顾了全脑和SRS的优点。对于多发或者大体积的脑转移患者更适合接受WBRT+SIB治疗。Dong等[19]的研究显示NSCLC脑转移患者接受了WBRT+SIB治疗, 1~7个病灶, 剂量52.5 Gy/15 F, 中位OS 为20.0个月, PFS为11.0个月, 毒性可以接受, 与我们的研究结果中位r-OS 18.4个月、中位r-iPFS 12.4个月类似, 然而Dong等的研究中并未阐明基因状态。Kim等[20]的研究显示, NSCLC脑转移患者接受了WBRT+SIB治疗, 中位随访时间14个月, 1年颅内转移灶控制率为67%。本研究的客观有效率达到93%, 较单纯靶向治疗的50%有效率明显提高, 与Kim等[19]研究对比稍有提高。虽然WBRT+SIB治疗效果有提升, 但目前SIB合适及安全的具体剂量还不太明确。本研究显示对于45~55 Gy/10 F治疗是安全的, 早期和晚期毒副反应可耐受。Zhou等[21]的研究中给予处方剂量40 Gy/20 F+20 Gy/4 F, 生物等效剂量低于本研究的最低剂量45 Gy/10 F。本研究显示放疗剂量45 Gy/10 F和55 Gy/10 F组患者的脑部病灶控制较差, 剂量50 Gy/10 F和52.5 Gy/10 F的患者可获得较好控制时间, 中位控制时间达到14.4个月和20.2个月, 四个剂量组的差异有统计学意义, P=0.029。较Brain[22]研究中WBRT的中位iPFS 4.8个月有明显提高, 比Zhou等[21]研究中的WBRT+SIB的生存期也有所提高, 这可能是因为较低剂量导致局部控制效果不佳, 较高剂量会因为放射损伤影响疗效, 中等剂量50 Gy/10 F~52.5 Gy/10 F是比较适宜的分割剂量, 但考虑样本量不大, 临床大规模应用需进一步的多中心研究验证。有文献[23]报道全脑保护海马放疗可以降低记忆损伤和提高生活质量, 采用VMAT调强技术行WBRT+SIB同时保护海马是可行的, 为提高肿瘤的放疗剂量提供了技术条件。
在靶向治疗时代, 对于有驱动基因的NSCLC多发脑转移患者优先使用放疗还是优先使用TKI治疗, 目前仍有争议。Magnuson等[24]的研究显示, 在TKI治疗之前使用放疗可以明显地提高iPFS和OS。但该研究是回顾性的研究, 仍需前瞻性研究证实。由吴一龙教授领导的Brain研究[22]比较靶向治疗与WBRT对NSCLC脑转移患者的疗效差异, 结果显示中位iPFS(WBRT vs. 埃克替尼)分别是4.8个月(95%可信区间2.4~7.2个月)和10.0个月(95%可信区间5.6~14.4个月), 差异有统计学意义, 风险比为0.56(95%可信区间0.36~0.90)。作者认为对于EGFR突变的NSCLC脑转移患者, 一线应用埃克替尼是推荐的首选治疗方案。目前我院对于基线有突变的NSCLC多发脑转移患者临床治疗先使用TKI治疗, 脑部病灶进展后再使用放疗。本研究显示对于初治突变的多发脑转移、继发突变的多发脑转移和初治无突变的多发脑转移的NSCLC患者接受WBRT + SIB治疗r-iPFS和r-OS没有差异, 见表2。放疗的中位控制时间为12个月, 较Yang等[22]报道的WBRT控制时间有明显提高, WBRT + SIB通过局部加量技术提高了脑部可见病灶的控制率, 毒副反应没有明显增多, WBRT + SIB技术值得推广。但是放疗失败后可选用的手段不多, 导致放疗后三组的r-iPFS和r-OS没有差异。本研究显示初治有突变的多发脑转移组预后较初治无突变的多发脑转移好, 与Sperduto 等[11, 14]研究显示的对于有基因突变的初治脑转移患者生存较无突变初治脑转移患者的预后较好的结果相符, 可能原因为TKI对于脑转移病灶控制率较好, 有文献[15]报道控制率大于50%, 失败后再行WBRT + SIB可达到与无突变初治脑转移患者类似的疗效, 放疗控制时间加上靶向药物控制时间比单纯放疗控制时间长。所以对于有基因突变的脑转移患者优先推荐先行靶向治疗, 脑部病灶控制失败后接受WBRT + SIB治疗, 本研究结果进一步验证基因状态对于脑转移患者的预后影响较大, 以后开展关于脑转移的临床研究应按照Lung-molGPA危险因素分层随机。
结语:因本研究病例样本量较少, 在病例选择方面难免存在一定偏差, 本研究结果仍可提示WBRT+SIB对于肺癌多发或者大体积脑转移患者疗效令人满意, 毒副反应可耐受, 肿瘤靶区合适照射剂量推荐50 Gy/10 F~52.5 Gy/10 F。对于有驱动基因初治脑转移患者先服用TKI, 颅内进展后行WBRT+SIB可以取得较长的颅内控制时间和OS。本研究没有进行精神状态量表分析, 也没有进行海马保护。需要以后的前瞻性研究来验证WBRT+SIB对精神状态的影响, 用前瞻性研究来探讨WBRT+SIB与靶向治疗联合的最佳顺序问题。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|