作者简介:
张屏(1993-),女,湖南邵阳人,博士研究生,从事心血管疾病遗传学研究。
心血管疾病已成为我国重大的公共卫生问题,临床上亟需新的诊疗方法来提高心血管疾病的防治水平。外泌体是由不同细胞分泌的纳米级脂质膜囊泡,其通过输送囊泡内容物(蛋白质、核酸等)介导细胞间的通讯,广泛参与机体的病理生理过程。肾素-血管紧张素系统是人体内重要的体液调节系统,在心血管疾病的发生发展中具有重要作用。研究显示外泌体和肾素-血管紧张素系统存在交互作用,共同参与心血管疾病的病理过程。在本篇综述中,我们主要概述外泌体与肾素-血管紧张素系统的相互作用在心血管疾病中的研究现状。
Cardiovascular diseases has become the most important public health issue in China, and new diagnostic and therapeutic methods are urgently needed to improve the level of prevention and treatment of cardiovascular diseases. Exosomes are membrane-derived nanovesicles secreted by different cells, which mediate cell-to-cell communication by transporting vesicle contents (proteins, nucleic acids, etc.) and widely participate in the pathophysiological process. Renin-angiotensin system (RAS) is an important humoral regulation system in human body and plays an important role in the occurrence and development of cardiovascular diseases. Studies have shown that exosomes interact with RAS, collectively participate in the pathological process of cardiovascular diseases. In this review, we summarize the research status of the interaction between exosomes and RAS in cardiovascular diseases.
最新心血管病报告显示, 我国心血管疾病的患病率及死亡率仍处于上升阶段, 推算心血管疾病现患人数2.9亿, 心血管疾病死亡率居首位, 占居民疾病死亡构成的40%以上, 心脑血管病住院总费用的年均增速远高于国民生产总值的增速[1]。可见, 心血管疾病已成为我国重大的公共卫生问题。因此, 寻找新的诊疗方法来提高心血管疾病的防治水平, 具有重大临床应用价值和巨大的社会经济效益。
外泌体是一种几乎所有细胞均可分泌的纳米级微囊泡, 直径大小在40~100 nm之间, 广泛存在于血液、尿液、脑脊液等体液中[2]。外泌体最初被认为是一种细胞排泄的垃圾而未得到重视, 近年来随着外泌体分离和鉴定技术的逐步成熟, 对其研究也逐步深入, 其在细胞间信息交流、疾病生物学标志以及药物运输等方面的价值得到重视, 成为当前的研究热点[3]。外泌体内包含蛋白质、核酸、脂质等多种生物活性物质, 携带了大量的生物信息。细胞释放的外泌体可通过直接接触, 与质膜融合或内吞作用进入靶细胞, 释放其内容物来调控细胞内信号。大量的证据表明外泌体及其内容物广泛参与心血管、肿瘤性及免疫性疾病的病理过程, 被认为是相关疾病潜在的生物分子标志物和干预靶点[4, 5]。
肾素-血管紧张素系统(renin-angiotensin system, RAS)是人体内重要的体液调节系统。在生理情况下, RAS对血压调节、水盐代谢具有重要作用, 而在病理情况下, 其与高血压、心肌肥厚、心力衰竭、动脉粥样硬化等心血管疾病的发生发展密切相关。近年来的研究显示, 外泌体及其内容物和RAS存在交互作用, 共同参与心血管疾病的病理过程, 包括内皮细胞损伤、心肌肥厚、心肌纤维化和炎性反应等。外泌体与RAS相互作用对心血管疾病有着潜在的重要影响, 但目前相关研究尚少, 其具体作用机制仍需进一步探究。将外泌体与RAS相结合, 深入研究两者在心血管疾病发生发展中的作用及其机制, 很可能为心血管疾病的诊治提供新策略、新靶点。
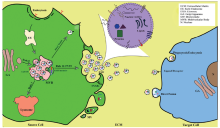
外泌体在细胞内吞系统中形成, 与细胞膜融合后以外分泌的形式释放到细胞外, 该过程复杂而有序。首先, 细胞内吞、细胞膜内化产生早期核内体, 然后在转运必需内吞分选复合物(endosomal sorting complex required for transport, ESCRT)作用下形成成熟的晚期核内体, 即多囊泡体(multivesicular body, MVB)。基于不同的生化特性, 一些MVB被转运到溶酶体后进行蛋白组的降解, 而另一些MVB被转运到细胞膜后与其融合并释放囊泡, 这些释放到细胞外微环境的囊泡即被称为外泌体, 见图1[6]。研究表明多种分子介导外泌体的形成和分泌。ESCRT募集泛素化的蛋白质到质膜上, 促进MVB释放其内的囊胞[7]。四跨膜家族蛋白(CD63、CD9等)与外泌体内容物的分选有关[7]。此外, Rab和SNARE家族也是外泌体分泌中的重要调节分子[8]。
外泌体内包含蛋白质、mRNA、miRNA、lncRNA、DNA、脂质等多种生物活性物质, 携带了大量的生物学信息。截至目前, 外泌体中已发现有9 769种蛋白质、3 408种mRNA、2 838种miRNA及1 116种脂类物质[9]。现普遍认为, 外泌体及其内容物具有重要的生物学功能和广阔的应用前景。第一, 外泌体携带亲本细胞表面的蛋白和胞质内的成分, 其表面标志物的表达可用于识别亲本细胞的类型[10]。第二, 外泌体携带不同的信号分子(如蛋白质、RNA)并可作用于靶细胞, 其类似脂质体的结构允许装载各种药物, 因此具有巨大的潜力用于药物的靶向输送和治疗[3]。第三, 外泌体及其内容物参与一些疾病的发生发展过程, 有望成为相关疾病的新型生物标志物和干预靶点[4, 7]。
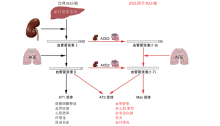
在经典的RAS中, 肾脏球旁细胞分泌肾素, 将肝脏中产生的血管紧张素原(angiotensinogen, AGT)转化为血管紧张素Ⅰ (angiotensinⅠ , AngⅠ ), AngⅠ 在血管紧张素转换酶(angiotensin converting enzyme, ACE)催化下转化为血管紧张素Ⅱ (angiotensinⅡ , AngⅡ )。AngⅡ 是RAS的主要活性物质, 其通过与AngⅡ 1型受体(angiotensinⅡ type 1 receptor, AT1R)结合, 发挥收缩血管、水钠潴留、促醛固酮合成、促纤维化、促细胞增殖、心肌肥厚等作用(见图2)。AngⅡ 2型受体(angiotensinⅡ type 2 receptor, AT2R)和血管紧张素转换酶2(ACE2)/Ang-(1-7)-Mas受体轴则可对抗经典RAS的作用[11]。AT2R具有扩张血管、促钠盐排泄、抗炎、抗纤维化、抗增殖等作用[12]。虽然AT2R的表达在胎儿期最高, 在出生后不久下降, 但在心力衰竭、肾衰竭、糖尿病和动脉粥样硬化等疾病中, AT2R的表达可能上调[13]。ACE2是RAS家族的新成员, 其通过高效降解ACE的作用产物AngⅡ 和竞争性地作用于ACE的底物AngⅠ 并产生Ang-(1-9), 最终均生成Ang-(1-7)来对抗ACE及其产物AngⅡ 的作用(图2)。ACE2/Ang-(1-7)/Mas受体轴通过降解AngⅡ 、减少促炎性因子的释放以及抑制参与组织纤维化的信号通路等, 从而在心血管疾病中发挥保护作用[14]。
外泌体包含多种蛋白质、核酸等物质, RAS成分主要为多肽(如AngⅡ )或蛋白酶(如ACE2), RAS成分是否也存在于外泌体中, 是否以外泌体为载体调控心血管疾病的病理过程。Pironti等研究表明心脏在压力负荷下, 心肌细胞释放的外泌体中富含AT1R, 这些AT1R随外泌体在血液中运行, 最终被心肌细胞、骨骼肌细胞和肠道阻力血管摄取, 发挥调节血压的功能[15]。在Tong等研究的AngⅡ 诱导的高血压血管重构模型中, 检测了大鼠血管外膜成纤维细胞来源的外泌体中RAS成分的表达水平, 采用qPCR测定AGT、AT1R、ACE的mRNA水平, ELISA测定AngⅡ 、AT1R、ACE蛋白水平, 以及荧光法测定ACE酶活性。该研究结果显示上述RAS成分在血管外膜成纤维细胞来源的外泌体中均有表达, 且自发性高血压大鼠的血管外膜成纤维细胞来源的外泌体中ACE蛋白水平和酶活性升高, 导致血管平滑肌细胞中AngⅡ 水平和AT1R活性升高, 从而促进细胞迁移[16]。该研究提示, RAS成分也存在于外泌体中, 且其表达水平很可能与心血管疾病相关。
免疫细胞引发的炎症在心血管疾病发生发展中发挥重要作用, 炎性因子增多被认为是心血管疾病患者的不良预后的危险因素之一[17]。Mayuko等采用持续静脉泵入AngⅡ 构建高血压大鼠模型, 高血压大鼠心脏巨噬细胞浸润增加, 且血清外泌体中miR-17显著减低可导致内皮细胞炎性因子PAI-1、ICAM-1表达上调[18]。另一项AngⅡ 诱导的自发性高血压大鼠模型中, 将自发性高血压大鼠的血浆外泌体经腹腔注射入正常血压大鼠体内, 正常血压大鼠出现血压升高且胸主动脉血管壁增厚、纤维化明显增加, 而自发性高血压大鼠经腹腔注射正常血压大鼠来源的血浆外泌体后发生相反的变化[19]。该研究表明外泌体可介导AngⅡ 引起的病理过程, 但未进一步阐明具体的分子机制。
Lyu等报道AngⅡ 可与心脏成纤维细胞膜上的AT1R和AT2R结合, 促进外泌体释放及其蛋白质含量改变, 进而通过MAPK和Akt信号激活心肌细胞RAS, 导致心肌肥厚[20]。Zhang等研究发现过表达ACE2的内皮组细胞释放的外泌体中miR-18a水平升高, 通过抑制Nox2/ROS信号保护老化内皮细胞缺氧/复氧损伤[21]。另一项临床研究显示内源性的RAS激活可导致尿外泌体中γ 钠离子通道蛋白含量升高[22]。以上研究均表明, RAS可通过影响外泌体中内容物的含量, 导致细胞间信号分子异常, 从而调控心血管疾病相关的病理过程。这为RAS调控心血管疾病发生发展的分子机制研究提供了新的思路。
AngⅡ 是RAS主要的活性物质, 分子机制研究表明AngⅡ 可通过以下途径促进心血管疾病的发生发展:上调粘附分子、趋化因子、细胞因子等炎症分子(如ICAM-1、TNF-α )的表达, 从而促进炎症反应; 诱导活性氧生成和减少一氧化氮生成引起氧化应激损伤; 激活AT1/Nox1/ROS、AT1/Nox1/IL-18 等信号通路促进平滑肌细胞增殖、迁移; 刺激细胞外基质释放和诱导生长因子表达导致血管壁重塑[23, 24, 25]。
在心血管疾病研究中, AngⅡ 被广泛用于诱导各种心血管病理模型, 如自发性高血压、心肌肥厚及氧化应激损伤等。miRNA是一类长度为18~25个核苷酸的非编码RNA, 可与靶基因3’ 非翻译区(3’ UTR)结合促进靶基因 mRNA 降解或抑制其翻译, 从而在转录后水平负调控基因表达。近来, 一些研究表明外泌体介导miRNA以旁分泌的方式调控AngⅡ 引起的病理过程。例如:心脏成纤维细胞来源的外泌体miR-21-3p水平降低可上调SORBS2和PDLIM5基因表达, 有助于改善AngⅡ 诱导的心肌细胞肥大[26]; 神经祖细胞来源的外泌体miR-210通过抑制Nox2/ROS和VEGF/VEGR2信号通路减轻AngⅡ 诱导的脑内皮细胞损伤[27]; 心肌球样细胞来源的外泌体中含量最高的小RNA(YF1)通过上调抗炎因子白介素-10(IL-10)的表达, 从而减轻AngⅡ 诱导的心肌肥厚、心脏炎症和纤维化及肾功能损伤[28]。
综上所述, 外泌体与RAS均在心血管疾病的发生发展中具有重要作用, 而将两者联系起来的研究并不多。外泌体与RAS的交互作用主要体现在以下几点:第一, 外泌体中含有RAS成分, 可将RAS成分输送至靶细胞; 第二, RAS活化可促进外泌体释放及其内容物改变; 第三, 外泌体中内容物可调控AngⅡ 引起的病理过程。
外泌体具有重要生物学功能和广阔的研究前景, 目前关于外泌体与RAS的相互作用在心血管疾病中的研究内容有待深化。首先, 外泌体中含有多种RNA成分, 而仅有少数miRNA被提及, 其它lncRNA、circRNA尚未有报道。其次, 外泌体或可作为心血管疾病药物(如RAS抑制剂)的靶向输送工具, 以达到更好的临床治疗效果。此外, 目前极度缺乏临床研究来探索心血管疾病中外泌体与RAS的相互作用, 而外泌体作为疾病潜在的生物标志物和干预靶点, 需要临床试验和基础实验来共同验证。全面和深入研究外泌体和RAS的相互作用, 揭示这两者在心血管疾病发生发展中的作用机制, 可能发现新的生物标志物和靶向治疗方法, 将有效提高心血管疾病的防治水平。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|