| 董晓荣,主任医师,三级教授,博士生导师,华中科技大学协和医院肿瘤学教研室副主任、华中科技大学协和医院肿瘤中心胸部肿瘤科主任。兼任中国临床肿瘤学会理事、中国抗癌协会肺癌专业委员会委员、中国临床肿瘤学会免疫专业委员会委员、中国临床肿瘤学会青年专家委员会常委、中国临床肿瘤学会非小细胞肺癌专家委员会委员、湖北省抗癌协会肿瘤免疫治疗专业委员会主任委员。 一直从事肿瘤放化疗临床工作,擅长胸部肿瘤(肺癌、食管癌、纵膈肿瘤)的诊断、规范化和个体化治疗(放化疗、分子靶向治疗、免疫治疗、国际新药临床试验研究),尤其对肺癌精准个体化治疗有丰富经验和造诣,牵头多项全国多中心临床试验。现负责国家自然科学基金4项、博士后基金2项及多项省部级课题,主要研究领域:肺癌脑转移的机制研究、放射性损伤机制的研究及防治,已发表第一作者和通讯作者的SCI论文40余篇,任国家自然科学基金一审评委和多种国际期刊的审稿人。获湖北省科技进步二等奖1项。 |
研究一:Hellmann MD, Ciuleanu TE, Pluzanski A, et al. Nivolumab plus Ipilimumab in lung cancer with a high tumor mutational burden[J]. N Engl J Med, 2018, 378(22):2093-2104.
研究二: Hellmann MD, Paz-Ares L, Bernabe Caro R, et al. Nivolumab plus Ipilimumab in advanced non-small-cell lung cancer[J]. N Engl J Med, 2019, 381(21):2020-2031.
1b。
纳武利尤单抗联合伊匹木单抗治疗非小细胞肺癌(non-small-cell lung cancer, NSCLC)在Ⅰ 期临床试验中获得很好疗效, 肿瘤突变负荷(tumour mutation burden, TMB)是潜在的生物标志物, 但仍需Ⅲ 期临床试验来探索在TMB高(≥ 10个突变/Mb)的人群中双免疫治疗对比含铂双药化疗的无进展生存期(progression-free survival, PFS)。
在之前的研究中, 纳武利尤单抗联合伊匹木单抗治疗NSCLC的缓解率优于纳武利尤单抗单药治疗, 表达程序性死亡配体1(programmed death ligand 1, PD-L1)的患者获益更明显, 但NSCLC患者是否能从双免疫治疗中获得长期获益需要更多的数据支持。
研究一:比较TMB高(≥ 10个突变/Mb)的NSCLC患者使用纳武利尤单抗联合伊匹木单抗治疗和化疗的PFS。
研究二:探索NSCLC患者使用纳武利尤单抗联合伊匹木单抗的长期获益。
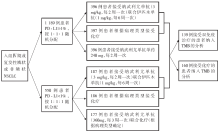
• 研究条件:美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)的临床试验协作项目(CheckMate-227, NCT02477826)。
• 研究方法: 多中心、开放标签、Ⅲ 期、随机对照临床试验。
• 研究时间:2015年8月至2016年11月。
• 研究对象:组织学确诊的Ⅳ 期或复发性鳞状或非鳞状NSCLC, 未曾接受系统性全身抗肿瘤治疗, 未检测到已知的EGFR或ALK敏感突变, PS评分0~1分。
• 干预措施:具体干预措施流程见图1。
• 评价指标:研究一的主要终点指标包括基于TMB分组的PFS和基于PD-L1分组的总生存期(overall survival, OS), 次要终点指标包括在TMB≥ 13个突变/Mb且PD-L1≥ 1%的患者中纳武利尤单抗单药对比化疗的PFS和纳武利尤单抗联合伊匹木单抗对比化疗在TMB≥ 10个突变/Mb的患者的OS, 探索性终点指标包括客观缓解率(objective response rate, ORR)、缓解持续时间和安全性。研究二的主要终点指标包括双免疫治疗对比化疗在PD-L1≥ 1%患者中的OS, 次要终点指标包括根据盲态的独立审查委员会评估的PFS和纳武利尤单抗联合化疗对比化疗在PD-L1< 1%的患者的OS以及纳武利尤单抗单药对比化疗在PD-L1≥ 50%的患者的OS。
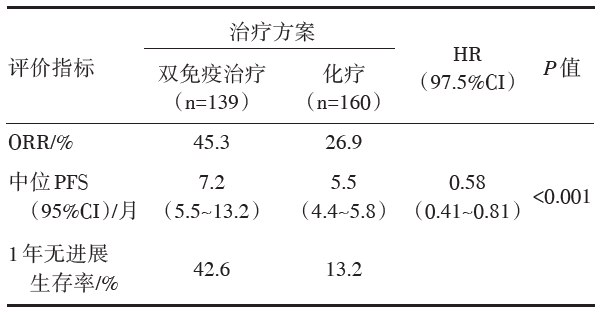
研究一:共入组1 739例NSCLC患者, 其中1 004例患者有基于TMB分析的疗效数据, 444例患者TMB≥ 10个突变/Mb, 其中139例患者接受双免疫治疗和160例患者接受化疗。高TMB患者的疗效分析见表1。在PD-L1≥ 1%和PD-L1< 1%的亚组分析中, 双免疫治疗和化疗的获益基本一致。双免疫治疗组3/4级不良事件发生率为31.2%, 化疗组为36.1%。
| 表1 高TMB组的疗效分析 |
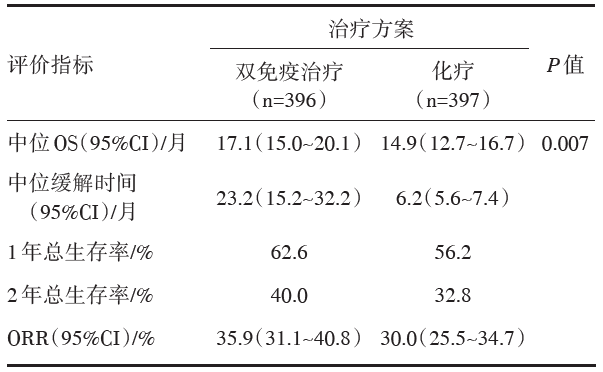
研究二:PD-L1≥ 1%患者的疗效分析见表2。PD-L1< 1%患者中使用纳武利尤单抗联合伊匹木单抗的中位OS为17.2个月, 使用化疗的中位OS为12.2个月。在所有入组患者中, 双免疫治疗组中位OS为17.1个月, 化疗组为13.9个月。3/4级不良事件发生率在双免疫治疗组为32.8%, 化疗组为36.0%。
| 表2 PD-L1≥ 1%患者的疗效分析 |
高TMB患者一线接受纳武利尤单抗联合伊匹木单抗治疗的PFS显著优于化疗, 且与PD-L1表达水平无关。
一线纳武利尤单抗联合伊匹木单抗治疗NSCLC的OS长于化疗, 且与PD-L1表达水平无关。
在不到10年的时间里, 免疫检验点抑制剂(immune checkpoint inhibitor, ICI)为肿瘤治疗带来前所未有的改观, 在恶性黑色素瘤、NSCLC、肝癌、结直肠癌等10多个瘤种中都给患者带来显著的疗效。在NSCLC领域, 最长随访时间的CheckMate 003研究显示接受Nivolumab二线治疗的患者6年生存率达14.7%[1], 较以往治疗手段明显提高了晚期患者长期生存率, 实现将部分晚期肿瘤患者转变为慢性病患者。随着二线NSCLC中ICI对比化疗多个随机对照研究的成功[2, 3, 4, 5], ICI也迈进了NSCLC的一线治疗。
目前NSCLC的一线治疗主要分为免疫单药和免疫联合两个治疗模式。免疫单药KEYNOTE-024首先证明在PD-L1肿瘤比例评分(tumor proportion score, TPS)≥ 50%的人群中, 主要研究终点Pembrolizumab PFS 10.3个月显著优于含铂双药化疗6.0个月(HR 0.50, 95%CI 0.37~0.68, P< 0.001)[6]。随后KEYNOTE-042亚组分析、IMpower110研究都证明PD-L1高表达人群一线免疫单药OS优于化疗[7, 8]。虽然免疫单药扩大至PD-L1 TPS≥ 1% 人群的KEYNOTE-042研究对比化疗获得了总体OS的阳性结果[16.7个月vs. 12.1个月, HR 0.81(0.71~0.93), P=0.001], 但亚组分析也提示PD-L1 TPS 1%~49%的人群对比化疗并无明显获益[13.4个月vs. 12.1个月, HR 0.92(0.77~1.11)], 所以目前尽管美国食品及药品管理局(Food and Drug Administration, FDA)批准免疫单药可用于PD-L1 TPS≥ 1% 人群, 但临床应用会更多考虑PD-L1低表达人群使用免疫联合模式。免疫联合化疗模式来自KEYNOTE-189, KEYNOTE-407, IMpower130研究, 证明了一线NSCLC免疫联合化疗PFS、OS都优于对照组[9, 10, 11]。但对于PD-L1高表达人群, 免疫联合化疗似乎并未有疗效的明显提升, 副反应率却较单药增加。免疫联合除联合化疗外, 还可以联合抗血管生成如IMpower150模式, 以及联合另一种ICI。这次主要就双免疫联合CheckMate 227 Part 1研究和大家探讨下。
首先CheckMate 227 Part 1 试验组采用的治疗方案是程序性细胞死亡1(programmed cell death 1, PD-1)抑制剂Nivolumab联合细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4, CTLA-4)抑制剂Ipilimumab。PD-1抑制剂主要在T细胞效应阶段起作用, 阻断PD-1与PD-L1的结合, 恢复T细胞杀伤肿瘤细胞功能, 其作用主要在肿瘤部位。CTLA-4抑制剂主要作用于T细胞活化的阶段, 与初始T细胞表面上的CTLA-4结合, 促进T细胞的增殖和活化, 主要作用在淋巴结部位, 从肿瘤免疫循环的环节上来说在PD-1通路的上游[12]。在肿瘤浸润的T细胞亚型上, PD-1抑制剂主要使耗竭样CD8+ T细胞增多, 而CTLA-4则同时还能使Th1样CD4+ T细胞增多[13]。从机制上看, 双免疫联合有协同作用的可能。临床研究能否验证其协同作用, 还要看CheckMate 227 Part 1的数据结果。
CheckMate 227 Part 1是一项多中心开放性Ⅲ 期随机对照临床研究, 主要想看不同PD-L1表达人群Nivolumab联合Ipilimumab对比化疗的疗效, 此外, PD-L1阳性人群还设置了Nivolumab单药组, PD-L1阴性人群还设置了Nivolumab + 化疗组。主要终点为选择人群中Nivolumab + Ipilimumab对比化疗的疗效, 包括高TMB(TMB≥ 10个突变/Mb)患者的PFS, 和PD-L1阳性人群的OS。一共入组1 739例患者(PD-L1≥ 1%, n=1189例; PD-L1< 1%, n=550例)。这是一项复杂而庞大的研究。两个主要研究终点分别在2018年和2019年发表在《N Engl J Med》杂志上, 高TMB人群双免疫联合中位PFS 7.2个月对比化疗组5.5个月(HR 0.58, 97.5%CI 0.41~0.81, P< 0.001), 1年无进展生存率42.6% vs. 13.2%, 达到第一个主要研究终点。PD-L1阳性人群双免疫联合中位OS 17.1个月对比化疗组14.9个月(HR 0.79, 97.72%CI 0.65~0.96, P=0.007)。第二个主要研究终点亦达到[14, 15]。
先谈谈研究设计, 有以下3点是值得思考的:(1)CheckMate 227 Part 1最终设计复杂庞大, 根据PD-L1选择, 分为两个队列, 每个队列设置三个臂, 试图回答多个问题, 从统计学角度这样的设计带来很大挑战, 有的问题没有预设统计学假设, 即使有结果可信度也不高; (2)该研究的第一个主要研究终点高TMB人群的PFS, TMB是在研究入组结束后引入的, 引入TMB因为CheckMate 026回顾分析提示TMB可能是一个有临床意义的生物标志物[16], CheckMate 568 Nivolumab联合Ipilimumab一线治疗NSCLC的Ⅱ 期研究中也初步验证了TMB阈值定为10个突变/Mb有临床意义[17], 高TMB患者并没有前瞻性随机分组, 虽然从基线特征上看双免疫治疗组和化疗组较为均衡, 但和前瞻性预设仍然有差别; (3)该研究没有将非鳞和鳞癌患者分开, 这两种组织亚型在预后和一线治疗方案上有差别, 且二线研究提示非鳞和鳞癌接受ICI对PD-L1表达状态的依赖也有差异, 在一线研究中分开设计可能会更好把握结果。
再来看看研究基于TMB和PD-L1提出的双免疫联合, 免疫联合化疗, 免疫单药和化疗哪个治疗方案更优的问题回答得如何。CheckMate 227 Part 1是第一个随机对照试验中试图回答TMB能否作为ICI临床应用生物标志物的研究, 研究证明了高TMB患者双免疫组PFS显著优于化疗组。首次报道美国癌症研究协会(American Association for Cancer Research, AACR)CheckMate 227 Part 1 PFS数据时已是2018年, 这时无论监管机构还是临床工作者对于免疫治疗药物长期疗效的特点已有共识, 已不仅仅满足于PFS的获益, 更期待OS的获益。但最终结果TMB≥ 10 个突变/Mb双免疫治疗组中位OS 23.0个月对比化疗组16.4个月, HR 0.68(0.51~0.91); TMB< 10个突变/Mb双免疫治疗组中位 OS 16.2个月对比化疗组12.6个月, HR 0.75(0.59~0.94), 即无论TMB高低, 免疫治疗组OS都优于化疗组[15]。TMB定义为10个突变/Mb阈值并未预测双免疫治疗OS的疗效。而MYSTIC研究探索结果血液TMB(blood TMB, bTMB)≥ 20个突变/Mb患者中, 与化疗相比, Durvalumab + Tremelimumab联合治疗可显著改善患者的OS[18]。虽然组织TMB 10个突变/Mb也与bTMB 20阈值设置不同。最终TMB能否作为双免疫药物临床应用生物标志物的问题悬而未决。那么TMB能否作为Nivolumab单药的生物标志物?这个也是研究的次要终点, PD-L1阳性且高TMB人群(TMB≥ 13个突变/Mb)Nivolummab单药对比化疗的PFS, 结果PFS未优于化疗, 不过两组样本量分别只有71例和79例, 且TMB和PD-L1混杂在一起, 高TMB、PD-L1在两组间未随机。而来自KEYNOTE042回顾性分析结果显示组织TMB(tissue TMB, tTMB)≥ 175时, Pembrolizumab的OS显著优于化疗[19]。不同TMB的定义, 不同的结局。这个问题也未得到解决。
作为研究主要研究终点PD-L1阳性双免疫联合对比化疗的OS, 研究给出了明确的答案, 优于化疗, 给临床一线治疗多了一个去化疗的选择。但目前高表达患者免疫一线单药疗效已得到认可, 双免疫疗效会更好吗?CheckMate 227 Part 1 设置了双免疫联合对比化疗, 单药对比化疗, 诚然双免疫联合优于单药, 但Nivolumab单药还未在一线获批。高表达人群中双免疫联合目前只有完全缓解8.8%, 缓解持续时间31.8个月的数据使人感受到双免疫治疗深度缓解且持久的优势。对于PD-L1表达1%~49%这个人群主要选择免疫联合化疗, 双免疫联合是否优于免疫联合化疗, CheckMate 227 Part 1并未设计, 但亚组分析提示双免疫联合对比化疗并未明显获益, 也间接回答了上面的问题。再来看PD-L1阴性人群, 虽不是主要研究终点, 双免疫联合中位OS 17.2个月对比化疗12.2个月, HR 0.62(0.48~0.78), 让人眼前一亮。且在PD-L1阴性患者中设置了双免疫联合对比化疗, 免疫联合化疗对比化疗, 在同一研究中显示双免疫联合优于免疫联合化疗, 2年总生存率双免疫联合组和PD-L1阳性人群相同都是40%。KEYNOTE-189中PD-L1阴性人群免疫联合化疗2年总生存率38.5%[20]。
最后再看看Nivolumab联合Ipilimumab安全性, 以往报道Ipilimumab毒副反应发生率高于PD-1抑制剂, 让临床较为担心。早期Ipilimumab在NSCLC中的探索剂量高达10 mg/kg/3w, Ipilimumab和Nivolumab不同, 不良反应发生率呈明显剂量依赖[21]。在晚期NSCLC双免疫联合Ⅰ 期CheckMate 012研究中发现Nivolumab联合低剂量Ipilimumab 1 mg/kg/6 w, 耐受性较好, 这一联合方式成为了Ⅲ 期研究的方案。这次报道任何级别治疗相关不良反应发生率77%, 3~4级治疗相关不良反应发生率33%, 导致停药率分别是18%和12%, 可以接受。相较Nivolumab联合化疗治疗相关不良反应发生率更低、程度更轻[15]。
值得一提的是CheckMate 227 Part 1研究中双免疫治疗组曲线在2年之后趋于平稳给人留下深刻印象, 这一点在以往免疫联合化疗研究中并未看到, 随着随访时间延长, 是否能出现5年总生存率的惊喜值得期待。免疫治疗机制复杂, 临床研究众多, 很多问题还需要时间来回答, 让我们拭目以待。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|