| 谢聪颖,肿瘤学博士,主任医师,温州医科大学附属第一医院放化疗科科主任,2009年美国密歇根大学医院肿瘤中心访问学者。担任中国临床肿瘤学会(CSCO)理事、CSCO肿瘤放射治疗专家委员会委员,中国抗癌协会肿瘤放射防护专委会常委、中国抗癌协会肿瘤放射治疗专业委员会委员、中国抗癌协会肺癌专业委员会委员、中国抗癌协会肿瘤靶向治疗专业委员会委员,浙江省抗癌协会理事、浙江省抗癌协会青年理事会副理事长、浙江省抗癌协会生物治疗专业委员会侯任主任委员、浙江省医学会放射肿瘤治疗学分会副主任委员、浙江省医师协会肿瘤精准治疗专业委员会副主任委员,中华医学会温州肿瘤放化疗分会主任委员。在国内外杂志发表论文90多篇,其中第一/通讯作者在《Clin Can Res》等SCI杂志上发表论文39篇,主持并完成科研项目10多项。获2016、2018年美国放射肿瘤学年会最佳论文奖(Best of ASTRO),主持获浙江省人民政府科技进步奖三等奖2次,参与获中华医学奖三等奖、浙江省医药科技创新奖一等奖等多次。获得国家发明专利和国家实用新型专利各一项。作为编写专家参与《CSCO原发性肺癌诊治指南》等制定。担任《Ann Oncol》、《J Clin Oncol》等中文版编委。 |
Antonia SJ, Villegas A, Daniel D, et al. Overall survival with Durvalumab after chemoradiotherapy in stage Ⅲ NSCLC[J]. N Engl J Med, 2018, 379(24):2342-2350.
1b。
Durvalumab是一种选择性、高亲和力的人源IgG1单克隆抗体, 能阻断程序性死亡-配体1(programmed death-ligand 1, PD-L1)与程序性死亡受体-1(programmed death-1, PD-1)和CD80的结合, 使T细胞识别和杀伤肿瘤细胞。
PACIFIC是一项随机、对照、 Ⅲ 期试验, 评估免疫检查点抑制剂Durvalumab对在同步放化疗后未出现疾病进展的不可切除性Ⅲ 期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的疗效。早期分析显示, 与安慰剂相比, Durvalumab显著地延长了这类患者的无进展生存期(progression-free survival, PFS), 但是总生存期(overall survival, OS)并未得出结果。
评估Durvalumab对同步放化疗后未出现疾病进展的不可切除性Ⅲ 期NSCLC患者的OS是否长于安慰剂, 同时还报告PFS、次要疗效和安全终点的结果。
• 研究条件:全球包括亚洲、澳大利亚、欧洲、北美、南美和南非的26个国家235个中心参与的PACIFIC临床试验 (NCT02125461)。
• 研究方法:多中心, 双盲, 随机对照试验, Ⅲ 期临床研究。
• 研究时间:2014年5月7日至2018年3月22日。
• 研究对象:组织学或细胞学诊断的不可切除性Ⅲ 期NSCLC患者。入组标准:接受至少两个周期以铂类为基础的化疗和放疗, 放化疗后未出现疾病进展, 且最后一次放疗在随机分组前1~42天内。
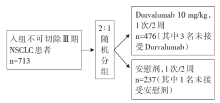
• 干预措施:共713名患者以2:1进行随机分组, 其中Durvalumab组(n=476)3名、安慰剂组(n=237)1名没有接受指定的干预。剩余709名患者, 473名接受了Durvalumab, 236名接受了安慰剂。Durvalumab剂量为10 mg/kg, 1次/2周, 持续12个月, 或持续到确诊的疾病进展、启动替代性癌症治疗、不可接受的毒性事件发生或撤回同意。研究干预流程见图1。
• 评价指标:主要终点指标为OS和PFS, 次要终点指标包括24个月的总生存率、客观缓解率、缓解持续时间、12个月和18个月的无进展生存率、死亡或远处转移时间、第二次进展时间和安全性。
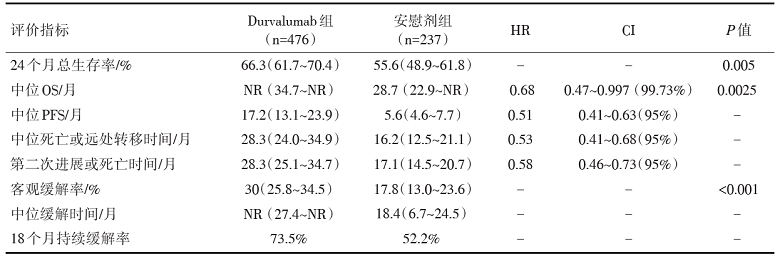
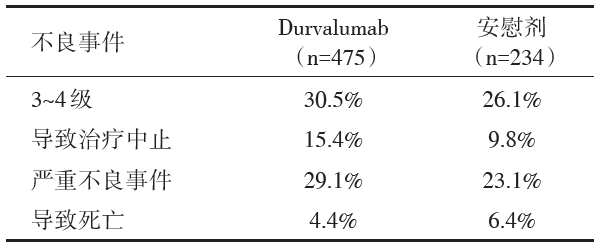
共713名患者接受随机分组。总生存期的中位随访时间为25.2个月。Durvalumab较安慰剂显著延长OS[死亡风险比(hazard ratio, HR)0.68, 99.73%可信区间(confidence interval, CI)0.47~0.997, P=0.002 5], 安全性可耐受, 研究终点指标见表1, 不良事件见表2。
| 表1 PACIFIC研究的主要疗效 |
| 表2 不良事件总结 |
对于同步放化疗后未出现疾病进展的不可切除性三期NSCLC患者, Durvalumab显著延长了这类患者的总生存期。
局部晚期(Ⅲ 期)NSCLC约占NSCLC总数的1/3, 其治疗从1980年的单纯放疗[1], 发展到1990年的放疗联合化疗[2], 再到2000年后正式确立了以铂类为基础的同步放化疗的地位[3]。然而不管是改变放疗剂量的RTOG 0617研究[4], 还是加用靶向药物的SWOG S0023研究[5], 均没有改善OS。患者的中位PFS约为15~18个月, 超过50%的复发转移率[6], 5年生存率仅在15%~32%左右[7], 亟需新的有效的治疗策略。
PACIFIC研究的出现, 诚如其名, 像一场海啸, 引发了肿瘤学界的轩然大波。2017年的欧洲肿瘤内科学会 (European Society for Medical Oncology, ESMO)上首次公布PACIFIC研究的中期数据显示Durvalumab可显著改善Ⅲ 期不可切除的NSCLC患者的PFS, 并同步发表在《N Engl J Med》[8]。2018年2月美国食品药品监督管理局(Food and Drug Administration, FDA)批准了Durvalumab用于不可手术的Ⅲ 期NSCLC同步放化疗后的维持治疗, 并写入美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南。2018年9月的世界肺癌大会 (World Conference on Lung Cancer, WCLC)首次公布了OS数据, 再次登顶《N Engl J Med》[9], 代表了Ⅲ 期不可切除的NSCLC治疗领域的里程碑式进展。
PACIFIC研究是一项随机、双盲、安慰剂对照的国际多中心的Ⅲ 期临床研究。该研究共纳入709例不可切除的Ⅲ 期NSCLC患者, 给予不少于2个周期的含铂放化疗后1~42天内按2:1随机分为Durvalumab组(473例)和安慰剂组(236例), 并按年龄、性别、吸烟史分层, 每2周分别静脉给予Durvalumab(10 mg/kg)和安慰剂以巩固治疗12个月。主要终点为独立中心盲法评估的PFS和OS, 次要终点包括无进展生存率与总生存率、客观缓解率(objective response rate, ORR)及缓解持续时间。
研究结果显示, 截至2018年3月, 299例患者(Durvalumab组183例, 安慰剂组116例)发生死亡, OS中位随访时间为25.2个月。与安慰剂相比, Durvalumab显著延长了OS, 两组的中位OS分别为未达到和28.7个月(HR=0.68, 99.73%CI 0.470~0.997, P=0.002 5), 疾病死亡风险降低了32%; 两组的中位PFS分别为17.2个月和5.6个月 (HR=0.51, 95%CI 0.41~0.63)。另外, Durvalumab组的中位死亡时间和远处转移时间均长于安慰剂组, 分别为28.3个月和16.2个月(HR=0.53, 95%CI 0.41~0.68), 新发脑转移的频率(6.3% vs. 11.8%)也比安慰剂组低; 两组的ORR分别为30.0%和17.8% (P< 0.001)。
在药物安全性方面, PACIFIC研究中同步放化疗联合Durvalumab的毒性与单纯放化疗相近, 并没有明显的提高。Durvalumab组和安慰剂组3~4级不良事件发生率分别为30.5%和26.1%; 不良事件导致治疗中止率分别为15.4%和9.8%, 其中最常见的原因均为肺炎(4.8% vs. 2.6%)。严重不良事件发生率分别为29.1%和23.1%, 其中不良事件致死率为4.4%和6.4%。
从研究设计上看, PACIFIC研究的成功, 主要在于其研究设计的合理性, 前期的基础研究显示, 放疗可通过调节PD-L1的表达从而对免疫治疗起到增敏作用[10]。PACIFIC研究正是利用了这一原理, 对同步放化疗之后的肺癌患者给予Durvalumab治疗, 考虑到了临床实践中患者的真实条件, 实现了免疫巩固治疗在Ⅲ 期不可切除的NSCLC中零的突破。
尽管PACIFIC研究结果为Ⅲ 期不可切除的NSCLC患者同步放化疗后的巩固治疗提供了新的选择, 但仍有一些问题值得深入探讨。首先是PD-L1抑制剂和放化疗的最佳结合模式。目前正在进行中的PACIFIC-2研究(NCT03519971)也在探索放化疗同步PD-L1抑制剂治疗Ⅲ 期不可切除的NSCLC, 未来的研究结果可能会为临床诊疗提供新的思路。其次, 在PACIFIC研究中, PD-L1检测并非必需。在亚组分析中发现PD-L1表达< 1%的人群OS未获益, 治疗前是否需要进行PD-L1检测以及检测方法的差异将是临床治疗中面临的问题。同时, 对治疗前获得的组织标本进行PD-L1检测并不能完全代表同步放化疗后PD-L1表达[11]。尽管同步放化疗后PD-L1表达更为可靠, 但组织再活检存在一定的困难。第三, 虽然在PACIFIC研究中≥ 3级肺炎的发生率低, 但是亚洲地区、非鳞、PS=1、表皮生长因子受体(epidermal growth factor receptor, EGFR)突变的患者中肺炎发生率高, 有关放射性肺损伤与免疫相关性肺损伤的毒性叠加问题值得重视。另外, PACIFIC研究入组人群多为非亚裔人群, 对于常见的驱动基因尤其是EGFR突变的亚裔人群是否适合, 尚待商榷。
总而言之, PACIFIC研究达到了Durvalumab组PFS和OS的双重获益, 为改善局部晚期不可切除的NSCLC患者的不良预后迈出历史性的一步。未来针对生物标志物(例如PD-L1表达和肿瘤突变负荷)以及放化疗和免疫疗法之间的最佳时机的研究将至关重要。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|