| 冯卫能,佛山市第一人民医院头颈胸肿瘤内科主任、主任医师、硕士研究生导师。主要研究方向为肺癌多学科综合治疗。兼任中国抗癌协会癌症康复与姑息治疗专业委员会委员、广东省医学会肺部肿瘤学分会副主任委员、广东省医师协会肿瘤内科医师分会副主任委员、广东省胸部肿瘤防治研究会副理事长、广东省精准医学应用学会肺癌分会副主任委员、广东省临床医学学会精准医疗专业委员会常务委员、广东省转化医学学会肿瘤学分会常务委员、广州抗癌协会肺癌专业委员会副主任委员、广州抗癌协会分子靶向治疗专业委员会副主任委员。 |
研究一:Nakagawa K, Garon EB, Seto T, et al. Ramucirumab plus Erlotinib in patients with untreated, EGFR-mutated, advanced non-small-cell lung cancer (RELAY): A randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2019, 20(12):1655-1669.
研究二:Zhou Q, Wu YL, Cheng Y, et al. CTONG 1509: Phase 3 study of Erlotinib with or without Bevacizumab in untreated Chinese patients with advanced EGFR-mutated NSCLC[J]. Ann Oncol, 2019, 30(5S):v602-v660.
1b。
临床前和临床研究证实厄洛替尼联合抗血管生成药物具有协同作用, 可显著延长表皮生长因子受体(epidermal growth factor receptor, EGFR)敏感突变晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的无进展生存期(progression-free survival, PFS)。
目前的研究局限在单中心、开放的临床试验, 尚缺少随机双盲、全球多中心的临床试验证实靶向药联合抗血管生成药物的有效性。
研究一(RELAY研究):比较治疗EGFR敏感突变晚期NSCLC的靶向药联合抗血管生成药方案厄洛替尼联合雷莫芦单抗的PFS是否优于单纯使用厄洛替尼。
研究二(CTONG1509):比较治疗EGFR敏感突变中国晚期NSCLC的靶向药联合抗血管生成药方案厄洛替尼联合贝伐珠单抗的PFS是否优于单纯使用厄洛替尼。
研究一:
• 研究条件:包括日本、美国等13个国家100个医疗中心参加的临床研究(NCT02411448)。
• 研究方法:多中心、Ⅲ 期、双盲、随机对照临床试验。
• 研究时间:2016年6月28日至2018年2月1日。
• 研究对象:诊断明确的Ⅳ 期EGFR突变阳性(EX19del或EX21 L858R)ECOG PS 0~1分的NSCLC患者。未曾接受化疗或靶向治疗。排除脑转移和EGFR T790M突变。
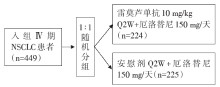
• 干预措施:患者按照1:1的比例随机分组, 分别接受厄洛替尼联合雷莫芦单抗方案或厄洛替尼单药治疗。干预措施流程见图1。
• 评价指标:主要研究终点PFS, 次要研究终点包括安全性, 总生存期(overall survival, OS), 客观缓解率(objective response rate, ORR), 疾病控制率(disease control rate, DCR), 反应持续时间(duration of response, DoR)等。
研究二:
• 研究条件:中国14个中心参加的临床研究(CTONG 1509研究, NCT02759614)。
• 研究方法:多中心, Ⅲ 期, 开放, 随机对照临床试验。
• 研究时间:2016年3月31日至2017年7月26日。
• 研究对象:局部晚期/晚期EGFR突变阳性(EX19del或EX21 L858R)非鳞NSCLC患者。未曾接受化疗。可耐受贝伐珠单抗。
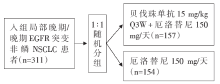
• 干预措施:患者按照1:1的比例随机分组, 分别接受厄洛替尼联合贝伐珠单抗方案或厄洛替尼单药治疗, 治疗干预措施流程见图2。
• 评价指标: 主要研究终点PFS, 次要研究终点包括安全性, OS, ORR, DCR等。
研究一:
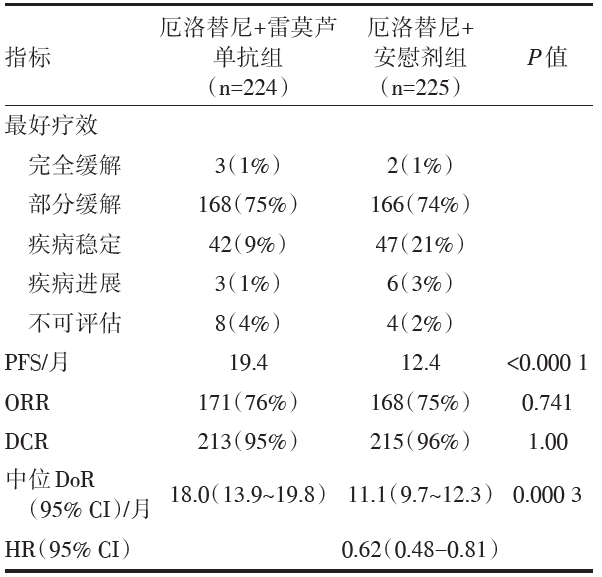
共入组患者449例。中位随访时间为20.7个月。在既往未经治疗的转移性EGFR突变的NSCLC患者中, 雷莫芦单抗联合厄洛替尼治疗可显著提高无进展生存率, 中位PFS为19.4个月[95%可信区间(confidence interval, CI)15.4~21.6], 而安慰剂和厄洛替尼的中位PFS为12.4个月(95%CI 11.0~13.5), OS数据尚未成熟(见表1)。值得注意的是, 在RELAY研究中L858R的无进展生存率(通常与EX19del相比治疗效果较差)与EX19del相似。
| 表1 RELAY研究的主要和次要终点指标 |
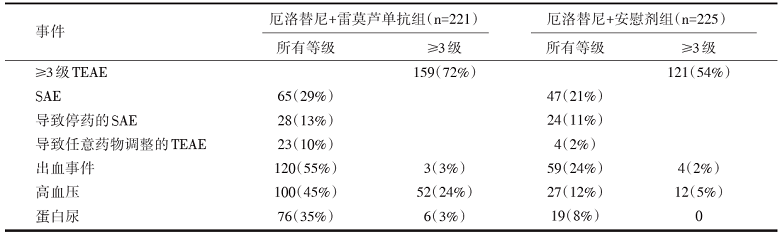
与安慰剂和厄洛替尼相比, 雷莫芦单抗联合厄洛替尼治疗增加了一些治疗相关不良事件(treatment-emergent adverse event, TEAE)的发生率; 然而, 差异主要是由1~2级事件引起的。该研究出现的不良事件通过剂量调整和支持性治疗基本上是可以控制的。抗血管生成药物的药理类相关作用, 即高血压、蛋白尿和出血事件, 雷莫芦单抗联合厄洛替尼治疗发生率高于安慰剂和厄洛替尼组, 但除高血压外, 其严重程度主要为1级和2级(见表2)。
| 表2 RELAY研究安全性总结 |
第一代和第二代EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)对一线治疗耐药的最常见机制是T790M突变。在RELAY研究中, 两个治疗组之间进展期的T790M患者比例相似, 雷莫芦单抗联合厄洛替尼与厄洛替尼单药耐药后出现T790M的发生率分别为25%(95%CI 16%~36%)、30%(95%CI 22%~40%), 但患者耐药后分析采用的是血浆ct-DNA NGS的方法, 这一种方法可能受血浆标本是否含有肿瘤释放的ctDNA影响, 可能出现假阴性。因此研究者另外分析了进展后NGS检测还存在EGFR 19del或L858R突变患者的T790M突变发生率分别为43% vs. 47%, P=0.849; 33% vs. 42%, P=0.732, 提示联合模式治疗不影响T790M突变的发生率。
研究二:
CTONG1509研究也再次证实“ A+T(厄洛替尼联合贝伐珠单抗, n=157)” 模式可以显著延长患者PFS[18.0 vs. 11.3个月, 风险比(hazard ratio, HR) 0.55, P< 0.001], 相较于对照组(n=154)有接近7个月的绝对获益(见表3)。
| 表3 CTONG 1509研究终点 |
EX21 L858R突变和脑转移人群获益更明显。亚组分析中可以看到, EX21 L858R突变患者的PFS获益更显著, 达到了19.5个月, 相较于对照组延长了近10个月(19.5 vs. 9.7个月, HR 0.51)。 其次, 在CTONG1509研究中入组了接近30%的基线脑转移患者, PFS的HR是0.42, 提示联合模式可能获得更好的获益。毒副反应方面, 最常见的≥ 3级不良事件是高血压、蛋白尿, 这些也是我们预期范围以内的不良事件, 并且基本上可以耐受和控制。
靶向药联合抗血管生成治疗EGFR突变阳性NSCLC患者中具有明显的PFS获益, 安全性可控, 因此, 对于转移性EGFR突变的NSCLC患者, 靶向药联合抗血管生成治疗是一种可行的新治疗方案。
表皮生长因子受体(epidermal growth factor receptor, EGFR)及血管内皮生长因子(vascular endothelial growth factor, VEGF)具有相同的下游通路, 两者可发生交互作用调控肿瘤血管生成及细胞增殖, 临床前研究已经证实与单独抑制EGFR通路相比, 双重阻断EGFR和VEGF通路可提高抗肿瘤活性[1]。因此, 对于EGFR突变晚期非小细胞肺癌, 研究者们希望在一线治疗方案, 一代EGFR-TKI的基础上, 联合抗血管生成药物以进一步提高疗效。
近期报告的两项Ⅲ 期随机对照研究结果均显示, 厄洛替尼联合抗血管生成药物一线治疗方案可显著提高EGFR突变晚期非小细胞肺癌的PFS。发表在《Lancet Oncol》的RELAY研究是一项国际多中心研究, 其中77%患者为亚裔, 该研究没有纳入中枢神经系统转移患者。研究结果显示, 厄洛替尼联合雷莫芦单抗组的PFS达到19.4个月, 而厄洛替尼联合安慰剂组的PFS为12.4个月, 联合治疗可将疾病进展风险降低41%(HR=0.59, 95%CI 0.46~0.76, P< 0.001) [2]。ARTEMIS(CTONG 1509)研究是由广东省人民医院吴一龙教授牵头在国内开展的Ⅲ 期随机对照研究, 周清教授在2019年欧洲肿瘤内科学会(European Society of Medical Oncology, ESMO)上口头报告了其研究结果[3]。该研究设计与RELAY研究相似, 但纳入了脑转移的患者(厄洛替尼联合贝伐单抗组占28%, 厄洛替尼单药组占30%)。研究结果显示:厄洛替尼联合贝伐单抗组独立评审的中位PFS达到18.0个月, 厄洛替尼单药组中位PFS是11.3个月(HR=0.55, P< 0.001)。次要终点研究者评估的PFS在厄洛替尼联合贝伐单抗组是18.0个月, 厄洛替尼单药组是11.2个月(HR=0.57, P< 0.001), 两个结果高度一致。而且, 亚组分析发现两个比较有意思的结果, 一是EGFR 21外显子突变患者从厄洛替尼联合贝伐单抗治疗中获益更大, 厄洛替尼联合贝伐单抗组的独立评审PFS高达19.5个月, 比厄洛替尼单药的9.7个月延长了近10个月。二是厄洛替尼联合贝伐单抗治疗模式在脑转移的患者中也有很好的疗效(HR=0.50)。
两项研究均未出现预期外的不良反应, 但雷莫芦单抗增加了与厄洛替尼相关不良事件的发生率, 如3级以上的痤疮样皮炎和腹泻发生率增加(分别为15% vs. 9%、7% vs. 1%)。加入抗血管生成药物, 增加了该类药物特有的不良反应, 如高血压、蛋白尿等。厄洛替尼联合雷莫芦单抗组和厄洛替尼单药组的高血压、蛋白尿发生率分别是24% vs. 5%、3% vs. 0。厄洛替尼联合贝伐单抗组和厄洛替尼单药组的高血压、蛋白尿发生率分别是18.5% vs. 3.3%、8.3% vs. 0。总体上仍在可控范围内。
两项研究进一步证实厄洛替尼联合抗血管生成药物治疗模式的优势, 为厄洛替尼联合抗血管生成药物治疗模式提供了高级别的证据。就国内临床实践而言, 由于厄洛替尼、贝伐单抗均已纳入国家医保目录, 费用大大降低, 具有很好的可及性, 厄洛替尼联合贝伐单抗方案更适合国内应用。但是, 对于有脑转移的患者, 厄洛替尼联合雷莫芦单抗的疗效尚不清楚。
厄洛替尼联合抗血管生成药物治疗模式无疑为EGFR突变晚期非小细胞肺癌一线治疗增加了新选择, 但也存在一些争议及需要进一步探索的问题。
(1)相比厄洛替尼单药, 厄洛替尼联合抗血管生成药物治疗模式虽然延长PFS, 但仍需确认OS是否获益。厄洛替尼联合抗血管生成药物方案比厄洛替尼单药增加了毒副反应, PFS延长能够转化为OS优势才能更好体现这种联合治疗模式的价值。既往报告的Ⅱ 期随机对照研究JO25567 及Ⅲ 期随机对照研究NEJ026同样显示厄洛替尼联合贝伐单抗治疗较厄洛替尼单药可显著延长PFS[4, 5], 但JO25567研究长期随访结果显示两组间的OS没有差异(47.0个月 vs. 47.4个月)[6]。当然, JO25567研究的样本量不足以评估OS的差别, 目前对这结论的判定为时过早。厄洛替尼联合抗血管生成药物治疗模式的PFS延长能否转化为OS获益需等待NEJ026、RELAY及ARTEMIS(CTONG 1509)这3项Ⅲ 期随机对照研究数据揭晓。
(2)在EGFR突变晚期非小细胞肺癌一线治疗选择众多的情况下, 需要考虑筛选厄洛替尼联合抗血管生成药物治疗模式的获益人群, 实施更精准治疗。目前, 第一、二、三代EGFR-TKI均是EGFR突变晚期非小细胞肺癌一线治疗选择, 基于奥希替尼获得最长的PFS, 以及对比吉非替尼具有OS优势[7], 奥希替尼被NCCN指南推荐为优先选择方案[8]。但对于EGFR 21外显突变亚组, 奥希替尼对比吉非替尼的HR值为0.996, 奥希替尼相比吉非替尼并不具有OS优势[7]。在ARTEMIS(CTONG 1509)研究中, 厄洛替尼联合贝伐单抗治疗EGFR 21外显子突变的PFS为19.5个月, 比厄洛替尼单药的9.7个月延长了近10个月, 提示21外显子突变患者可能是厄洛替尼联合贝伐单抗治疗模式的获益人群。这结果也引出一个需要解答的重要问题, 21外显子突变患者对这种治疗模式获益的机制是什么呢?只有明确这种治疗模式的作用机制, 才能精准筛选出获益人群。既往有研究显示合并共存突变会显著降低一代EGFR-TKI的疗效, 研究同时发现EGFR 21号外显子突变患者合并共存突变的比例更高[9]。合并共存突变是否是厄洛替尼联合抗血管生成药物治疗模式获益的潜在机制?值得进一步探讨。
(3)厄洛替尼联合抗血管生成药物治疗模式获得性耐药的机制仍需明确。厄洛替尼联合抗血管生成药物治疗模式获得性耐药机制对后续治疗影响的重要性不言而喻。RELAY研究及ARTEMIS(CTONG 1509)研究结果一致显示厄洛替尼联合抗血管生成药物耐药后EGFR T790M突变的发生率与厄洛替尼单药相近, 提示联合模式不影响T790M突变的发生, 不影响奥希替尼作为后线治疗的重要保障。此外, ARTEMIS(CTONG 1509)研究发现厄洛替尼单药耐药后出现了更多的突变和扩增, 而联合方案的耐药机制显得更加单纯, 这点差异是否会影响后续治疗的方案选择及疗效, 同样值得关注。
总之, 厄洛替尼联合抗血管生成药物治疗模式为EGFR突变晚期非小细胞肺癌一线治疗增加了新选择, 尤其是厄洛替尼联合贝伐单抗方案, 在国内具有更好的可及性, 可作为EGFR 21外显子突变患者的优先选择。与此同时, 仍然需要进一步探索厄洛替尼联合抗血管生成药物治疗模式存在的一些问题, 才能实现更加精准的治疗。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|