| 赵军,北京大学肿瘤医院胸部肿瘤中心副主任、胸部肿瘤内一科副主任、主任医师、副教授,肿瘤内科教研室主任、新里程肿瘤医院肿瘤内科主任。北京医学奖励基金会肺癌青年专家委员会主任委员,北京肿瘤学会肺癌专委会副主任委员,中国抗癌协会呼吸内镜分会委员,精准医学与肿瘤康复专委会常委,中国老年学会老年肿瘤专业委员会委员,《中国肺癌杂志》青年编委,《肿瘤防治研究》杂志编委,《中国肿瘤临床》杂志审稿专家,《Chinese Journal of Cancer Research》审稿专家。 赵军教授从事肿瘤临床工作近21年,在胸部肿瘤尤其是肺癌的多学科综合治疗上有丰富经验及深厚的学术造诣,擅长肺癌规范化、个体化多学科综合治疗及气管镜、经支气管针吸活检、内科胸腔镜等局部治疗及操作。2011年获教育部科技成果二等奖、北京市科技进步三等奖、中华医学奖三等奖等奖励,2012年获中国抗癌协会科技一等奖,2019年获教育部科学技术进步一等奖。 |
Socinski MA, Jotte RM, Cappuzzo F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC[J]. N Engl J Med, 2018, 378(24): 2288-2301.
1b。
贝伐珠单抗联合含铂化疗是目前晚期非鳞非小细胞肺癌的标准治疗之一。贝伐珠单抗可以通过逆转VEGF介导的免疫抑制, 增加阿特珠单抗活化的T细胞杀伤肿瘤的效应。贝伐珠单抗联合阿特殊单抗有协同抗肿瘤效应。
研究Atezolizumab+贝伐珠单抗+化疗对先前未经治疗的转移性非鳞非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的疗效。
• 研究条件:26个国家240个中心参加的IMpower150临床研究(NCT02366143)。
• 研究类型:多中心, 开放标签, 随机Ⅲ 期临床试验。
• 研究时间:2015-2018年。
研究对象:未曾接受化疗的Ⅳ 期或复发的转移性非鳞NSCLC患者。
• 干预措施:研究共入组了1 202例患者, 随机(1:1:1)分配至:Atezolizumab+卡铂+紫杉醇(ACP组, n=402), 或Atezolizumab+贝伐珠单抗+卡铂+紫杉醇(ABCP组, n=400), 或贝伐珠单抗+卡铂+紫杉醇(BCP组, n=400), 各组患者分别接受4~6个周期的研究方案治疗, 后续分别采用Atezolizumab(ACP组), Atezolizumab +贝伐珠单抗(ABCP组)和贝伐珠单抗(ACP组)进行维持治疗直至疾病进展或接受Atezolizumab不再有临床获益。
• 评价指标:意向性治疗(intention-to treat, ITT)分析 WT(wild-type, WT; 即无EGFR、ALK突变)人群以及效应T细胞(Teff)基因信号高表达的野生型患者的无进展生存期(progression-free survival, PFS)、总生存期(overall survival, OS)、毒性反应等。
共入组晚期NSCLC患者1 202例。中位随访时间为9.5个月。
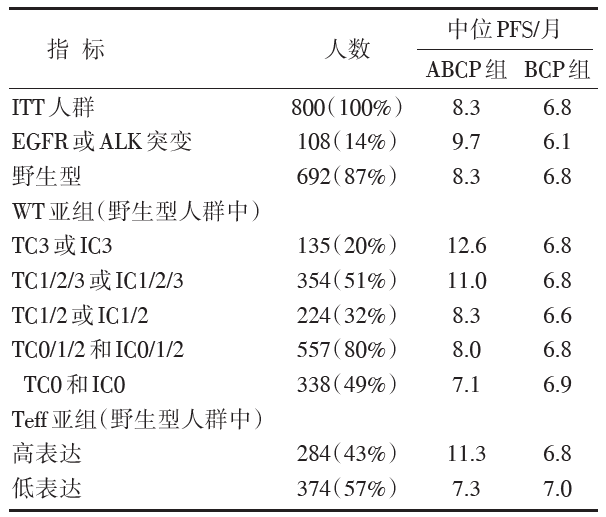
在WT人群中, ABCP组的中位PFS长于BCP组(8.3个月vs. 6.8个月)。疾病进展或死亡危险比0.62, 95%可信区间(confidence interval, CI)为0.52~0.74, P< 0.001)。Teff基因高表达野生型人群中, 两组中位PFS分别为11.3个月和6.8个月(危险度比0.51, 95%CI 0.38~0.68, P< 0.001)。在整个ITT(意向治疗)人群(包括EGFR或ALK突变)和低或阴性PD-L1、Teff基因低表达组和肝转移组, ABCP 组的中位PFS比BCP组更长(见表1)。在ABCP组中, WT人群中患者的中位OS长于BCP组(19.2个月vs. 14.7个月, 死亡的风险比0.78, 95%CI 0.64~0.96, P=0.02)。
| 表1 生物标志物在ABCP组与BCP组间PFS比较 |
与任何治疗相关的不良事件, ABCP组发生率为94.4%, BCP组发生率为95.4%。1或2级不良事件发生率分别为35.9%、45.4%(见表2)。其中, 最常见的3级或4级治疗相关不良事件为中性粒细胞减少症、中性粒细胞数降低、发热性中性粒细胞减少症和高血压。ABCP组皮疹、口腔炎、发热、中性粒细胞减少、咯血的发生率低于BCP组的至少10个百分点。
| 表2 ABCP与BCP两组的不良反应 |
Atezolizumab加入贝伐珠单抗联合化疗治疗转移性非鳞非小细胞肺癌, 可显著延长PFS和OS, 该疗效不受PD-L1表达和EGFR或ALK基因变异状态的影响。
IMpower150研究是一项Ⅲ 期随机临床研究, 旨在探索免疫检查点抑制剂Atezolizumab(阿特珠单抗)+贝伐珠单抗+卡铂+紫杉醇(ABCP)、阿特珠单抗+卡铂+紫杉醇(ACP)与标准治疗方案贝伐珠单抗+卡铂+紫杉醇(BCP)用于未经化疗的转移性非鳞状NSCLC患者的疗效。
研究结果提示, 在标准含铂双药+贝伐珠单抗方案的基础上联合阿特珠单抗可显著改善初治非鳞NSCLC患者的PFS和OS, 且疗效不受PD-L1表达及EGFR、ALK驱动基因状态影响。
(1)设计的合理性。该研究人群选择基于IMpower 131在晚期肺鳞癌患者取得的结果[1], 将目标人群转向非鳞NSCLC, 入组患者时并未限定PD-L1表达及驱动基因状态, 进一步探索了四药联合模式在非鳞NSCLC人群、不同PD-L1表达状态、不同驱动基因状态人群中的疗效。研究还以Teff基因信号表达水平高低分组, 分析两组非鳞NSCLC人群中的免疫治疗反应, 探索将Teff基因信号作为新的生物标志物区分免疫治疗优势性人群的可行性。
(2)结论的可靠性。该研究从方案设计、人群选择、方案执行等均符合研究设计初衷, 严格遵循随机对照临床试验的原则, 研究结论达到统计学假设目标。目前化疗联合贝伐珠单抗已获批用于晚期非鳞NSCLC一线治疗[2, 3]; 阿特珠单抗对比多西紫杉醇用于晚期NSCLC二线及二线以上治疗, 可以显著延长患者的OS[4]。本研究将视角推至晚期非鳞NSCLC的一线联合治疗, 将ABCP组与BCP组的结果对比研究, 通过PFS和OS区别反应治疗效果的差异, 最终得到“ 在标准含铂双药+贝伐珠单抗方案的基础上联合阿特珠单抗可显著改善初治非鳞NSCLC患者的PFS和OS” 这一结论。同时研究中还提出贝伐珠单抗可以通过逆转VEGF介导的免疫抑制, 增加阿特珠单抗活化的T细胞杀伤肿瘤的效应。对贝伐珠单抗联合阿特珠单抗有协同抗肿瘤效应[1]。
研究中根据驱动基因状态、免疫相关基因表达将人群进行分组, 将性别、PD-L1表达水平和是否合并肝转移作为分层因素, 通过不同分组、分层分别验证上述结论, 均得到了一致的结果。此项研究最大的特点在于入组了一部分EGFR+/ALK+的患者, 多个临床试验和Meta分析都显示免疫单药用于经治EGFR突变人群的获益有限[5, 6, 7], 亦有小样本研究报道PD-L1 高表达伴EGFR突变患者能从免疫治疗中获益[8]。对于这部分患者, 本研究发现对于EGFR/ALK突变人群单用免疫治疗效果并不理想, 但叠加抗血管生成治疗以及化疗可以使这一类患者获益, 提示这一新的治疗模式可能为TKI治疗耐药后提供新的治疗选择。
(3)尚存的不足:①IMpower150研究结果显示, 贝伐珠单抗联合阿特珠单抗联合化疗这一组患者的疗效相较另两组优势明显, 似乎抗血管生成药物贝伐珠单抗在调节免疫微环境、增强免疫治疗疗效中起到了关键作用, 但目前类似的临床试验结果有限, 仍需更多的临床数据及实验室的基础机制研究支持。②本研究中对于驱动基因阳性人群的分析只是探索性的事后分析, 就这一特殊人群而言, 这并不是严格的随机对照试验, 每组的样本量有限, 患者基线不会完全均衡, 没有针对该人群的统计学假设, 因而证据级别有限。③该研究中未能指出驱动基因阳性人群TKI耐药后的基因状态, 关于不同耐药因素对免疫联合治疗的结果是否存在影响, 需要进一步的研究予以探索。④由于免疫治疗发挥疗效机制复杂, 目前尚无单一、高效的生物标志物来很好地预测免疫治疗的疗效, 本研究探索将PD-L1和Teff作为生物标志物来观察其表达状态与疗效的关系, 虽结果显示在不同PD-L1的表达状态下四药联合的模式均可见到优势, 但并未展示同样治疗模式下不同表达水平的疗效差异状态, 且未展示Teff作为生物标志物相较于PD-L1是否存在预测优势。
(4)临床实践中应注意的问题。①虽然联合阿特珠单抗带来了生存获益, 但获益有限, 联合方案在我国是否符合卫生经济学评价原则, 需要综合考量。②联合阿特珠单抗治疗组, 57%的患者出现了3~4度不良反应, 这提示在实际应用这一治疗方案时, 需要充分关注患者的基线体能状态和合并疾病情况, 评估可能的获益及潜在风险, 谨慎作出选择。③本研究提示PD-L1的表达水平可能不能预测免疫治疗的疗效, 是否存在其他与疗效及不良反应相关分子标志物, 还有待临床实践中继续摸索。④本研究中采用的含铂双药方案为紫杉醇联合卡铂, 临床实践中的可选择的化疗方案还有很多, 同样地, 已经上市的免疫检查点抑制剂种类繁多, 是否能够替代该治疗方案, 取得同样的效果和安全性数据, 也有待后续进一步探索。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|