作者简介:
黄兹锐(1994-),男,广东阳江人,硕士研究生,从事先天性心脏病基础研究。
目的 肺动脉狭窄是一种常见的先天性心脏病亚型,采用生物材料扩张肺动脉是目前治疗手段之一。含有细胞的生物材料治疗效果最佳,但制备生物材料的肺动脉平滑肌细胞来源是目前亟待解决的问题。本研究采用化学因子诱导方法,探索人胚胎干细胞(human embryonic stem cell,hESC)向肺动脉平滑肌细胞分化的能力。方法 常规培养hESC细胞系H9,当细胞融合度为10%时,分别加入侧板中胚层(lateral mesoderm,LM)和神经外胚层(neural ectoderm,NE)的定向分化诱导剂。通过real-time PCR、Western blot、细胞免疫荧光检测对这些诱导分化而来的细胞进行鉴定并检测其向血管平滑肌细胞(vascular smooth muscle cell,VSMC)分化的能力。结果 H9细胞呈克隆样生长,SOX2、OCT4、NANOG均为阳性表达。经诱导分化后,与对照组相比,ISL-1、NKX2.5、KDR(LM的标志基因),Nesting、PAX6、GBX2(NE细胞的标志基因)表达上调, 而hESC的标志基因SOX-2、OCT-4和NANOG表达下调。这两种细胞能进一步分化成α-SMA、CNN1、MYH11、TAGLN、SMTN-A表达阳性的VSMC。结论 特定的分化条件能诱导hESC向肺动脉平滑肌样细胞分化。
Objective Pulmonary stenosis (PS) is one of the most common subtypes of congenital heart disease. Using bioengineered tissue materials to expand the pulmonary artery is one of the current treatments for PS. Cell-coating biomaterials have the best therapeutic effect, but it's a critical problem that the source of pulmonary artery smooth muscle cells for bioengineering tissue is rare. In this study, chemical factor induction methods were used to explore the ability of human embryonic stem cells (hESC) differentiating into pulmonary artery smooth muscle cells.Methods hESC line H9 was culture and changed to lateral mesoderm (LM) and neural ectoderm (NE) inducing medium respectively when the cell confluent reached to 10%. Real-time PCR, Western blot, and cellular immunofluorescence were used to detect the ability of H9 to differentiate into vascular smooth muscle cells (VSMC).Results H9 cells grew in a clone-like manner, SOX2, OCT4, and NANOG were all positively expressed. The expressions of ISL-1, NKX2.5, KDR (marker genes of LM), Nesting, PAX6, GBX2 (marker genes of NE cells) were up-regulated while the hESC marker gene SOX-2, OCT-4 expressions were down-regulated after induction compared with control group. These two type of cells can further differentiate into VSMCs with α-SMA, CNN1, MYH11, TAGLN, and SMTN-A positive.Conclusion hESC can differentiate into pulmonary artery smooth muscle like cells under specific inducing condition.
肺动脉狭窄(pulmonary stenosis, PS)是一种常见的先天性心脏病(congenital heart defects, CHD), 可因遗传或环境因素在胚胎发育的前三个月引起。据统计, 全球范围内, PS的发病率排在各种CHD中的第四位, 约占所有CHD的6.2%[1]。PS可单独发生, 也可合并其他先天性心脏大血管发育不良。PS的临床表现可轻可重, 轻者终生无需治疗, 重者出生后即可出现严重的临床症状, 甚至威胁生命[2]。目前, PS的治疗方式主要为介入治疗和外科手术治疗[3], 心脏外科手术所用补片一般为自体心包或牛心包、Goretex补片等异体材料[4, 5, 6, 7]。然而, 目前所有的补片都存在一个共同的缺点, 不具有生长潜能。由于接受PS手术的患者多处于婴幼儿时期, 无生长潜能的补片可能随着患儿的生长发育于肺动脉形成再次狭窄。制备具有生长潜能的组织工程肺动脉补片则成为本研究领域的一个难点和热点问题, 而种子细胞的来源则是首先要解决的问题, 在体外培养得到具有肺动脉特征的平滑肌细胞鲜有研究报道。
人体不同部位血管平滑肌细胞(vascular smooth muscle cell, VSMC)来源于胚胎发育早期三个不同的胚层, 包括神经外胚层(neural ectoderm, NE)、侧板中胚层(lateral mesoderm, LM)和轴旁中胚层[8]。在心脏发育过程中, 来源于NE的心脏神经嵴细胞和来源于LM的前第二生心区的细胞会形成肺动脉主干[9]。人胚胎干细胞(human embryonic stem cell, hESC) 具有分化全能性, 可在体外诱导分化为多种细胞或组织, 近年来已成为组织工程领域的研究热点[10, 11, 12]。但是, 关于hESC作为种子细胞诱导分化为VSMC的方法尚无统一的标准, 目前的各种分化方案均存在一定缺陷。本研究旨在改良肺动脉样VSMC的诱导分化方法, 为肺动脉生物补片的种子细胞来源提供新的途径。
人胚胎干细胞H9(北京赛贝生物技术有限公司), PSCeasy® 人多潜能干细胞复苏培养基(北京赛贝生物技术有限公司), PSCeasy® 人多潜能干细胞完全培养基(北京赛贝生物技术有限公司), PSCeasy® 人多潜能干细胞消化液(北京赛贝生物技术有限公司), Growth-Factor-Reduced Matrigel(美国Corning公司), 0.1% Gelatin(美国Gibco公司), 0.25%胰酶(美国Thermo Fisher Scientific公司), DMEM/F12(1:1)(美国Gibco公司), B27 Supplement(50× )(美国Gibco公司), N2 Supplement(100× )(美国Gibco公司), Human bFGF(美国Gibco公司), Human BMP4(美国PeproTech公司), LY294002(美国Selleck公司), SB431542(美国Selleck公司), Human PDGD-bb(美国PeproTech公司), Human TGF-β 1(美国PeproTech公司), 逆转录试剂盒(日本Takara公司), 蛋白质印迹法相关试剂(上海碧云天生物技术有限公司), 6孔板、T-25瓶(美国Corning公司), 小鼠抗SOX2(美国Abcam公司), 小鼠抗OCT4(美国Abcam公司), 小鼠抗NANOG(美国Abcam公司), 兔抗α -SMA(美国Abcam公司), 山羊抗兔二抗(美国Abcam公司), 山羊抗鼠二抗(美国Abcam公司)。
1.2.1 H9细胞培养和鉴定
复苏H9细胞用PSCeasy® 人多潜能干细胞复苏培养基接种于Growth-Factor-Reduced Matrige包被的细胞培养瓶, 常规置于5% CO2的37℃恒温细胞培养箱中。48 h后更换为PSCeasy® 人多潜能干细胞完全培养基培养, 每24小时换液。待H9呈克隆样增长至80%时进行传代。观察细胞形态并采用免疫荧光鉴定H9的标志蛋白SOX2、OCT4和NANOG的表达情况。
1.2.2 H9向两种血管平滑肌细胞的分化
配制分化液(每50 mL)。LM细胞分化液①:48.5 mL DMEM/F12, 1 mL B27, 0.5 ml N2, 20 ng/mL bFGF, 10 μ M LY294002, 10 ng/mL BMP4。LM细胞分化液②:48.5 mL DMEM/F12, 1 mL B27, 0.5 mL N2, 20 ng/mL bFGF, 50 ng/mL BMP4。NE细胞分化液:48.5 mL DMEM/F12, 1 mL B27, 0.5 mL N2, 12 ng/mL bFGF, 10 μ M SB43142。VSMC分化液:48.5 mL DMEM/F12, 1 mL B27, 0.5 mL N2, 10 ng/mL PDGF-bb, 2 ng/mL TGF-β 1。
LM细胞的诱导分化:H9生长汇合度至10%时开始加入LM细胞分化液①, 36小时后换液, 加入LM细胞分化液②。每两天半量换液, 共诱导分化5天。
NE细胞的诱导分化:H9生长汇合度至10%时开始加入NE细胞分化液, 每两天半量换液, 共诱导分化7天。
VSMC的诱导分化:LM细胞及NE细胞传代后置于0.1%明胶溶液包被好的6孔板中, 加入VSMC分化培养基, 每两天半量换液, 共诱导分化6天。
1.2.3 Real-time PCR检测LM细胞、NE细胞、VSMC特异性基因相对表达
按照上述方案诱导分化两种平滑肌, 分别取H9细胞样品、LM细胞样品、NE细胞样品、分化时间为3天和6天两个时间点的VSMC样品, Trizol法提取总RNA, Real-time PCR分别检测LM细胞ISL-1、NKX2.5、KDR基因的相对表达, NE细胞Nesting、PAX6、GBX2基因的相对表达, LM和NE细胞SOX-2、OCT-4、NANOG基因的相对表达, VSMC α -SMA、CNN1、TAGLN、MYH11、SMTN-A基因的相对表达。GAPDH作为内参基因。引物序列见表1。
| 表1 PCR引物序列 |
1.2.4 Western blot检测VSMC特异性蛋白
收集两种VSMC分化时间为3天和6天的细胞样品, 使用RIPA裂解液和蛋白免疫制剂PMSF提取蛋白, 应用BCA方法检测蛋白含量。蛋白变性后每孔上样30 μ g, 10% SDS-聚丙烯酰胺凝胶进行分离电泳, 然后转印到PVDF膜上。含5%脱脂奶粉的TBST缓冲液封闭45分钟。洗涤PVDF膜3次, 每次5分钟。加入一抗α -SMA(1:400)和内参GAPDH(1:1000), 4℃摇晃过夜。洗膜。山羊抗兔二抗室温孵育1小时, 洗膜3次, 每次5分钟。最后暗室中ECL化学发光显色, 全自动凝胶成像分析仪显影。
1.2.5 细胞免疫荧光检测
贴壁生长的细胞用PBS洗涤三次, 4%多聚甲醛室温固定15分钟。PBS浸洗3次, 每次5分钟。0.2% Triton X-100(PBS配制)室温通透20分钟。4%BSA(0.2% Triton X-100-PBS配制)室温封闭30分钟。分别加一抗SOX-2(1:100)、OCT-4(1:100)和NANOG(1:100), α -SMA(1:100), 4℃过夜孵育。除去一抗, PBS洗3次, 每次5分钟。加荧光二抗(1:500), 室温避光孵育45分钟。除去二抗, PBS洗3次, 每次5分钟。滴加含DAPI的封片剂, 封片, 共聚焦显微镜采集图像。
1.2.6 统计学方法
实验均重复三次, 数据以均数 ± 标准差表示, 运用SPSS 19.0统计学软件采用成对设计的两样本均数比较(配对样本t检验), P< 0.05认为差异有统计学意义。
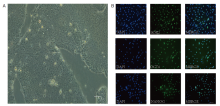
相差显微镜观察H9细胞, 细胞生长良好, 大小和形态大致一致, 呈圆形或卵圆形, 细胞核大, 胞浆少, 呈集落状生长, 连接紧密, 彼此界限不清, 细胞克隆与周围存在明显界限(见图1A)。细胞免疫荧光显示H9细胞SOX-2、OCT-4和NANOG均高表达(见图1B)。
在诱导分化过程中, 原先集落样生长的胚胎干细胞形态发生改变, 细胞由圆形变为梭形, 开始是在集落的边缘向外生长, 随着诱导时间的加长, 细胞不再聚集成团, 向周围散在生长, 呈多形性(见图2)。
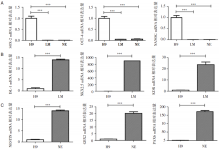
RT-PCR结果显示, 在向LM和NE诱导分化的两种细胞中, 干细胞标志物SOX-2、OCT-4和NANOG明显下调, 向LM诱导分化的细胞ISL-1、NKX2.5和KDR表达上调, 向NE诱导分化的细胞NESTIN、PAX6、GBX2表达上调(见图3)。
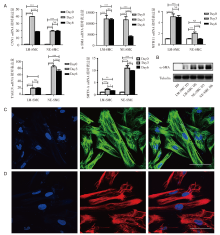
Real-time PCR结果显示, CNN1、α -SMA、MYH11、TAGLN和SMTN-A等平滑肌标志物在两种诱导得到的平滑肌细胞中均有表达上升(见图4A)。Western blot结果表明, α -SMA蛋白在H9细胞中不表达, 在LM-SMC和NE-SMC中均高表达, 分化第六天的平滑肌α -SMA蛋白表达量比分化第三天的相对较高(见图4B)。细胞免疫荧光结果显示, 分化第六天的外胚层来源平滑肌细胞(NE-SMC Day6)和中胚层来源平滑肌细胞(LM-SMC Day6)均高表达α -SMA蛋白(见图4C和图4D)。
在本实验中, LM细胞和NE细胞分化为VSMC的时间为六天。细胞培养过程中观察到, 在两种细胞分化的前六天, 细胞生长分化良好。约在六天之后, 细胞逐渐死亡。分化第三天和第六天的两种平滑肌细胞均高表达平滑肌标志物的mRNA, 但部分mRNA相对表达量在第六天时低于第三天, 存在mRNA与蛋白表达不同步的现象。结合Western blot第六天α -SMA蛋白的表达量高于第三天的结果可知, LM和NE细胞在分化六天后可得到最成熟的VSMC。而在六天之后, 该分化体系已经不再适合成熟VSMC的维持培养, 因此细胞会逐渐死亡。
目前国内外关于ESC向VSMC诱导分化的研究较少。Christine Cheung等学者采用Ham's F12、IMDM作为基础培养液, 化学成分确定的脂质浓缩物、硫代甘油、转铁蛋白、胰岛素、牛血清白蛋白和聚乙烯醇作为基础添加剂, LY294002、FGF2、BMP4、SB431542、PDGF-BB、TGF-β 1作为诱导因子, 诱导hESC向肺动脉的两种VSMC分化[13]。我们预实验采用上述方法进行诱导分化, 细胞在2~3天后开始死亡, 培养得到的LM细胞和NE细胞数量极少且生长缓慢, 无法进行后续实验。最初, 我们推测有可能是某种细胞分化因子浓度过高, 抑制细胞生长。在后续实验中, 我们分别将每种细胞因子的浓度减半, 但LM细胞和NE细胞依旧生长缓慢, 并在培养过程中出现死亡。我们继续对基础培养基和硫代甘油、聚乙烯醇等基础添加剂进行一一排查, 分别剔除其中一种添加剂或更换基础培养液配成新的培养液, 然而依旧无法培养得到足够量的细胞。试验结果表明这种培养体系中存在某种细胞毒性物质的可能性较小, 与我们最初的设想不符, 由此我们推测可能是这种基础培养体系的整体营养成分不适合H9细胞株的定向分化。由于DMEM/F12培养基适用于一些较难养的细胞系的培养, 并且具有丰富的营养物质, 因此我们采用该培养基作为基础培养基。
本实验结果显示在这种诱导体系下能获得肺动脉中两种类型的VSMC。
LY294002是磷酸肌醇3激酶的抑制剂, 作用是抑制hESC的自我更新能力, 促进细胞分化[14]。FGF2、BMP4是MAPK、SMAD信号通路成员, 作用是促进干细胞向中胚层细胞分化[15]。PDGF-BB 和TGF-β 1的作用是促进VSMC的分化与增殖[8, 16, 17]。在上述信号通路的综合作用下, 激活诱导了hESC向LM-SMC和NE-SMC的分化, 但这种诱导体系的优化及其具体机制尚待进一步研究。
综上, 本实验采用多个信号通路诱导因子作用于hESC获得不同细胞特性的VSMC。两种VSMC的分化时间分别为11天和13天, 但其功能尚需进一步验证。本研究探索了hESC在体外诱导为肺动脉样VSMC的能力, 为肺动脉血管补片的种子细胞来源提供一个可能的途径。有望通过这种方法制备既具有生长潜能, 在组成成分上又能最大程度贴近人体肺动脉血管的肺动脉补片, 具有进一步开发的价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|