作者简介:
冯会博(1994-),女,河南郑州人,硕士研究生,主要研究方向为肺癌靶向治疗。
目的 探讨晚期肺腺癌中Kirsten大鼠肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene, KRAS) G12C、G12V、G12D等突变亚型的预后及与肿瘤细胞程序性死亡受体配体1 (programmed death ligand 1, PD-L1)表达的相关性。方法 回顾性分析晚期 KRAS突变肺腺癌患者的临床资料,采用二代测序等方法检测 KRAS突变亚型,免疫组织化学方法检测PD-L1(Dako公司22C3和罗氏公司 SP142)的表达。卡方检验分析 KRAS突变亚型与PD-L1的关系并结合临床资料进行生存分析。结果 在91例患者中, KRAS G12C突变30例(33.0%),G12D突变19例(20.9%),G12V突变14例(15.4%),其他类型突变28例(30.8%)。 KRAS G12C、G12D和G12V突变PD-L1表达≥1%分别占86.7%、44.4%和50.0%,卡方检验结果显示 KRAS G12C突变PD-L1的表达水平较其他突变亚型的表达水平高( P=0.026); KRAS G12C突变与 KRAS G12D突变相比,PD-L1表达水平较高( P=0.028)。生存分析结果显示, KRAS G12C,G12D和G12V突变的中位生存时间分别为10.0个月、11.2个月和14.7个月,差异无统计学意义( P=0.267)。结论 KRAS基因主要突变亚型之间的预后无明显差异。 KRAS G12C突变亚型肿瘤细胞PD-L1的表达水平较高,其临床免疫治疗的预测意义需进一步研究。
Objective This study aims to explore the prognostic role of mutation subtypes of Kirsten rat sarcoma viral oncogene ( KRAS) in advanced lung adenocarcinoma and their relation with expression level of programmed death ligand 1 (PD-L1).Methods We retrospectively collected tumor specimens of 91 advanced KRAS-mutant lung adenocarcinoma. Next-generation sequencing was employed to detect the genomic alterations of cancer related genes and immunohistochemistry was applied to determine the expression level of PD-L1. Clinical and survival data were collected for Kaplan-Meier analysis.Result KRAS G12C, G12D, G12V and other mutations made up 33.0%, 20.9%, 15.4% and 30.8% of all patients respectively. Positivity of expression of PD-L1 ≥1% were 86.7%, 44.4% and 50.0% respectively in KRAS G12C, G12D and G12V subgroups. Positive ratio of PD-L1 ≥1% in KRAS G12C is higher than KRAS G12D tumors ( P=0.028).Conclusion Mutation subtypes of KRAS were not prognostic of survival in KRAS mutant patients with NSCLC. Yet expression of PD-L1 was higher in KRAS G12C versus other mutation subtypes, which needs further investigation for its potential predictive role for immune therapy.
肺癌是我国发病率和死亡率最高的恶性肿瘤, 常见的驱动基因有EGFR、ALK、KRAS等。KRAS突变在肺腺癌和肺鳞癌的发生率分别为7.2%~8.0%和5.0%[1]。目前EGFR突变和ALK突变的肺癌人群靶向治疗已发展到第三代药物, 与化疗相比, 靶向治疗可显著延长患者的生存时间, 提高患者的生存质量。但近30年来, 由于KRAS蛋白难以结合, 至今未研制出有效的针对KRAS突变的靶向药, KRAS突变患者的标准治疗模式仍为含铂双药化疗, 患者的预后相对较差[2]。KRAS G12C靶向药AMG510 的Ⅰ 期临床试验结果显示, 对于二线治疗后的患者, 一半以上获得部分缓解(partial response, PR), 填补了KRAS靶向治疗的空白。KRAS其它突变位点的研究尚无进展。现有研究发现, KRAS共突变基因与治疗疗效和生存时间相关, 伴随STK11突变的KRAS突变肺癌患者预后不佳。同时, PD-L1的表达水平与共突变基因之间存在一定的联系。KRAS不同突变亚型的GTPase活性存在差异, 说明KRAS不同突变亚型的生物学功能不同[3]。因此, 有必要探讨KRAS不同突变亚型PD-L1的表达水平及其与预后之间的关系。目前, KRAS突变不同亚型的预后意义尚不明确, 本研究分析了晚期KRAS突变肺腺癌的突变亚型与PD-L1的表达水平之间的关系, 及不同突变亚型与预后之间的关系。
本研究经伦理委员会批准, 收集2016年1 月至2019年10月广东省人民医院初诊为晚期KRAS突变肺腺癌患者109例, 排除含有EGFR、ALK、ROS1突变的患者18例, 所有患者或家属已知情同意并签署知情同意书。从病历系统获取患者的性别、年龄、病理、分期等基本资料。
总生存时间定义为从确诊肺癌时间至死亡或最后一次随访时间。随访截止时间为2020年3月31日。
PD-L1蛋白表达水平的检测采用Dako公司22C3抗体和罗氏公司 SP142抗体。
使用燃石二代测序(next-generation sequencing, NGS)(520 panel)检测肿瘤组织的基因突变状态。
采用 SPSS 25统计软件包进行数据分析。生存分析用 Kaplan-Meier 法并以Log-rank进行组间检验; 使用Cox比例风险模型进行多因素生存预后相关因子分析; 组间比较使用卡方检验。P< 0.05被认为差异有统计学意义。
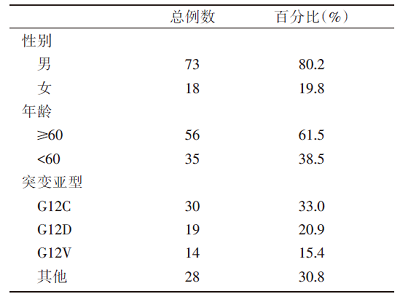
91例晚期KRAS突变肺腺癌患者中, 男性73例, 女性18例; 年龄35.2岁~82.4岁, 平均年龄(62.9± 8.5)岁, 见表1。
| 表1 KRAS突变患者的临床特征和突变亚型 |
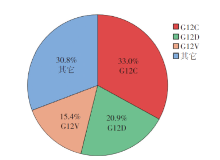
KRAS突变主要发生在第12、13和61密码子, 有G12C、G12D、G12V、G13C、G13D、Q61H等突变亚型, 其中G12C、G12D和G12V的突变率较高, 分别为33.0%、20.9%和15.4%, 见图1。
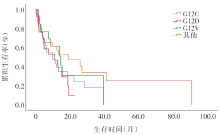
KRAS突变亚型的生存分析Log-rank检验结果如图2所示, KRAS G12C、G12D和G12V 的中位生存时间分别为10.0个月、11.2个月和 14.7个月, 差异无统计学意义(P=0.267)。
多因素分析结果显示, 性别和年龄不是影响预后的因素(P=0.985, P=0.962)。
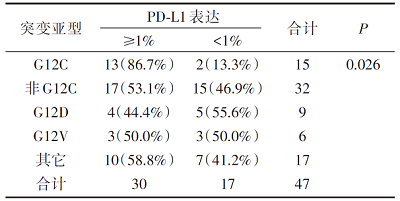
KRAS突变肺腺癌患者PD-L1表达≥ 1%占63.8%, 其中KRAS G12C突变患者PD-L1表达水平相对较高(P=0.026), PD-L1表达≥ 1%占86.7%。KRAS G12D和G12V突变患者PD-L1表达≥ 1%分别占44.4%和50.0%, 差异无统计学意义, 见表2。
RAS是第一个被发现的人类促癌基因, 分为HRAS、KRAS和NRAS三个成员。KRAS位于12号染色体上, 编码P21蛋白, 常见的突变主要发生在12、13和61号密码子。KRAS突变后损害了其内在的GTPase活性, 并对GAP产生抗性, 从而导致KRAS持续处于与GTP结合活性状态, 维持KRAS信号通路的激活状态。 KRAS蛋白位于EGFR下游, 参与了MAPK、PIK3CA、STAT3等复杂的信号通路, 在肿瘤的生长、分化和转移等起到了重要的作用[4]。
| 表2 晚期KRAS突变肺腺癌PD-L1的表达 |
本研究中, 晚期KRAS G12C、G12D和G12V突变肺腺癌的发生率分别为36.9%、19.2%和15.4%, 中位生存时间分别为10.0个月、11.2个月和 14.7个月, 差异无统计学意义。KRAS突变亚型与预后之间的关系在既往研究中结果不一致。Jü rgen Wolf的研究结果显示, KRAS突变不同亚型的预后没有统计学差异, 与本研究一致[5]。Min Li的研究发现KRAS G12D突变的患者无进展生存期和总生存期均比KRAS G12C 突变和KRAS G12V突变的患者差[6]。
在晚期KRAS突变肺腺癌的不同突变亚型的PD-L1表达水平上, 本研究结果显示KRAS G12C突变患者PD-L1≥ 1%水平相对较高, 但各突变亚型之间差异无统计学意义。研究发现KRAS突变肺癌的PD-L1表达水平比KRAS野生型水平高。亚组分析显示, 合并STK11突变的KRAS突变肺癌患者PD-L1水平较合并TP53突变患者低[7], 并且合并STK11突变的患者免疫治疗疗效相对较差[8], 但对KRAS不同突变亚型PD-L1水平尚未研究。
美国纪念斯隆凯特琳癌症中心的研究, 首次根据KRAS突变肺癌患者的基因谱、转录谱和蛋白谱综合分析, 将KRAS突变分为KP (TP53和KRAS共突变)、KC(CDKN2A/B和KRAS共突变)和 KL (STK11/LKB1和KRAS共突变)三个亚组[9]。三个亚组具有独特的生物学功能, 为进一步指导免疫治疗提供了理论基础。Jü rgen Wolf的研究发现, KRAS G12C突变常合并ERBB2扩增和ERBB4突变, KRAS G12D突变常伴随PDGFRA突变, G12V常伴随PTEN突变。这对KRAS突变肺癌进一步的亚组分析提供了依据。
近年来, 免疫治疗在KRAS突变肺癌中取得了较好的疗效, 这使得KRAS从单一的含铂双药化疗进入一个全新的时代。对中国肺癌人群基因谱和免疫表达谱的研究发现, KRAS突变肺腺癌患者T细胞浸润水平较其他驱动基因突变高[10]。KRAS共突变的亚组分析提示, 合并STK11突变的患者其预后较其它共突变基因差[11, 12, 13], 因此, 进一步分析KRAS突变肺腺癌的基因谱与免疫表达谱有利于为免疫治疗选择最优人群。
综上, 本研究初步探索了KRAS基因不同突变亚型晚期肺腺癌的预后, 未发现与预后明显相关的突变亚型。我们发现PD-L1的表达水平在KRAS基因不同突变亚型之间存在差异, KRAS突变肺癌患者治疗疗效是否会受到不同突变亚型及PD-L1表达水平的影响有待进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|