| 邹立群,医学博士、主任医师、教授、博士生导师,四川大学华西医院肿瘤中心淋巴瘤专业学术带头人。毕业于华西医科大学,2001~2004年在美国哈佛大学医学院进行博士后研究,2014年美国华盛顿大学Fred⁃Hunchiton 肿瘤中心访问学者。任中华医学会肿瘤内科专业委员会肿瘤学分会肿瘤转化医学组副组长,四川省卫生健康委员会学术技术带头人,四川省抗癌协会淋巴瘤专业委员会主任委员,中国老年保健协会淋巴瘤专业委员会常务委员,中国抗癌协会淋巴瘤专业委员会委员,四川省免疫学会肿瘤专业委员会常务委员。 作为负责人主持包括国家自然科学基金、国家863计划项目、重大新药创制等多项课题。发表论文60多篇,其中SCI论文50多篇。 |
Horwitz S, O'Connor OA, Pro B, et al. Brentuximab Vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): A global, double-blind, randomised, phase 3 trial[J]. Lancet, 2019, 393(10168):229-240.
1b。
外周T细胞淋巴瘤(peripheral T cell lymphoma, PTCL)是一组异质性明显的疾病, 常见PTCL亚型包括外周T细胞淋巴瘤非特指型(peripheral T-cell lymphoma not otherwise specified, PTCL NOS)、血管免疫母细胞性淋巴瘤(angioimmunoblastic T-cell lymphoma, AITL)、ALK阳性/阴性的间变性大细胞淋巴瘤[anaplastic lymphoma kinase (ALK)-positive or ALK-negative systemic anaplastic large cell lymphoma, ALK+/ALK-ALCL]。目前PTCL一线治疗无标准方案, 多年来采用CHOP(环磷酰胺Cyclophosphamide, 阿霉素Doxorubicin, 长春新碱Vincristine, 泼尼松Prednisone)或CHOP样方案治疗, 疗效较差, 患者生存时间短。
CD30不同程度的表达于PTCL亚型中, 最常见于ALCL, 在ALCL病理机理中扮演重要角色。Brentuximab Vedotin(BV)是一种抗CD30抗体偶联药物(antibody-drug conjugate, ADC), 抗CD30单克隆抗体通过可断裂的蛋白酶连接体偶联破坏微管的细胞毒素(microtubule disrupting drug monomethyl auristatin E, MMAE), 在与肿瘤细胞表面的CD30抗原结合后, 释放MMAE, 发挥抗肿瘤作用。
Ⅰ 期临床试验A+CHP(Brentuximab Vedotin, Cyclophosphamide, Doxorubicin, Prednisone)在PTCL中显示出的较高CR率, 显著提高的5年PFS和OS, 可控的毒副反应, 为开展Ⅱ 期临床试验进行头对头比较A+CHP方案与CHOP方案在初治CD30阳性PTCL患者中的有效性和安全性提供了依据。
比较A+CHP方案与CHOP方案在初治CD30阳性PTCL患者中的有效性和安全性。
• 研究单位:参与的132家医院来自南美洲、欧洲、亚太平洋、中东地区的17个国家(NCT01777152)。
• 研究方法:全球多中心、双盲、双模拟、随机、安慰剂对照、活性药物对照的Ⅲ 期临床研究。
• 入组起止时间:2013年1月24日至2016年11月7日。
• 研究对象:
入组标准:年龄≥ 18岁; 初治的CD30表达阳性(≥ 10%细胞)的PTCL中的7个亚型:IPI≥ 2分的ALK+ ALCL、ALK- ALCL、PTCL NOS、AITL、成人T细胞白血病/淋巴瘤(adult T-cell leukemia/lymphoma, ATLL)、肠病相关的T细胞淋巴瘤(enteropathy associated T-cell lymphoma, EATL)、肝脾T细胞淋巴瘤。
重要的排除标准:既往有其他侵袭性肿瘤或血液恶性肿瘤病史; 既往接受过Brentuximab Vedotin治疗。
• 干预措施:研究对象随机分配至A+CHP组或CHOP组, 治疗6~8周期。具体流程见图1。疗效评价采用的Cheson修订的淋巴瘤疗效标准, PET-CT在初筛、治疗后4周期、治疗结束后完善; 随访的第9、12、15、18、21和24个月采用CT扫描, 随后每6个月随访一次直到疾病进展、死亡或分析主要终点。
• 评价指标:主要研究终点为无进展生存期(progression-free survival, PFS); PFS定义:从随机化入组开始至第一次记录的疾病复发/进展/任何原因的死亡/接受其他的系统性化疗的时间, 允许患者后续行放疗/造血干细胞移植作为巩固治疗; 次要终点是系统性间变大细胞淋巴瘤的PFS, 完全缓解(complete response, CR)率, 总生存期(overall survival, OS), 客观有效率(objective response rate, ORR); 上述指标均由设盲独立中心审查机构进行评价。
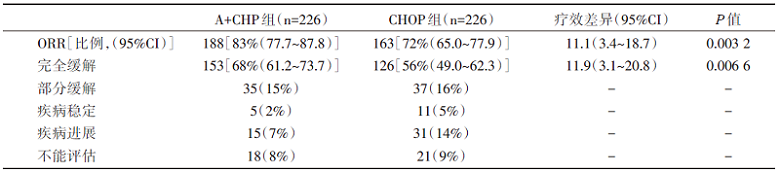
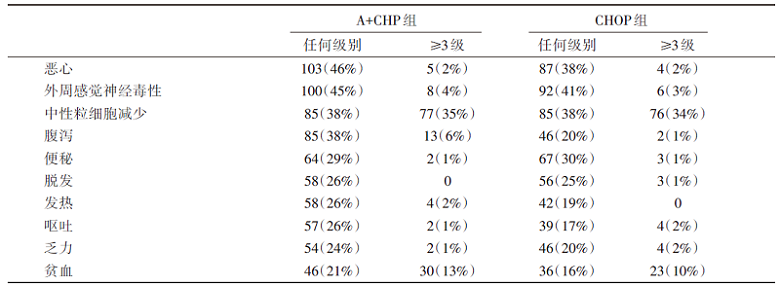
从2013年1月24日至2016年11月7日, 共筛选601例患者, 其中入组的452例随机分配至A+CHP组(n=226)或CHOP组(n=226)。中位随访36.2个月, A+CHP组中位PFS明显长于CHOP组, 48.2个月 vs. 20.8个月; A+CHP组3年PFS是57.1%(49.9%~63.7%), CHOP组为44.4%(37.6%~50.9%); 中位OS未达到; 研究的重要终点结局见表1。在毒副反应方面, A+CHP组3级及以上不良事件发生率与CHOP组相似(66% vs. 65%), 安全性结局见表2。
| 表1 ECHELON-2研究主要结局 |
| 表2 ECHELON-2研究的常见不良反应 |
对比一线CHOP方案, A+CHP方案治疗初治CD30阳性的PTCL能够显著延长中位PFS; 中位OS虽未达到, A+CHP组延长的趋势明显; 且毒副反应可控。
外周T细胞淋巴瘤占非霍奇金淋巴瘤的10%~15%[1], 是一组高度异质性的疾病, 多年来一直缺乏能够改善PTCL预后的前瞻性、随机对照的临床试验。德国DSHNHL研究[2], 首次证实CHOP+依托泊苷较CHOP方案能够提高3年无事件生存期(event free survival, EFS), 75.4% vs. 51%, 这种优势仅体现在年龄≤ 60岁且LDH(乳酸脱氢酶)正常的患者和 ALK+ ALCL亚型, 而ALK- ALCL, PTCL NOS和AITL亚型虽有EFS延长趋势, 但无统计学差异。北欧淋巴瘤协作组通过回顾性研究[3]瑞典和丹麦的122例ALK+ALCL病例, 显示CHOEP较CHOP方案能使41~65岁年龄段患者的死亡风险下降62%。
强化传统的化疗方案, 如Hyper-CVAD, Hyper-CHOP, 与CHOP方案对比3年OS相似(62% vs. 52%), 无统计学差异[4]; Hyper-CVAD/MA较CHOP/CHOEP方案有更高的ORR和CRR, 但3年PFS(53% vs. 32%)和3年OS(55% vs. 49%)并无统计学差异[5]; 而DA-EPOCH较CHOEP提高了ALK- ALCL患者3年EFS(45.7% vs. 63%)[6]。PTCL发病的中位年龄60岁, 使得CHOEP方案获益人群相对少, 不能为这部分患者带来EFS和OS改善; Hyper-CVAD和DA-EPOCH方案虽有ORR提升, 但毒副反应较大, 因此对于> 60岁PTCL患者CHOP方案仍然是首选。
ECHELON-2研究是头对头比较A+CHP与CHOP治疗PTCL的全球多中心、前瞻性、双盲、随机化的Ⅲ 期临床试验, 也是第一个经过前瞻性研究证实的对比一线传统CHOP方案能够延长PFS和OS的临床试验, 具有里程碑式的意义。该研究纳入452例初治PTCL患者, 按照1:1随机分配至A+CHP组或CHOP组, 中位随访36.2个月, A+CHP组降低PFS事件风险29%, 死亡风险下降34%, 3年OS 达77%。值得注意的是, A+CHP较CHOP方案改善预后的同时, 并未增加治疗相关毒副反应。尽管A+CHP组周围神经毒性的缓解时间长于CHOP组(17w vs. 11.4w), 但周围神经毒性的发生比例和严重程度两组间均无差异。此外, 临床应用还需要关注A+CHP方案的腹泻、呕吐等消化道毒性。
PTCL肿瘤细胞中CD30的表达程度有差异, ALCL 100%表达, PTCL NOS 58%~64%, AITL 63%~75%, ATLL 0%~55%, EATL 0%~100%[7]; ECHELON-2研究中仅纳入≥ 10%肿瘤细胞表达CD30的ALCL、PTCL NOS、AITL及少数的ATLL和EATL患者, 且70%的人群为ALCL, PTCL NOS和AITL分别占15.9%(72例/452例)和11.9%(54例/452例)。尽管亚组分析显示PTCL NOS、AITL均有OS获益, AITL无PFS获益, 亚组结果是否存在偏倚, 需要进一步的验证。此外, 对于具有CD30表达的ATLL、EATL亚型的患者, A+CHP能否带来PFS和OS的获益目前仍不清楚。本研究中对CD30表达阳性的界定值为≥ 10%肿瘤细胞表达, 那么, CD30表达在1%~10%, 甚至< 1%的PTCL人群, A+CHP治疗的效果如何?NCCN指南中推荐A+CHP一线用于CD30阳性的PTCL患者, 基于部分CD30低表达的患者也显示出疗效, 并未对CD30阳性表达的阈值进行界定。一个需要思考的问题, 即不同程度CD30表达, 如≥ 1%、≥ 10%、20%~25%, A+CHP能否带来相同的获益?
自体造血干细胞移植(autologous stem cell transplantation, ASCT)作为PTCL一线治疗后的巩固治疗选择, ECHELON-2研究允许ASCT作为A+CHP治疗后的巩固治疗, 并纳入PFS和OS分析。该研究中A+CHP组mPFS达48.2个月, 中位OS未达到, A+CHP显著延长患者的mPFS和OS, 而对于该试验中占比70%的ALCL(49例IPI≥ 2分的ALK+ALCL, 113例ALK-ALCL), 72例的PTCL NOS, A+CHP的获益是否可以抵消ASCT带来的作用?2019年ASH会议口头报告了ECHELON-2试验组中36例患者接受ASCT和2例Allo-SCT治疗的结果[8]:27例ALK-ALCL和11例Non-ALCL患者接受SCT巩固治疗, SCT组和Non-SCT组估算3年 PFS分别为76.1% vs. 53.3%, 初步显示出A+CHP治疗后SCT治疗组较Non-SCT组有PFS获益。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|