作者简介:
张雅婷(1995-),女,甘肃陇南人,硕士研究生,从事消化肿瘤相关研究。
目的 评价14-3-3ζ蛋白的表达与胃癌的相关性。方法 计算机检索中国期刊全文数据库、维普中文科技期刊数据库、中国生物医学文献数据库、万方数据知识服务平台、 PubMed、Web of Science核心合集、Cochrane 图书馆和EMBASE数据库,搜集国内外公开发表关于14-3-3ζ蛋白的表达与胃癌相关性的研究,检索时限至2019年11月14日。筛选文献、提取资料和评价纳入研究的偏倚风险后,采用RevMan 5.3.5软件进行Meta 分析。结果 共纳入6篇文献,共计671例胃癌组织,其中14-3-3ζ蛋白高表达的胃癌组织为414例,低表达257例。Meta 分析结果显示:胃癌组织中14-3-3ζ蛋白多呈高表达[比值比=4.94,95%可信区间(1.29,18.82), P=0.02],高表达多见于肿瘤临床分期为Ⅲ~Ⅳ期的胃癌患者[比值比=0.34,95%可信区间(0.12,0.92), P=0.03];但与年龄[比值比=0.87,95%可信区间(0.59,1.28), P=0.48]、性别[比值比=1.11,95%可信区间(0.72,1.69), P=0.64] 及肿瘤大小[比值比=0.74,95%可信区间(0.30,1.84), P=0.02]无相关性。在生存方面,14-3-3ζ蛋白低表达组胃癌患者的1年[风险比=18.25,95%可信区间(6.53,51.04), P<0.000 01]、2年[风险比=24.37,95%可信区间(9.25,64.25), P<0.000 01]、3年 [风险比=20.90,95%可信区间(7.01,62.31), P<0.000 01]、5年[风险比=19.03,95%可信区间(7.02,51.62), P<0.000 01]总体生存率均明显高于高表达组。结论 14-3-3ζ蛋白表达与患者的临床分期及预后显著相关。
Objective To evaluate the correlation between the expression web of Science of 14-3-3ζ protein and gastric cancer.Methods CNKI, VIP, CBM, WanFang Data, PubMed, Cochrane Library and EMBASE,were searched to identify studies on 14-3-3ζ expression for gastric cancer before November 14th,2019. Meta-analysis was performed using RevMan 5.3.5 software after screening the literature, extracting data, and evaluating the risk of bias in the included studies.Results A total of 671 cases of gastric cancer were included in the cross-sectional study. Among them, 14-3-3ζ protein was high expressed in 414 cases and low expressed in 257. Meta-analysis shows that 14-3-3ζ protein was high expressed in gastric cancer tissues (OR=4.94, 95%CI 1.29 to 18.82, P=0.02), and its high expression was more common in tumors with clinical stage Ⅲ~Ⅳ gastric cancer patients (OR=0.34, 95%CI 0.12 to 0.92, P=0.03); but with age (OR=0.87, 95% CI 0.59 to 1.28, P=0.48), gender (OR=1.11, 95%CI 0.72 to 1.69, P=0.64) as well as tumor size (0.74,95%CI 0.30 to 1.84, P=0.02)had no significant relationship. 1-year [HR=18.25,95%CI(6.53,51.04), P<0.000 01],2-year(HR=24.37, 95%CI 9.25 to 64.25, P<0.000 01),3-year (HR=20.90, 95%CI 7.01 to 62.31, P<0.000 01) and 5-year overall survival rate(HR=19.03, 95%CI 7.02 to 51.62, P<0.000 01) of 14-3-3ζ protein low expression group were significantly higher than high expression group.Conclusion The expression of 14-3-3ζ protein is markedly correlated with clinical stage and the prognosis of gastric cancer.
胃癌(gastric carcinoma)是起源于胃黏膜上皮的常见消化道恶性肿瘤。近年来, 我国胃癌发病率与死亡率逐年上升, 其中以西北地区最为显著。调查显示, 2014年我国胃癌患者的死亡率高达13.5%, 仅次于肺癌(28.3%)和肝癌(15.5 %)[1]。外科手术及放化疗是胃癌治疗的最常见临床治疗方法, 但术后复发率高、易转移, 预后差, 目前, 临床尚缺乏有效的治疗手段。故研究胃癌发生、发展的分子机制, 寻找潜在治疗靶点, 提高胃癌患者的生活质量, 是当前相关研究的重点。
14-3-3蛋白是一类高度保守的酸性蛋白家族, 在所有真核生物中广泛表达。目前已知14-3-3蛋白在哺乳动物中确定表达7种亚型, 包括β 、γ 、ε 、ζ 、η 、σ 和τ , 结构高度相似, 并广泛参与细胞周期、信号转导、细胞增殖、细胞凋亡等多种生理过程[2, 3, 4, 5]。其中, 14-3-3ζ 蛋白是信号转导通路中重要的接头蛋白, 与14-3-3家族的其他成员形成同源二聚体和异二聚体, 可直接参与细胞的转化和增殖, 也可通过抑制、活化、结构的稳定或转位等多种方式, 抑制细胞凋亡, 促进细胞周期、增殖和粘附[6, 7, 8, 9, 10, 11]。研究发现, 14-3-3ζ 蛋白在多种恶性肿瘤中呈高表达, 有望成为癌症诊断、复发和预后的潜在标志物之一[12]。在胃癌中, 14-3-3ζ 蛋白在细胞膜、细胞质和细胞核均呈强阳性表达, 在正常细胞仅表达于细胞核, 故14-3-3ζ 蛋白可有望成为胃癌临床治疗的一个新靶点。本研究收集相关临床研究, 进行系统评价和Meta分析, 以明确14-3-3ζ 蛋白表达水平与胃癌的相关性, 为胃癌的临床诊治和预后提供相关依据。
1.1.1 纳入标准 ①研究类型为在2019年11月14日之前以论文形式发表的研究14-3-3ζ 蛋白表达与胃癌及其临床病理特征的相关研究。语种限中、英文。②研究对象为确诊的胃癌患者, 全部病例诊断均经病理结果证实; 纳入人群均不受年龄、种族、国籍限制。③暴露因素将14-3-3ζ 蛋白高表达作为暴露因素。14-3-3ζ 蛋白的检测方法为免疫组化, 评定标准采用半定量记分法。④结局指标采用免疫组化检测胃癌组织中14-3-3ζ 蛋白表达。
1.1.2 排除标准 未提供病例来源; 病例诊断标准不明确; 14-3-3ζ 的蛋白表达阳性判断界值不一致; 重复发表的文献; 仅有摘要而未找到全文的文献。
检索中国期刊全文数据库(CNKI), 中国生物医学文献数据库(CBM), 万方数据库, 维普中文科技期刊数据库, PubMed, Web of Science核心合集, Cochrane 图书馆, EMBASE数据库, 检索公开发表的中英文研究, 有关14-3-3ζ 蛋白表达与胃癌及其临床病理特征关系的研究, 检索时限至2019年11月14日。不包含(未公开出版、发行或刊登的)灰色文献, 检索关键词包括:stomach carcinoma; gastric cancer; 14-3-3 zeta; 14-3-3ζ ; 胃癌; 14-3-3蛋白等。
由2名研究人员分别独立提取资料, 如果存在争议, 则由第3名独立评价者进行评价。提取内容包括:①纳入研究的基本信息, 包括研究题目、第一作者、发表年限、原始文献出处等; ②研究对象的基线特征和关注结局, 包括各组的样本数、患者的年龄、性别和胃癌及其淋巴结转移、临床分期、病理学分级及14-3-3ζ 蛋白表达阳性判定标准等; ③偏倚风险评价的关键要素。采用NOS量表对纳入研究的偏倚风险进行评价。
采用Cochrane协作网提供的RevMan 5.3.5 软件进行荟萃分析。计数资料用比值比(odds ratio, OR)为效应指标, 计量资料采用均数差(mean difference, MD)为效应指标, 各效应量均给出其点估计值和95%可信区间(confidence interval, CI)。纳入研究结果间的异质性采用χ 2检验进行分析(检验水准为α =0.1), 同时结合I2定量判断异质性的大小。对纳入研究进行异质性检验, 有统计学异质性(P≤ 0.1, I2> 50%)则进一步分析异质性来源, 明显的临床异质性采用亚组分析或敏感性分析等方法进行处理, 或只行描述性分析。在排除明显临床异质性的影响后, 研究结果之间的合并分析采用随机效应模型; 反之, 采用固定效应模型。对于生存分析计算风险比(hazard ratio, HR)和标准误, 应用Parmar等提供的推算方法, 并应用方差倒数法估计及合并HR及95%CI[13, 14]。
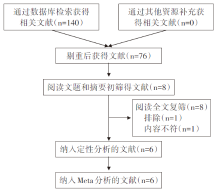
初检出相关文献140篇(PubMed 18篇、EMBASE 29篇、Cochrane 图书馆2篇、Web of Science 30篇、CBM 7篇、CNKI 36篇、VIP 3篇、Wanfang 15篇), 查重后为76篇, 经过阅读文题和摘要后为8篇。通过查找全文、通篇阅读文献, 最终纳入6篇文献。文献筛选流程及结果见图1。
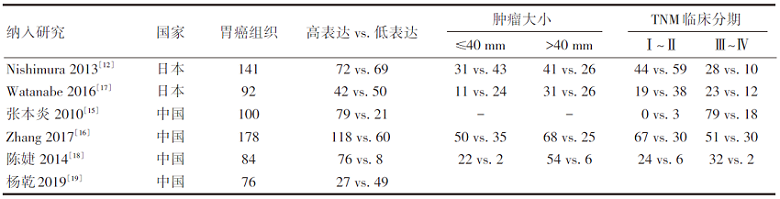
纳入研究的基本特征见表1。如表1所示, 共纳入6篇文献[12, 15, 16, 17, 18, 19], 3篇英文[12, 16, 17], 3篇中文[15, 18, 19], 均为回顾性研究; 其中1篇文献的研究对象为食管胃交界性胃腺癌[17], 4篇胃癌[12, 15, 16, 18], 1篇胃癌伴腹膜转移[19]; 6篇纳入文献共计纳入671例胃癌组织, 其中14-3-3ζ 蛋白高表达组织414例, 低表达257例, 男性患者的胃癌组织453例, 女性218例; 4篇文献采用免疫组化、Western Blotting、RT-PCT检测蛋白表达情况[8, 9, 10, 11], 2篇仅采用免疫组化[15, 19]; 4篇文献通过Kaplan-Meier分析胃癌患者的总体生存率和14-3-3ζ 蛋白表达高低的相关性[12, 16, 17, 19], 其中3篇使用Cox比例风险模型进行生存分析[12, 17, 19]。6篇纳入文献的NOS得分均值为6.3, 具体偏倚风险评价见表2。
| 表1 纳入研究的一般情况 |
| 表2 纳入研究的偏倚风险评价 |
2.3.1 胃癌组织中14-3-3ζ 蛋白表达情况
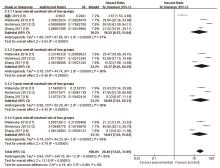
6项研究[12, 15, 16, 17, 18, 19]报告了胃癌组织中14-3-3ζ 蛋白高表达与低表达的比较情况。共414例胃癌高表达14-3-3ζ 蛋白, 257例低表达。在对6篇文献进行Meta分析时, 出现结果无统计学意义且异质性较大, 进行敏感性分析发现剔除杨乾等[19]的研究后异质性变化明显, 考虑为其样本量较少引起, 故在14-3-3ζ 在胃癌组织中表达情况的Meta分析时仅纳入5项研究[12, 15, 16, 17, 18]。随机效应模型Meta分析结果显示, 胃癌组织中14-3-3ζ 蛋白多呈高表达, 差异有统计学意义[OR=4.94, 95%CI(1.29, 18.82), P=0.02], 见图2。
2.3.2 胃癌14-3-3ζ 蛋白表达与性别的关系
4个研究[12, 16, 17, 18]报告了在310例14-3-3ζ 蛋白高表达的胃癌组织中, 男性组与女性组的比较情况。固定效应模型Meta 分析结果显示, 在14-3-3ζ 蛋白高表达的胃癌组织中, 在男性组与女性组中的差异无统计学意义[OR=1.11, 95%CI(0.72, 1.69), P=0.64], 见图3。
2.3.3 胃癌组织中14-3-3ζ 蛋白表达与年龄的关系
4个研究[12, 16, 17, 18]报告了308例胃癌组织中14-3-3ζ 蛋白高表达在年龄> 60岁组与≤ 60 岁组的比较情况。固定效应模型Meta 分析结果显示, 14-3-3ζ 蛋白高表达的胃癌组织中, > 60岁组与≤ 60 岁组中的差异无统计学意义[OR=0.87, 95%CI(0.59, 1.328), P=0.48], 见图4。
2.3.4 胃癌组织中14-3-3ζ 蛋白表达与肿瘤大小的关系
4个研究[12, 16, 17, 18]报告了胃癌组织中14-3-3ζ 蛋白高表达与低表达的比较情况, 该组高表达胃癌组织共计309例。随机效应模型Meta 分析结果显示, 肿瘤大小> 40 mm组中14-3-3ζ 蛋白表达的胃癌组织明显多于≤ 40 mm组, 其差异无统计学意义[OR=0.74, 95%CI(0.30, 1.84), P=0.52], 见图5。
2.3.5 胃癌组织中14-3-3ζ 蛋白表达与临床病理分期的关系
5个研究[12, 15, 16, 17, 18]报告了胃癌组织中14-3-3ζ 蛋白表达与临床病理分期的关系。随机效应模型Meta 分析结果显示, 胃癌临床Ⅲ ~Ⅳ 期组的14-3-3ζ 蛋白高表达明显多于Ⅰ ~Ⅱ 期组, 差异有统计学意义[OR=0.34, 95%CI(0.12, 0.92), P=0.03], 见图6。
2.3.6 胃癌组织14-3-3ζ 蛋白高表达组与低表达组总生存率的比较
4个研究[12, 16, 17, 19]报告了胃癌组织中14-3-3ζ 蛋白高表达组与低表达组的总生存率。随机效应模型Meta 分析结果显示, 胃癌14-3-3ζ 蛋白低表达组的1年[HR=18.25, 95%CI(6.53, 51.04), P< 0.000 01]、2年[HR=24.37, 95%CI(9.25, 64.25), P< 0.000 01]、3年 [HR=20.90, 95%CI(7.01, 62.31), P< 0.000 01]、5年[HR=19.03, 95%CI(7.02, 51.62), P< 0.000 01]总体生存率明显高于高表达组, 差异有统计学意义, 见图7。
作为14-3-3蛋白家族亚型之一, 14-3-3ζ 蛋白以二聚体形式, 参与调节细胞信号通路, 影响肿瘤细胞发生发展。研究表明, 14-3-3ζ 蛋白可能通过激活磷脂酰肌醇3-激酶/蛋白激酶B 通路, 导致P53降解并抑制P53诱导的细胞凋亡, 促进细胞增殖, 粘附并抑制肿瘤细胞的凋亡[2], 也可通过调控p38丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)参与p38信号通路, 促使胰腺癌细胞凋亡[20]。14-3-3ζ 蛋白可作用于细胞分裂周期蛋白Cde25, 调控细胞周期, 并抑制T/E/Y-cadhefin 等细胞粘附分子的表达来促进肿瘤细胞的浸润和转移[21, 22]。14-3-3ζ 蛋白表达也可促进肿瘤表型转化。Neal等[23]发现, 14-3-3ζ 在早期乳腺疾病中多呈高表达, 可参与促进人类乳腺上皮细胞向恶性转化; 在浸润性导管癌中也发现14-3-3ζ 蛋白过表达, 并影响疾病进展, 其机制可能是14-3-3ζ 蛋白通过激活的TGF-b/Smads途径导致上皮-间质转化, 促进浸润性乳腺癌的转化[24]。目前已有多个研究表明, 14-3-3ζ 蛋白可作为乳腺癌、肺癌和头颈癌的临床相关预后标志物, 用于识别肿瘤患者的预后, 影响临床治疗[23, 24, 25, 26]。14-3-3ζ 蛋白表达异常也与消化疾病的发生相关。研究表明, 14-3-3ζ 蛋白可能有助于肿瘤发生和早期癌症发展。Matta等[27]发现14-3-3ζ 蛋白过表达多发生在癌前病变阶段, 可能作为口腔肿瘤的早期肿瘤标志之一, 影响肿瘤发展和演变, 食管癌中也发现类似表现[27, 28, 29]。
Yuan等[30]发现14-3-3ζ 蛋白在胃癌细胞中可能影响CyclinD1和Bcl2蛋白, 上调PUMA和Bax蛋白, 通过p53途径抑制增殖和诱导凋亡。Guo等[31]发现, 沉默14-3-3ζ 蛋白表达可导致胃癌BGC-823细胞的细胞周期停滞, 促进其凋亡; 抑制14-3-3ζ 蛋白表达可上调LC3II/LC3I比率, 下调p62水平, 促进肿瘤自噬。此外, 14-3-3ζ 蛋白可激活PI3K/AKT/mTOR信号通路, 进一步影响细胞凋亡和自噬。Zhang等[16]发现14-3-3ζ 可以通过诱导YAP磷酸化来促进细胞质保留, 抑制YAP的转录活性, YAP可诱导泛素化抑制14-3-3ζ 的表达, 表明可能存在14-3-3ζ -YAP负调节反馈回路, 在细胞增殖和存活中起关键作用。本文通过研究14-3-3ζ 蛋白与胃癌临床病理参数及预后的相关性, 进一步研究14-3-3ζ 蛋白在胃癌发生发展过程中可能产生的作用。
研究结果显示, 14-3-3ζ 蛋白在胃癌组织中多呈高表达, 且在肿瘤直径> 40 mm, TNM临床分期Ⅲ ~Ⅳ 期的晚期胃癌患者的肿瘤组织中更易呈高表达, 由此可见14-3-3ζ 蛋白可能为重要的胃癌致癌基因; 进一步进行生存资料分析发现, 14-3-3ζ 蛋白高表达的胃癌患者, 其1年、2年、3年、5年总体生存率远低于低表达患者, 说明14-3-3ζ 蛋白在胃癌患者预后中的重要性。关于14-3-3ζ 蛋白表达与胃癌患者性别、年龄及肿瘤大小的关系, 则未见明显相关性。
本研究的局限性体现在:纳入研究所在国家为日本和中国的亚洲国家; 纳入研究数和样本量均偏少, 部分合并分析纳入研究数仅3个; 未能进行调整数据的Meta 分析。这些局限性均可能产生偏倚, 而影响本次Meta 分析结果的可靠性。且本研究的纳入文献中, 均通过检测胃癌手术后标本组织中14-3-3ζ 表达, 结合具体临床数据进行研究, 故尚不能说明14-3-3ζ 蛋白对胃癌治疗疗效是否有一定作用。
综上所述, 在胃癌组织中14-3-3ζ 蛋白多呈高表达, 且其表达与胃癌肿瘤大小、不同临床分期及预后存在明显关联, 但与患者年龄、性别无明显相关性。14-3-3ζ 蛋白可能作为重要的临床相关预后蛋白, 影响胃癌临床诊疗。鉴于纳入研究质量和数量所限, 本研究结论尚需开展更多设计严谨、高质量的研究进一步验证。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|