作者简介:
陈湘婷(1991-),女,广东茂名人,硕士研究生,从事糖尿病性视网膜病变研究。
目的 探讨细胞骨架蛋白2(CKAP2)对高糖培养的人视网膜血管内皮细胞的作用。方法 体外培养人视网膜微血管内皮细胞(HRMECs)株,分为正常对照组(CON组)、高渗培养组(30 mmol/L甘露醇,HO组)、高糖培养组(30 mmol/L D-葡萄糖,HG组)。RT-PCR和Western blot法分别检测CKAP2 mRNA及蛋白表达情况。分别用siCKAP2转染HRMECs阻断CKAP2,或加入雷珠单抗(106 μg/mL)阻断血管内皮生长因子后,细胞增殖、划痕和小管形成实验检测细胞的增殖率、迁移能力和成管能力。结果 ①与正常对照组、高渗组相比,高糖组CKAP2的mRNA和蛋白表达上调;②阻断CKAP2后,细胞的增殖能力、迁移能力和血管形成能力明显减弱;③阻断CKAP2与阻断血管内皮生长因子对降低细胞的增殖、迁移和成管能力的作用相似。结论 CKAP2可影响视网膜微血管内皮细胞的增殖、迁移和成管能力,其作用效果可能与血管内皮生长因子相似。
Objective To investigate the role of cytoskeletal-associated protein 2 (CKAP2) in human retinal vascular endothelial cells cultured in high glucose.Methods Human retinal microvascular endothelial cells (HRMECs) were cultured in vitro and divided into normal control group (CON group), hypertonic culture group (30 mmol/L mannitol, HO group), and high glucose culture group (30 mmol/L D-glucose, HG group). Real-time PCR and Western blot were used for detecting the mRNA and protein expression level of CKAP2. After transfection of HRMECs with siCKAP2 to block CKAP2, or addition of Ranibizumab(106 μg/mL) to block VEGF, MTT, scratch and tubule formation experiments were performed to detect the proliferation rate, migration ability and tube formation ability of cells.Results ①Compared with the CON group and HO group, the mRNA and protein expressions of CKAP2 in the HG group were up-regulated; ② After siCKAP2 transfection, the cell proliferation ability, migration ability and angiogenesis ability were significantly reduced; ③Blocking CKAP2 and blocking VEGF have similar effects on reducing cell abilities in proliferation, migration, and tubular formation.Conclusions CKAP2 may be involved in the proliferation, migration and tube formation of retinal microvascular endothelial cells, and its effect may be similar to VEGF.
糖尿病视网膜病变(diabetic retinopathy, DR)是糖尿病最常见的微血管并发症之一, 是高收入国家劳动年龄人口失明和视力受损的主要原因[1]。根据有无新生血管生成, DR可分为非增殖性糖尿病视网膜病变(nonproliferative diabetic retinopathy, NPDR)和增殖性糖尿病视网膜病变(proliferative diabetic retinopathy, PDR), 其中PDR可导致严重的视功能损害。目前PDR的治疗方式主要包括视网膜激光光凝、玻璃体视网膜手术和抗血管内皮生长因子(vascular endothelial growth factor, VEGF)治疗[2]。抗VEGF药物通过抑制VEGF的表达, 可以阻断新生血管形成和降低血管渗透压, 改善血管内皮细胞的紧密连接[3]。但由于这些治疗手段都存在相应的并发症或风险[4], 如玻璃体内注射抗VEGF药物会导致纤维血管的收缩, 引起牵拉性视网膜脱离[5]。因此进一步阐明DR的发生机制, 探寻新的治疗靶点依然是目前亟待解决的问题。
本课题组前期对PDR患者和糖尿病无视网膜病变患者进行全外显子组测序联合SNaPshot技术分析[6], 发现细胞骨架蛋白2(cytoskeleton-associated protein 2, CKAP2)基因可能参与PDR的发生发展。CKAP2也称为肿瘤相关微管蛋白(tumor-associated microtubule-associated protein, TAMP), 是一种新型的与细胞有丝分裂相关的蛋白, 研究证明其主要参与活跃增殖细胞的有丝分裂过程, 已涉及多种活跃增殖相关疾病[7]。本研究旨在探讨CKAP2对高糖培养的人视网膜微血管内皮细胞(human retinal microvascular endothelial cells, HRMECs)的作用。
HRMECs由中山大学中山眼科中心胡洁教授赠送。所用试剂主要包括:内皮细胞培养液(endothelial cell medium, ECM, 美国Sciencell公司)、胎牛血清(FBS, 美国GIBCO公司)、内皮细胞生长因子(endothelial cell growth supplement, ECGS, 美国Sciencell公司)、0.25%胰酶(美国Thermo Fisher Scientific公司)、基质胶(Matrigel胶, 美国Corning公司)、二甲基亚砜(DMSO, 美国Sigma公司)、MTT细胞增殖及细胞毒性检测试剂盒(上海碧云天生物技术有限公司)、兔源性CKAP2抗体(美国Abcam公司)、鼠源性a-tublin抗体(美国Santa Cruz公司)、山羊抗兔IgG抗体(美国CST公司)、山羊抗鼠抗体(美国CST公司)、焦碳酸二乙酯DEPC(美国Sigma公司)、逆转录试剂盒(日本Takara公司)、6孔板、24孔板(美国Corning公司)、蛋白质印迹法相关试剂(上海碧云天生物技术有限公司)、雷珠单抗(Ranibizumab, Lucentis® , 瑞士Novartis Pharma Schweiz AG公司)、单基因套装siCKAP2(广州市锐博生物科技有限公司)、 Lipofectamine 2000(美国Thermo Fisher Scientific公司)、无血清培养基(Opti-MEM, 美国GIBCO公司)。
1.2.1 HRMECs的培养
采用含有10%胎牛血清、1% ECGS和1%肝素钠的ECM(5.5 mmol/L的葡萄糖)在37℃、5% CO2饱和湿度的培养箱中培养HRMECs, 待细胞长满约80%时进行传代, 只取用3~7代的细胞用于实验。
1.2.2 实验分组
根据HRMECs培养条件的不同分为对照组(CON组, 常规ECM培养, 含糖5.5 mmol/L)、高渗组(hypertonic, HO组, 常规ECM+24.5 mmol/L甘露醇培养, 终浓度约为30 mmol/L)、高糖组(high glucose, HG组, 常规ECM+24.5 mmol/L D-葡萄糖培养, 终浓度约为30 mmol/L), 细胞铺板贴壁后无血清培养液饥饿12 h, 使细胞生长同步化, 再分别采用以上各组条件培养24 h。在高糖培养基础上, 进行CKAP2 siRNA转染HRMECs沉默CKAP2基因, 即高糖+siCKAP2组(HG + siCKAP2组)。使用雷珠单抗(106 μ g/mL)进行阻断VEGF实验, 即高糖+雷珠单抗组(HG+Lucentis组)。
1.2.3 细胞爬片及免疫荧光测定
取对数生长期的HRMECs, 消化后进行细胞计数, 以每孔1 mL接种于预先放入无菌圆形盖玻片的6孔板内。按照上述条件进行干预培养, 培养结束后弃去培养液用磷酸盐缓冲液(PBS)洗涤3次, 室温下4% 多聚甲醛(PFA)固定15 mins, PBS洗涤3次, 改0.2% Triton X-100通透15 mins, PBS洗涤3次, 室温下5% 牛血清血蛋白(BSA)封闭30 mins, 盖玻片取出放入湿盒内, 加入5% BSA稀释的一抗, 4℃过夜。取出湿盒, 室温复温30 mins, PBS洗涤3次, 加入5% BSA稀释的AlexaFluor标记的荧光二抗, 室温避光孵育2 h。PBS洗涤3次, DAPI染液室温下避光孵育10 mins, PBS洗涤3次, 倒置显微镜下拍照。
1.2.4 RT-PCR检测目的基因表达量
Trizol法提取细胞或者组织总RNA, 将RNA逆转录为cDNA后采用反转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)方法检测目的基因mRNA相对表达量。CKAP2上游引物:5′ -GCCCAAAGAAACCTCGGAAG-3′ , 下游引物:5′ -GCAGGCRCATGCTGAGTAAC-3′ 。
1.2.5 MTT法检测细胞增殖
按照干预条件干预结束后, 弃去细胞培养液, PBS清洗后加入10 μ L MTT溶液(5 g/L)继续培养4 h。弃去培养液后每孔加入DMSO 150 μ L, 低速振摇10 mins后于全自动酶标仪570 nm处测定各孔吸收OD值。
1.2.6 小管形成实验
收集各组细胞接种至包被Matrigel(40 μ L/孔)的96孔板内, 细胞密度5× 103个/孔。采用各实验组及对照组条件孵育24 h, 光镜下随机选取视野, 观察各组细胞管状排列状况、完整程度, 并于采图后用ImageJ图像分析系统计算每一孔内小管的个数, 评估细胞形成小管能力。
1.2.7 细胞转染
使用Opti-MEM培养基稀释Lipofectamine2000试剂, 充分混匀, 同时使用Opti-MEM培养基稀释siRNA浓度至50 nM, 制备siRNA预混液, 室温下静置20 mins。将siRNA-脂质体复合物添加至细胞中, 37℃室温孵育6 h后换含1%血清浓度的ECM。同时荧光显微镜下观察转染效率, 提取细胞总蛋白行Western blot检测细胞转染效果。
1.2.8 Western blot检测蛋白表达量
RIPA法提取细胞或组织总蛋白, 统一蛋白浓度后行SDS-聚丙烯酸胺凝胶电泳, 先设置起始电压为80 V, 当溴酚蓝指示剂跑至浓缩胶与分离胶交界处电压改100 V, 后用200 mA恒流将蛋白质转至PVDF膜上, TBST洗涤后用5%脱脂奶粉封闭1 h后敷一抗过夜, HRP标记的二抗4℃孵育2 h后加入ECL发光液后曝光显影。
采用SPSS 23.0软件进行统计学处理, 计量资料以均数± 标准差(Mean± SD)表示, 多组差异采用随机区组设计的单因素方差分析(one-way analysis of variance, ANOVA), 组间差异采用SNK(Student Newman-Keuls)检验方法, P< 0.05为差异有统计学意义。
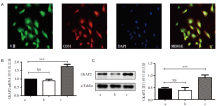
使用Ⅷ 因子和CD31共同鉴定HRMECs。Western blot和RT-PCR结果显示CKAP2在高糖培养的HRMECs表达上调, 与对照组、高渗组相比, 差异有统计学意义(P< 0.001), 见图1。
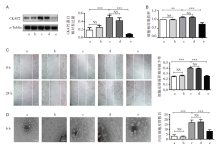
在高糖培养条件下转染CKAP2 siRNA后可有效阻断CKAP2蛋白的表达, 见图2。MTT、划痕实验和小管形成实验结果显示阻断CKAP2后, 与对照组比较, 高糖培养条件下细胞的增殖能力、迁移能力和血管形成能力明显减弱, 见图2。
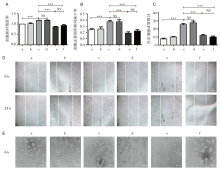
已有研究证实高糖培养内皮后ZO1蛋白表达下调, 而这种下调可以被抗VEGF药物改善[8, 9]。因此我们选用ZO1蛋白作为评估雷珠单抗阻断VEGF效果的指标。与既往文献报道相似, 高糖培养HRMECs 24 h后ZO1蛋白表达较对照组明显下调, 而高糖培养12 h时加入雷珠单抗继续培养12 h后ZO1表达与正常组和高渗组比较没有差异, 提示雷珠单抗106 μ g/mL可以在体外成功阻断VEGF, 见图3。
随后我们比较了使用siCKAP2阻断CKAP2和使用雷珠单抗阻断VEGF后对HRMECs的影响, 发现两者均能显著降低HRMECs的增殖能力、迁移能力和成管能力, 见图4, 且两者之间比较差异无统计学意义。
CKAP2主要通过残基的磷酸化参与细胞早期的有丝分裂[10]。目前CKAP2的研究热点主要集中于恶性肿瘤, 如骨肉瘤、乳腺癌和前列腺癌等[11, 12]。研究者发现敲除CKAP2后可以减少细胞增殖, 而过表达CKAP2可以增强人HFFs和NIH3T3细胞的增殖[13]。我们前期测序发现PDR患者中CKAP2基因高表达, 推测CKAP2的过度表达可以导致视网膜血管的过度增生, 细胞处于活跃增殖状态, 进而引起PDR的发生。因此, 本研究初步探讨了高糖培养条件下HRMCEs中CKAP2的表达及其作用。结果发现, 高糖组中CKAP2 mRNA和蛋白表达水平显著升高; 阻断CKAP2后, 高糖条件下HRMECs的增殖、迁移和成管能力显著下降, 提示CKAP2在DR的视网膜血管内皮细胞中可能存在表达上调, 影响细胞增殖、迁移和成管能力, 从而参与DR的发生和发展。
诸多研究已证实VEGF可以促进内皮细胞增殖及诱导血管生成, 是参与DR进展的重要因素, 其中VEGF-A型是最主要的参与血管形成的亚型。VEGF-A和VEGFR2结合可激活多条通路, 引起眼部血管形成和血管通透性增加[14]。抗VEGF药物可以阻断新生血管的形成和有效降低血管的渗透压, 改善视网膜血管内皮细胞的紧密连接[3], 已逐渐应用于DR的治疗。因此, 我们进一步在体外使用雷珠单抗阻断HRMECs的VEGF, 与阻断CKAP2后对细胞增殖、迁移和成管能力的影响进行对比观察。结果显示, 二者均可显著引起HRMECs细胞学功能的变化, 且作用结果相似, 提示CKAP2对DR的作用可能与VEGF类似。
通过实验初步验证了CKAP2可以影响视网膜微血管内皮细胞的增殖、迁移和成管能力, 且作用与VEGF类似。目前关于CKAP2的研究热点主要集中于肿瘤学, 有研究发现, CKAP2外显子上游位点具有高度保守的p53结合位点, 认为p53可以激活CKAP2[15]。p53是一种抑癌因子, 是控制细胞增殖和凋亡的中心调节开关[16]。已有研究证明p53在PDR患者的增生性糖尿病视网膜病变患者的前膜中过表达, 且其诱导的磷酸酶1(Wild-type p53-induced phosphatase 1, Wip1)在增生性糖尿病视网膜病变前膜中高表达[17]。我们也初步在临床标本探讨了p53和CKAP2在PDR患者的玻璃体液和外周血中同时高表达, 但是二者是如何共同参与PDR的发生发展的关系需要进一步的实验验证。
综上所述, 高糖环境下CKAP2在HRMECs中高表达, 并可促进细胞的增殖、迁移和成管能力, 且该作用与VEGF作用类似。利用PDR患者组织标本(玻璃体液、视网膜增殖膜)及动物模型进一步探讨CKAP2的作用及其机制, 将有利于阐明DR的发病机制, 为DR治疗策略提供新的思路, 并将为其他新生血管性疾病的研究提供新的切入点, 将具有重要的应用基础研究意义和临床应用转化价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|