| 范云,中国科学院大学附属肿瘤医院(浙江省肿瘤医院)胸部肿瘤内科主任,主任医师,博士生导师。擅长肺癌、食管癌、胸腺瘤等恶性肿瘤的内科诊疗及转化研究;在肺癌脑转移的综合治疗及转移机制、小细胞肺癌的药物治疗和肿瘤免疫微环境等方面有较深入研究。兼任中国临床肿瘤学会理事,中国临床肿瘤学会小细胞肺癌专家委员会副主任委员,中国临床肿瘤学会患者教育专家委员会副主任委员,中国医师协会肿瘤多学科诊疗专业委员会常务委员,中国抗癌协会肺癌专业委员会委员,浙江省医师协会肿瘤精准治疗专业委员会主任委员,浙江省抗癌协会肿瘤内科专业委员会候任主任委员。以第一或通讯作者发表学术论著40余篇;参与8部专著编写。主持或参与国际、国内多中心临床研究70余项。主持国家自然科学基金、浙江省自然科学基金及其它省部级科研课题10余项。2019年获国家科学技术进步奖二等奖。 |
Horn L, Mansfield AS, Szczesna A, et al. First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer[J]. N Engl J Med, 2018, 379(23):2220-2229.
1b。
近20年来, 以铂类联合依托泊苷(platinum-etoposide, EP)的化疗方案作为广泛期小细胞肺癌(small cell lung cancer, SCLC)的一线治疗标准未有改变, 有效率在60%~65%, 但患者预后差, 中位生存期仅约10个月。SCLC有较高的基因突变率, 提示着可能对免疫检查点抑制剂的治疗有效。在化疗的基础上联合免疫治疗可能提高抗肿瘤免疫原性, 改善患者预后。免疫治疗在复发转移SCLC患者中已观察到临床疗效, 目前nivolumab已经获批用于转移性SCLC的三线治疗。然而在SCLC一线的研究中, pembrolizumab维持治疗的Ⅱ 期单臂研究及ipilimumab联合化疗的Ⅲ 期研究均未显示疗效获益。atezolizumab是一种人源化的程序性死亡配体1(programmed death ligand 1, PD-L1)抗体, 抑制PD-L1/PD-1及PD-L1/B7-1通路的激活, 激活肿瘤特异性T细胞免疫活性。在Ⅰ 期的临床研究中, atezolizumab单药治疗的毒性可控, 安全性较好, 对复发难治SCLC有较好的反应持续时间。IMpower133研究旨在评估atezolizumab/安慰剂联合EP方案在广泛期SCLC一线治疗的有效性及安全性。这篇文献报道了总生存期(overall survival, OS)中期分析结果及无进展生存期(progression-free survival, PFS)的最终结果。
评估atezolizumab/安慰剂联合EP方案在广泛期SCLC一线治疗的有效性及安全性。
• 研究条件:包括美国、波兰等全球多中心合作的IMpower133研究组(NCT02763579)。
• 研究时间:2016年6月6日至2017年5月31日。
• 研究方法:全球Ⅰ 期(安全性)/Ⅲ 期(有效性)、双盲、随机、安慰剂对照的临床试验。
• 研究对象:有可测量病灶的广泛期SCLC, 东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)PS评分0~1分, 既往未接受过系统性治疗, 允许经治无症状脑转移患者; 主要排除有自身免疫性疾病史、既往使用过CD137激动剂或免疫检查点阻断治疗的患者。
• 干预措施:按1∶ 1比例随机分配至研究组(atezolizumab 1 200 mg, d1+依托泊苷100 mg/m2, d1~d3+卡铂AUC=5, d1, n=201)及对照组(依托泊苷100 mg/m2, d1~d3+卡铂AUC=5, d1, n=202), 完成4周期的治疗后, 研究组接受atezolizumab维持治疗, 对照组接受安慰剂治疗, 均治疗至疾病进展。
• 评价指标:主要研究终点指标为OS, PFS; 次要研究终点指标为客观缓解率(objective response rate, ORR), 缓解持续时间(duration of response, DoR)及安全性。
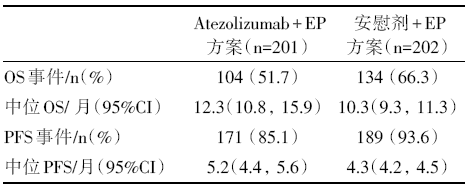
中位随访时间为13.9个月, 研究达到主要研究终点, atezolizumab联合化疗组OS、PFS均较对照组显著延长, 两组12个月的总生存率分别为51.7%、38.2%, 中位OS分别为12.3个月和10.3个月[风险比hazard ratio(HR) 0.70, 95%可信区间(confidence interval, CI) 0.54~ 0.91; P=0.006 9]; 中位PFS分别为5.2个月和4.3个月(HR 0.77, 95%CI 0.62~0.96; P=0.001 7); 两组ORR分别为60.2%和64.4%; 研究组安全性与既往报道一致, 毒性可控。主要研究结果见表1。
| 表1 IMpower133主要研究终点OS结果 |
Atezolizumab联合EP方案作为广泛期SCLC的一线治疗可显著延长患者的OS和PFS, 安全性与单用时一致。
小细胞肺癌(small-cell lung cancer, SCLC)是一种恶性度高, 疾病进展迅速, 生存预后差的恶性肿瘤; 约60%~70%的患者在初诊时即为广泛期[1]。既往以依托泊苷联合铂类的一线治疗方案缓解率虽可高达60%~80%, 但中位生存期(overall survival, OS)仅为10个月左右。在二十余年SCLC新药研究的探索中, 多种化疗及靶向药物均以失败告终, 一线治疗缺乏进展。
小细胞肺癌有着较高的突变负荷[2, 3], 其潜在的免疫原性是免疫检查点抑制剂获益的基础。Nivolumab及pembrolizumab率先在复发、难治性SCLC进行探索, 均已取得SCLC三线治疗的适应证[4, 5, 6]。IMpower133研究是第一项在未经治疗的广泛期SCLC(extensive-stage small-cell lung cancer, ES-SCLC)患者开展的随机、双盲、安慰剂对照的Ⅲ 期临床试验, 结果显示, atezolizumab相比安慰剂显著延长了OS(12.3 个月vs. 10.3 个月, HR=0.70, P=0.007)和PFS(5.2个月vs. 4.3个月, HR=0.77, P=0.02); atezolizumab联合化疗没有明显增加不良反应的发生率, 患者耐受性良好。IMpower133的研究结果是近30年来SCLC治疗领域的重大突破; 随后, 与其设计类似的CASPIAN研究同样取得了阳性结果[7]。基于IMpower133和CASPIAN研究结果, NCCN指南和CSCO指南推荐这两个PD-L1单抗联合化疗作为ES-SCLC的一线治疗首选方案, 改变了SCLC的一线治疗格局。有意思的是, 基于程序性死亡受体1(programmed death 1, PD-1)单抗的两项Ⅱ ~Ⅲ 期随机对照试验(EA5161研究和KEYNOTE-604研究)的结果却不尽人意, 免疫联合化疗与单纯化疗相比, 尽管在PFS上取得显著延长, 但OS改善均未达统计学差异。这些不一致的研究结果可能与药物本身、入组人群、研究设计和后续治疗等因素相关。PD-1单抗在ES-SCLC一线治疗中的疗效及地位仍需要进一步明确; 目前在国内开展的三项PD-1单抗的Ⅲ 期随机临床试验将会解答这个疑问。
尽管IMpower133研究建立了ES-SCLC一线治疗的新标准, 尚存在一些未解决的临床问题。首先, 如何寻找预测免疫疗效的生物标志物。PD-L1表达和肿瘤突变负荷(tumor mutational burden, TMB)是最经典和常用的生物标志物。在IMpower133研究中, 接受atezolizumab联合化疗的OS获益不受PD-L1表达(肿瘤细胞或免疫细胞)水平的影响; CASPIAN研究亦得出相似结果。IMpower133研究探索了液态TMB与疗效的相关性, 结果没有发现两组之间存在相关性。这些数据与既往研究结果有所出入[6, 8], 需要后续研究进一步明确这些生物标志物的预测价值及最佳检测方法。与非小细胞肺癌相比, SCLC的PD-L1阳性率明显降低, 尤其需要探索新的生物标志物及SCLC分子分型在其中的价值。其次, 关于特定器官转移的免疫疗效问题。在CASPIAN研究中, 脑转移亚组(占全组人群的10%)的OS获益与无脑转移组相似(HR分别为0.69和0.74); 而IMpower133研究中的脑转移亚组(占全组人群的8%), 无论接受免疫治疗与否, OS差异并不明显。在IMpower133研究的肝转移亚组, 接受免疫联合化疗似乎有一定程度的OS获益; 而CASPIAN研究未报道相关数据。因此, 有关SCLC肝、脑转移人群的免疫治疗获益问题有待进一步研究。第三, 在免疫治疗时代, 如何将PD-L1单抗与传统治疗相结合。IMpower133研究中, 在维持治疗阶段两组均允许预防性全脑放疗(prophylactic cranial irradiation, PCI), 全组403例患者中有44例(11%; 每组22例)接受了PCI; 然而, CASPIAN研究仅允许对照组进行PCI。两项研究均不允许进行胸部姑息放疗。由此可见, ES-SCLC免疫治疗人群的PCI及胸部姑息放疗的意义及安全性问题, 目前缺乏相关数据, 需要更多临床研究来评估。
IMpower133研究及CASPIAN研究代表了几十年来ES-SCLC治疗的最大进步, 但所带来的OS绝对获益仅有2~3个月。如何进一步提高PD-1/PD-L1单抗的疗效, 是目前面临的最大挑战。正在探索的领域包括以下几个方面:(1)联合新的免疫治疗药物, 加入TIGIT(具有免疫球蛋白和ITIM结构域的T细胞免疫受体, T cell immunoglobulin and ITIM domain)抑制剂的联合模式现已进入Ⅲ 期临床研究。(2)联合小分子抗血管生成药物, 目前已经有一些初步数据。(3)将免疫治疗与PARP[多聚二磷酸腺苷核糖聚合酶, Poly(ADP-ribose) polymerase]抑制剂等小分子药物相结合。(4)探索新的免疫治疗策略, 如疫苗及嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy, CAR-T)等; 一项靶向DLL3的CAR-T(AMG 119)治疗(NCT03392064)正在SCLC进行Ⅰ 期临床试验。(5)进一步探索预测疗效的分子标志物。这些研究将有望进一步提升SCLC免疫治疗的疗效及精准性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|