作者简介:
陈秀云(1985-),女,广州人,主管技师,医学学士,从事药物浓度监测。
目的 评价广东省人民医院2014年1月至2017年12月的9 389例/次环孢素(cyclosporine A,CsA)治疗药物监测和临床用药情况。方法 对广东省人民医院1 719例患者9 389次的CsA监测结果进行统计分析,并对501例血液病患者的性别、年龄、肝功能、合并用药变化对CsA血药浓度影响的分析。结果 首次治疗药物监测结果在有效治疗窗内的仅占30.8%;治疗药物监测次数为1、2、3和大于10次者分别占总人数的41.0%、16.9%、9.2%和14.4%;在所有监测次数为3~5次的患者中,第1、2、3、4、5次治疗药物监测结果在治疗窗内的分别占总人数的38.8%、38.9%、39.2%、37.1%、47.1%;性别、肝功能、合并用药变化对CsA血药浓度均有显著的影响( P<0.05),年龄对CsA血药浓度未有显著影响( P>0.05)。结论 治疗药物监测虽然广泛应用,但监测次数偏少;即使监测多次,达标情况仍不理想,应高度重视这种不能很好调整患者用药的现象,这可能与CsA血药浓度药动学参数个体差异和受多种因素影响有关。
Objective To evaluate 9 389 cases of therapeutic drug monitoring (TDM) and the clinical drug usage of cyclosporine A(CsA) in Guangdong Provincial People's Hospital during January 2014 to December 2017.Methods Analysis and statistics of CsA TDM data of 9 389 cases (1 719 subjects) in Guangdong Provincial People's Hospital were carried out. The effects of gender, age, liver function and changes of combined medication on the blood concentration of CsA in 501 patients with hematological disease were analyzed.Results Among all the first TDM concentration, only 30.8% was within the therapeutic window. Constituent ratio of patients whose drug concentrations were monitored once, twice, three times or more than ten times respectively of 41.0%, 16.9%, 9.2 % and 14.4%. Among all the subjects undergoing 3~5 times of TDM, constituent ratio of patients whose drug concentrations of the first, second, third, fourth and fifth monitoring were within the therapeutic window accounted for 38.8%, 38.9%, 39.2%, 37.1% and 47.1% respectively. Gender, liver function, and changes of combined medication had significant effect on the blood concentration of CsA( P<0.05), and age had no significant effect on the blood concentration of CsA( P>0.05).Conclusion Although TDM was widely used, the TDM times were insufficient. Even TDM was multiple, the status of which was not satisfactory. We should pay much more attention to the phenomenon that the patients'medication was not adjusted properly. It may correlate with the individual difference of pharmacokinetic parameters of CsA, and many factors that can affect the concentration of CsA.
治疗药物浓度监测(therapeutic drug monitoring, TDM)是通过测定血液中或其他体液中药物的浓度并利用药动学的原理和公式使给药方案个体化, 以提高药物疗效, 避免或减少不良反应, 同时为药物过量中毒的诊断和处理提供依据, 对提高临床用药的有效性与安全性具有重要意义[1, 2, 3]。环孢素(cyclosporine A, CsA)是一种高效的免疫抑制剂, 能有效地特异性抑制淋巴细胞反应和增生, 临床上广泛应用于器官移植的排斥反应和其他自身免疫性疾病的治疗。由于CsA治疗窗窄[4, 5], 吸收缓慢且不完全, 绝对生物利用度低, 其浓度受移植后时间和其他药物代谢的影响显著, 患者需长期服药且具有一定程度的肾毒性。毒性的发生与CsA的应用剂量密切相关[6, 7, 8], CsA血药浓度过高会发生过敏反应、胃肠道反应及肝肾毒性等, 过低则可导致急性排斥反应[9, 10]。在临床应用中, 应定期监测CsA血药浓度及时调整给药方案, 确保在安全剂量下的有效治疗。本文采用回顾性分析方法, 对广东省人民医院2014年1月至2017年12月监测的1 719例患者共9 389例次CsA血药浓度结果进行统计分析, 为临床合理用药提供参考依据。
共检测1 719例患者9 389例次, 其中男性1 045例, 女性674例, 年龄1~84岁, 平均年龄33.4± 16.0岁。
CsA口服给药, 于服药前空腹取血, 测定CsA谷浓度。
化学发光微粒子免疫检测法(chemiluminescent microparticle immunoassay, CMIA), ARCHITECT i1000SR(美国雅培)。用CMIA配套的定标液[包括0(A)、40(B)、150(C)、400(D)、800(E)和1500(F)ng/mL的6个点]制定标准曲线; 采用低、中、高三个水平的全血免疫抑制剂质控物(批号为21830, 伯乐); CsA样品预处理, 在1.5 ml EP管中加入200 μ l充分混匀的样品, 依次加入100 μ l裂解液和400 μ l沉淀剂, 充分振荡30 s至变色, 然后14 000转/分离心8 min, 上清液倒入样品杯中上机检测。
器官移植类或血液免疫性相关疾病等, 广东省人民医院统一推荐CsA血药谷浓度的参考的治疗最佳浓度范围100~220 ng/mL, 大于220 ng/mL可能导致不良反应风险增加, 小于100 ng/mL则可能导致治疗效果不佳。
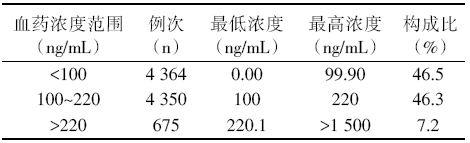
9 389例次CsA血药浓度结果检测中, 其中4 364例CsA血药浓度< 100 ng/mL, 占46.5%; 4 350例CsA血药浓度100~220 ng/mL, 占46.3%; 675例CsA血药浓度> 220 ng/mL, 占7.2%, 见表1。
| 表1 9 389例次进行TDM的血药浓度分布统计 |
首次进行TDM时, 浓度在治疗窗之内仅占30.8%, 而中毒者占9.4%, 剂量不足占59.8%。其中, 浓度最低为0 ng/mL; 最高> 1 500 ng/mL, 见表2。
| 表2 1 719例患者首次进行TDM的血药浓度分布统计 |
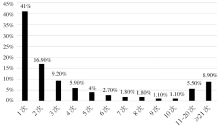
由表3可见, 绝大多数患者只测定了1次血药浓度, 占41.0%, 而测定2次、3次、4次血药浓度的患者仅占16.9%、9.2%和5.9%; 但也有8.9%的患者坚持监测次数大于20次, 最多者35次, 多见于器官移植患者, 见图1。
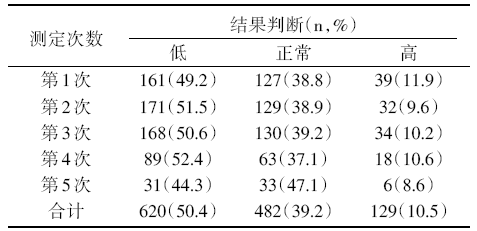
| 表3 TDM 3~5次的血药浓度分布统计 |
TDM 3~5次共329位患者, 共1 231例次, 血药浓度分布情况见表3。在有效治疗窗内仅占39.2%, 低浓度范围占50.4%, 中毒浓度范围内占10.5%。第1次TDM结果在治疗窗内仅占38.8%, 第2、3、4、5次治疗浓度在治疗窗内分别占38.9%、39.2%、37.1%和47.1%; 而第1、2、3、4、5次治疗浓度在中毒范围内分别占11.9%、9.6%、10.2%、10.6%和8.6%。
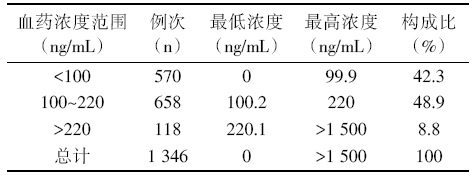
TDM 10~20次共95位患者, 共1 346例次, 血药浓度分布情况见表4。在治疗窗内有658例次, 占48.9%; 中毒者118例次, 占8.8%; 低血药浓度者570例次, 占42.3%; 最低浓度0 ng/mL, 最高浓度 > 1 500 ng/mL。
| 表4 TDM 10~20次的血药浓度分布统计 |
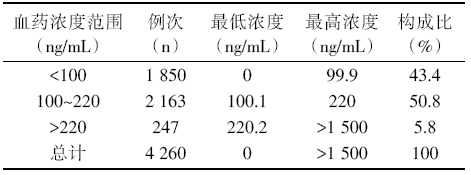
TDM> 20次共153位患者, 共4 260例次, 血药浓度分布情况见表5。在治疗窗内有2 163例次, 占50.8%; 中毒者有2 478例次, 占5.8%; 低血药浓度者有1 850例次, 占43.4%; 最低浓度0 ng/mL, 最高浓度 > 1 500 ng/mL。
| 表5 TDM> 20次的血药浓度分布统计 |
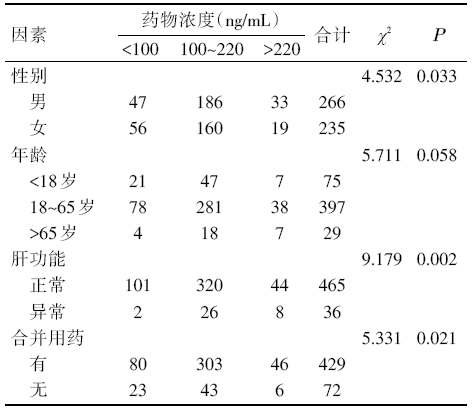
收集501例血液相关疾病患者, 按CsA血药浓度< 100 ng/mL, 100~220 ng/mL和> 220 ng/mL, 区间分类统计, 采用秩和检验单独分析不同因素对CsA血药浓度的影响, 见表6。
| 表6 501例血液病患者的CsA血药浓度在不同影响因素中分布 |
对9 389例/次监测结果分析发现, 从图1结果显示, 绝大多数患者(41.0%)仅仅监测1次, 而监测2次、3次和4次者也仅占16.9%、9.2%、5.9%, 绝大多数患者不能坚持长期监测, 其中的原因有很多, 包括监测程序繁琐, 费用高, 外地病人居多, 不严格遵守医嘱以及对TDM认识不足和缺乏系统的用药调整指导等。由表3、表4和表5可见, 坚持长期监测的患者, 中毒者所占的比例相对减少, 但是血药浓度达标情况仍然不理想, 通过分析以及结合部分文献资料, 将可影响CsA血药浓度的因素归结为以下几点, 患者的性别、年龄、饮食和合并用药等因素都可与影响细胞色素P450(cytochrome P450, CYP450)肝微粒体酶起作用[11, 12]。
患者的性别、年龄以及肝、肾功能影响药物在体内的转化和代谢。有研究发现在使用相同剂量的情况下, 男性和女性CsA血药浓度有显著性差异, 男性患者的CsA血药浓度水平要低于女性患者[13, 14, 15], 老年人的CsA血药浓度值均要显著高于中青年, 肝功能损伤的患者中CsA浓度出现了异常变化, 与肝功能正常的患者有显著差异。CsA主要经肝脏CYP3A4代谢, 文献报道CYP3A4活性具有一定程度的性别二态性, CYP3A4的活性女性高于男性; 肝功能受损或者老年患者的肝细胞萎缩, 肝P450酶数量和活性均会有所下降, 可导致CsA的清除和代谢降低, 造成CsA在体内蓄积, 使其血药浓度增加; 同时, 由于CsA具有肝毒性, 其血药浓度的异常升高致使肝功能受损加重, 从而可能会形成恶性循环[16]。在体内研究性别差异对血液病患者CsA药代动力学的影响时, 从本研究结果看, 与以往研究结果相似, 不同性别CsA浓度的确存在差异, 但在调查的影响因素中显著性最小(χ 2=4.532; Ρ =0.033)。本研究将年龄分为三个阶段, 同时将其测得的CsA浓度分为三个区域, 结果发现不同年龄段的CsA浓度差异不明显(χ 2=5.711; Ρ =0.058), 这可能与标本例数较少有关系。另外, 本研究发现, 在出现肝功能损伤的患者中CsA浓度出现了异常变化, 而这与肝功能正常的患者有显著差异(χ 2=9.179; Ρ =0.002)。
饮食变化可能是CsA血液浓度变化非常重要的因素之一。CsA是脂溶性药物, 当与脂溶性食物尤其是高脂肪性食物(如奶油、黄油、牛奶等)同服时, 可通过增加CsA在肠道的吸收而增加其血药浓度。大多数患者需要长期服用CsA, 在治疗过程中不免会有饮食变化, 特别是脂肪胆固醇类、蛋白质及豆类食物摄入量增加或减少。而像酒、葡萄(汁)或橘子(汁)这类食物是肝P450酶系统的抑制剂, 若与CsA同服, 则可能会减少CsA的代谢和消除, CsA血药浓度可升高3倍[17, 18, 19]。
药物相互作用也可显著影响CsA的血药浓度。CsA主要是通过肝脏CYP450的CYP3A3/4酶代谢, 任何影响该酶的药物都可能影响CsA的血药浓度[20, 21]。例如大环内酯类抗生素、氟康唑、伊曲康唑、雄激素、罗红霉素、口服避孕药、地尔硫䓬、尼卡地平等可抑制CYP450的活性, 从而阻断CsA在肝脏内的代谢, 使CsA血药浓度升高。苯巴比妥、利福平、苯妥英钠、卡马西平、噻氯匹定等为肝药酶诱导剂, 可增强CYP450酶的活性, 从而降低CsA的血药浓度。另外, 其他凡可改变胃排空速率及促进胆汁排泄的药物, 也可改变CsA的体内过程, 与CsA发生相互作用, 可能会增加或降低其疗效和毒性反应。从我们收集的数据来看, 合并用药的影响也比较显著(χ 2=5.331; Ρ =0.021), 如在发生真菌感染时, 会使用氟康唑或伊曲康唑等抗真菌药物, 存在合并用药。
CsA口服吸收不规则, 存在个体差异, 且其主要经由肝脏P450微粒体酶分解代谢, 因此给药剂量、胃肠功能、P450肝微粒体酶缺陷或功能受损等因素, 都可能影响CsA的血药浓度。其中编码药物代谢酶、药物转运体的药物作用靶点的基因序列不同是引起同一种药物相似剂量在不同个体间产生不同反应的重要原因, 药物代谢酶和药物转运体的基因改变了它们在体内的表达和活性, 产生了不同个体药物代谢酶和药物转运体对其作用底物的代谢、吸收、分布的影响差异, 造成了个体间药物治疗作用和不良反应的不一致。CsA主要通过包括CYP3A4、CYP3A5在内的CYP3A亚家族进行代谢, CYP3A是CYP450酶的一个亚家族, 主要分布在肝和小肠, 是参与药物代谢和口服药物首过效应的主要酶系[22]。CsA在小肠中即有部分被CYP3A4代谢, 进入体内后在肝脏由CYP3A4和CYP3A5完成其氧化还原反应。Xue等[23]的一项针对636例肾移植患者的研究指出, 地尔硫䓬(CYP3A抑制药)可使CsA的血药浓度增加而剂量降低。由CYP3A4和CYP3A5个体差异所致的CsA血药浓度和代谢差异, 涉及CsA临床用药和不良反应的发生。在中国汉族人群中, CYP3A4的活性个体间差异达14倍。CYP3A4的活性与其mRNA表达量呈正相关, 提示可能主要在转录水平上调控CYP3A4的活性, 而CYP3A5的差异主要由单核苷酸多态性引起[24]。
依从性是保证血药浓度监测有意义的一个重要因素。某些患者不能严格依从医嘱疗程, 不能够遵从正确的服用方法, 服药时间的随意性较大, 未按时服药、漏服药物, 擅自减量或停服, 均可导致血药浓度监测无意义。
取样时间正确与否, 直接关系着血药浓度的测定结果。一个对临床有指导意义的血药浓度数据, 采血时间的选择很重要。正确的采血时间应在患者用药达稳态后取血, 一般经5~6个药物半衰期达稳态。峰浓度和谷浓度能够帮助医生判断用药过量或不足, 若怀疑病人中毒, 在病人服药后峰浓度或出现中毒症状时采血为宜; 若怀疑药物疗效不佳, 在谷浓度时采血为宜; 判断病人依从性则在服药后稳态后任意时刻采血。在研究中由于CsA浓度的突然升高, 调查了少部份服药患者的采样时间, 存在把峰浓度当成谷浓度来做检测。
综上所述, CsA在临床上受多种因素干扰, TDM工作需要实验室与医生、护士的密切配合, 正确地解释和利用血药浓度结果, 真正发挥TDM在个体化用药中的作用。对于异常数据, 临床药师应根据患者的饮食、服药依从性、合并用药、监测方法及近期的生理、病理状态等多方面考虑, 如发现存在上述诱因, 应首先尽量去除诱因, 同时可在这期间调整剂量, 一旦诱因去除, 要及时进行环孢素浓度检测, 实时调整给药剂量; 对于合并用药及体重增减等短期内无法去除的诱因, 我们可以根据新的参数和检测结果重新制定个体化给药方案。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|