作者简介:
金田恩和黄嘉为共同第一作者。金田恩(1989-),男,广东汕头人,医学硕士,主治医师,主要从事乳腺肿瘤病理诊断和基础研究工作;黄嘉(1990-),女,广州人,文学硕士,中级教师,主要研究公共卫生管理学。
目的 检测肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)和乳腺癌新辅助治疗疗效病理完全反应(pathological complete response,pCR)的关系及TILs在乳腺癌新辅助治疗前后的动态变化情况。方法 收集2014年1月至2018年12月广州医科大学附属肿瘤医院100例乳腺癌新辅助治疗前后配对石蜡标本696块;H&E染色手工评价TILs水平;SPSS 22.0软件分析TILs对pCR的预测作用及TILs在新辅助治疗前后的动态变化。结果 二元回归分析模型示总区域TILs(OR 1.182,95%CI 1.030~1.358, P=0.018)和肿瘤区域内TILs(OR 1.727,95%CI 1.137~2.622, P=0.010)具有很好的pCR预测价值。总患者中(100例),新辅助治疗前后TILs在总区域( P<0.000 1)、间质区域( P<0.000 1)、肿瘤内区域( P=0.057)均显著升高。结论 全区域TILs、肿瘤内区域TILs可预测乳腺癌新辅助治疗pCR。新辅助治疗可促进乳腺癌患者肿瘤区域TILs免疫浸润。
Objective This study is to investigate the relationship of tumor-infiltrating lymphocytes and pathological complete response (pCR) to neoadjuvant treatment(NAT) in breast cancer, and to observe the dynamic change of TILs between pre- and post-NAT.Methods A total of 100 cases of breast cancer with 696 paraffin blocks were collected between January 2014 and December 2018 in Affiliated Cancer Hospital & Institute of Guangzhou Medical University. TILs was evaluated by pathologists on H&E sections. SPSS 22.0 was used to detect the predictive value of TILs to pCR and the dynamic change of TILs between pre- and post-NAT.Results Bivariate regression analysis indicated that Total TILs (OR 1.182,95%CI 1.030~1.358, P=0.018) and Intratumoral TILs (OR 1.727, 95%CI 1.137~2.622, P=0.010) were statistically significant and independent predictors of pCR. Otherwise, the Total TILs( P<0.000 1), Stromal TILs( P<0.000 1)and Intratumoral region TILs( P=0.057)in pre-NAT tissue were significantly higher than those in post-NAT.Conclusions Total TILs and Stromal TILs could be predictive factors for pCR to NAT in breast cancer. Meanwhile, NAT could promote Stromal TILs in breast cancer.
肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)[1]是主要存在于肿瘤间质和肿瘤细胞区域内以T细胞为主, 同时含有少量B细胞和NK细胞的一个异质性淋巴细胞群体, 其主要作用是通过细胞免疫的方式在肿瘤组织中发挥抗肿瘤效应。
证据表明乳腺癌新辅助治疗(neoadjuvant treatment, NAT)后的病理完全反应(pathological complete response, pCR)与全身低复发风险密切相关[2]。辅助治疗临床试验的设计需等待数年才能得到结果用于指导临床, 与传统实验终点相比, 采用pCR作为替代性的预测远期疗效的生物标志物将有效的缩短实验周期, 并能准确的反映新疗法在乳腺癌治疗过程中的作用。
与此同时, 在乳腺癌NAT中, 发现TILs能预测即时疗效。TILs与乳腺癌预后之间的关系在20世纪90年代初由Aaltomaa等首次报道[3]。Carsten Denkert等分析了德国6项乳腺癌NAT临床试验中3 771例患者TILs浸润情况[4], 发现乳腺癌中TILs高浸润水平能够预测NAT疗效, 并且在HER-2阳性和三阴型乳腺癌患者中, 与患者的长期生存有关。2010年, Denkert等进一步证明治疗前穿刺活检的淋巴细胞浸润预测了蒽环类/紫杉类新辅助化疗的pCR[5]。而在我们亚裔人群中, TILs对乳腺癌新辅助疗效预测也存在相似的结论, 然而相关的研究依然较少[6]。所以本研究通过分析100例乳腺癌NAT前后配对石蜡标本, 探讨TILs和乳腺癌NAT疗效pCR的关系, 并揭示TILs在乳腺癌NAT前后的动态变化情况。
本研究收录了2014年1月至2018年12月在广州医科大学附属肿瘤医院行NAT的106例无远处转移的乳腺癌患者。NAT为标准化疗联合或者不联合HER-2靶向治疗。最终有100例符合标准并且有充足组织的患者纳入本研究。此研究经广州医科大学附属肿瘤医院伦理委员会批准, 每位纳入本研究的患者签署知情同意书。收集这100例患者的临床资料, 包括一般临床特征, 病理资料, 新辅助化疗方案和周期, 新辅助化疗疗效评估等。一般临床特征包括:年龄, 性别, 月经史, 家族史等; 病理资料包括新辅助化疗前后:肿瘤位置和大小, 淋巴结转移状况, TNM分期, 组织分级, 分子分型, HER-2免疫组化弱阳性进一步行荧光原位杂交实验结果。疗效评估主要采取三个指标:①实体肿瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST)1.1版:完全缓解(complete response, CR)所有靶病灶消失, 无新病灶出现, 且肿瘤标志物正常, 至少维持4周; 部分缓解(partial response, PR)靶病灶最大径之和较少≧ 30%, 至少维持4周; 疾病进展(progressive disease, PD)靶病灶最大径之和增加≧ 20%或者出现新病灶; 疾病稳定(stable disease, SD)靶病灶最大径之和缩小未达PR, 或者增大未达PD。②pCR按照严格意义指乳腺原发灶和转移的区域淋巴结均达到病理完全缓解(ypT0/isypN0)。③病理显著缓解(major pathological response, MPR)是指NAT诱导的肿瘤消退在病理上残留肿瘤< 10%, 并记录患者新辅助化疗后手术日期和手术方式。对这些患者进行随访, 随访内容为复发、生存状态(存活/死亡, 如已死亡, 记录死亡时间及死亡原因是否与乳腺癌相关)。
1.2.1 取材:NAT前标本, 利用穿刺直径为0.2 cm的巴德(BARD Magnum)穿刺活检枪穿刺2~4条癌组织, 穿刺后立即福尔马林固定液固定, 制作石蜡块备用。配对的NAT后样本取自手术标本, 将手术切下的肿块按照每层0.5 cm厚度切开后取肉眼所见肿块, 所取组织块较理想的体积为1.5 cm× 1.5 cm× 0.5 cm。取材后1∶ 4~1∶ 20比例福尔马林固定液固定, 备用; 手术标本所留取石蜡块2~30块。取距肿瘤组织约0.5~2 cm范围内组织为癌旁组织, 用作对照分析。
1.2.2 石蜡包埋:按照80%、90%、95%、100%各种浓度乙醇2小时的程序, 脱水机自控完成脱水后, 浸蜡、包埋组织标本。共包埋石蜡组织696块。
1.2.3 H& E片制作:自动切片机上将修过的石蜡片切成厚度为4~6 μ m的组织薄片, 铺片, 贴片, 烤片(60~65℃恒温箱内烤片15~30分钟, 脱去溶化组织间隙的石蜡), 染色(HE染色程序:脱蜡、脱苯、复水、染色、脱水、透明、封固), 封片, 黏贴标签。
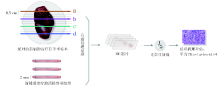
1.2.4 H& E染色片评价TILs:由两位专业病理科医师(广州医科大学附属肿瘤医院谭小军主任医师, 广州达安临床检验中心病理部金田恩主治医师)独立按照国际TILs工作组推荐乳腺癌中标准TILs评价方法进行评价[7]。首先选择整个肿瘤区域, 鉴定肿瘤间质区域(stromal area)和肿瘤内区域(intratumoral area), 然后在低倍镜下观察, 确定炎症浸润类型, 评估肿瘤间质区域和肿瘤内区域TILs的百分含量[7]。例如一个患者有4块石蜡块, 每块石蜡的TILs分别是a、b、c、d, 这位患者平均TILs=(a+b+c+d)/4 (图1)[8]。总TILs=间质区域TILs+肿瘤内区域TILs。
患者的临床资料采用频数和百分率进行描述, 组间TILs含量比较使用秩和检验Mann-Whitney 和Kruskal-Wallis分析。新辅助化疗前pCR患者和未达到pCR(non-pCR)患者之间TILs含量比较采用Mann-Whitney分析方法。持续性变量NAT前总TILs, 间质区域TILs, 肿瘤内区域TILs对pCR的检测敏感度和特异度使用受试者工作特征(receiver operating characteristic, ROC)曲线图。NAT前总TILs, 间质区域TILs, 肿瘤内区域TILs对pCR的预测使用单因素和多因素二元Logistic回归。TILs的NAT前后动态变化使用Wilcoxon秩和检验。本研究统计数据分析使用SPSS 22.0 (SPSS, Inc., Chicago, IL.)。以双侧检验P< 0.05定义为差异具有统计学意义; * 表示P< 0.05、* * 表示P< 0.01、* * * 表示P< 0.001、* * * * 表示P< 0.000 1。图片的制作使用GraphPad Prism 8.0 软件。
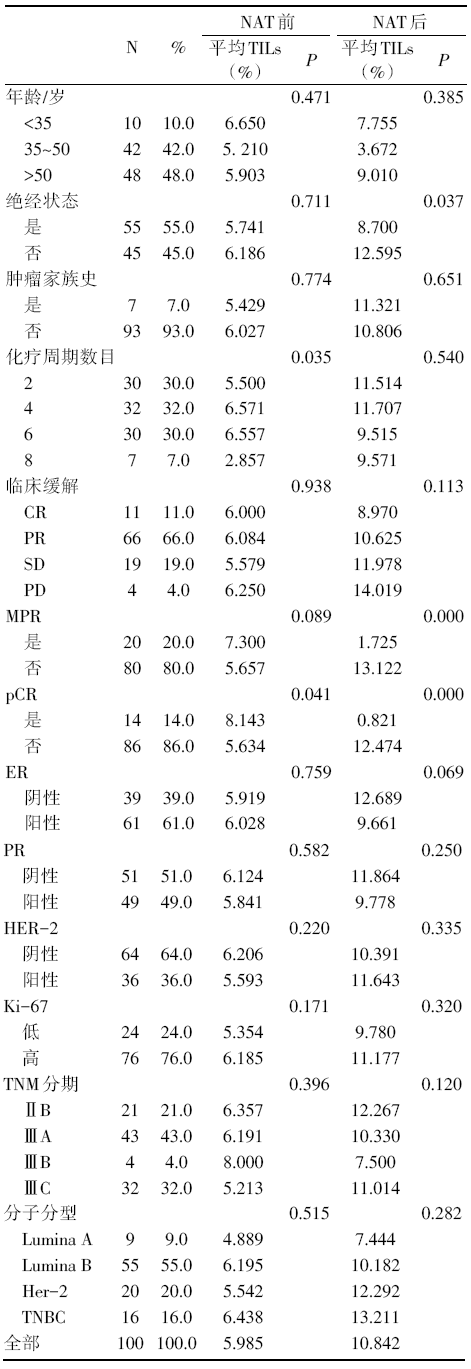
筛选106例患者, 100例患者拥有充足的配对组织标本用作病理TILs分析, 平均随访时间2.9年。100例患者中小于35岁的10例, 35~50岁42例, 大于50岁48例, 平均年龄49.7岁, 年龄跨度23~76岁; 停经55例, 未停经45例; 7例具有家族肿瘤病史; 新辅助化疗方案为EC 序贯T(吡柔比星/表柔比星序贯脂质体紫杉醇或者多西他赛)或者TEC(吡柔比星/表柔比星+脂质体紫杉醇或者多西他赛+环磷酰胺), 2~8个疗程; 按照RECIST 1.1标准评价达CR患者11例, PR患者66例, SD患者19例, PD患者4例; 20例患者达MPR, 未达MPR者80例; 达pCR患者14例, non-pCR患者86例; ER阳性39例, 阴性61例; PR阳性51例, 阴性49例; HER-2阳性36例, 阴性64例; Ki-67表达低于20%的24例, ≥ 20%的76例; TNM分期, Ⅱ B期21例, Ⅲ A期43例, Ⅲ B期4例, Ⅲ C期32例; 分子分型, Lumina A型9例, Lumina B型55例, HER-2型20例, TNBC型16例。新辅助化疗前总TILs百分比pCR对比non-pCR患者具有显著差异(P=0.041); 新辅助化疗后总TILs百分比绝经对比非绝经患者(P=0.037)、MPR对比非MPR患者(P=0.000)、pCR对比non-pCR患者(P=0.000)具有显著统计学差异, 具体入组患者基线特征情况见表1。
| 表1 临床资料病理特征与NAT前后组织TILs的关系 |
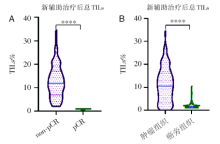
在NAT前标本中, pCR患者TILs浸润水平高于non-pCR患者。在NAT前标本中, 平均总TILs百分比是6.0%, 其中肿瘤内TILs 是1.585%, 间质内TILs是4.4%。non-pCR患者总TILs浸润较pCR患者少, 二者比较具有统计学意义(P=0.041)(图2; 图3A)。pCR患者较non-pCR患者间质内TILs和肿瘤内TILs均有增加, 统计学P值呈现临界值(P=0.051, P=0.074)。
 | 图3 100例乳腺癌样本中总TILs、间质区域TILs、肿瘤内区域TILs的变化情况 A:新辅助治疗前non-pCR和pCR患者样本中总TILs、间质区域TILs、肿瘤内区域TILs 比较; B、C、D:新辅助化疗前总TILs、间质区域TILs、肿瘤内区域TILs 对pCR预测的受试者工作特征曲线图; E、F、G:总患者、non-pCR、pCR患者不同空间分布区域新辅助化疗前后TILs动态变化情况 |
ROC曲线分析, 连续性变量新辅助治疗前样本总区域TILs、间质区域TILs、肿瘤内区域对pCR预测的AUC值(area under curve, 曲线下面积)分别为0.669、0.655、0.636 (P=0.042, P=0.064, P=0.104) (图3B、C、D)。
单因素和多因素二元回归模型同样显示TILs水平对pCR的良好预测能力。为了进一步检测TILs水平对NAT的pCR的预测能力, 先对NAT前样本全区域TILs、间质区域TILs、肿瘤内区域TILs及临床重要指标Ki-67、ER、年龄、化疗周期单因素二元回归。可见总区域TILs、肿瘤内区域TILs水平、Ki-67表达对pCR具有预测价值, 比值比(odds ratio, OR)分别是(1.143、1.762、0.271), 95% CI 分别是(1.007~1.297、1.112~2.791、0.073~1.011), P值分别是(0.039、0.016、0.052)(表2)。将单因素二元回归分析中P值小于0.2的指标纳入多因素回归中分析。因为总区域TILs和肿瘤区域内TILs具有交互作用, 故分别将总区域TILs和Ki-67、肿瘤区域内TILs和Ki-67纳入多因素二元回归分析模型选用严格的Forward: LR法(以最大局部似然为基础作似然比概率检验, 向前逐步选择自变量)分析。结果显示总区域TILs和肿瘤区域内TILs具有很好的pCR预测价值OR值分别是1.182和1.727, 95%CI 分别是1.030~1.358和1.137~2.622, P值分别是0.018和0.010。
| 表2 单因素和多因素二元回归模型分析TILs水平和临床指标预测pCR |
总患者中(100例), NAT前后总区域(P< 0.000 1)、间质区域(P< 0.000 1)、肿瘤内区域(P=0.057)TILs在NAT前后均显著升高; 提示总体上新辅助化疗刺激并促进了免疫细胞在肿瘤中的浸润(图3E)。
Non-pCR患者中, NAT前后总区域、间质区域、肿瘤内区域TILs在NAT前后均显著升高(P< 0.000 1、P=0.000 1、P=0.000 1)。提示在non-pCR患者中新辅助化疗后肿瘤免疫得到了激活(图3F)。
pCR患者中, NAT前后总区域、间质区域、肿瘤内区域TILs在NAT前后均显著下降(P< 0.000 1、P< 0.000 1、P=0.057)。pCR患者NAT后标本中肿瘤细胞全部凋亡吸收, 治疗前肿瘤组织区域被纤维化组织替代, 残留有少量的免疫细胞(图3G)。
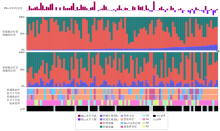
图4显示了TILs在NAT前后的全景图, 此图以新辅助化疗前TILs从低到高的顺序排列。non-pCR患者主要见于治疗前后TILs水平升高者, pCR患者多见于治疗前后TILs水平下降者。同时NAT前后TILs水平下降的患者主要见于新辅助化疗前TILs水平较高患者人群。不管是NAT前还是NAT后标本, 间质区域TILs均高于肿瘤内区域TILs(图4中深紫色高于浅紫色)。30例患者NAT前后分子分型发生了变化。
本研究采用目前国际推荐的通用的手工评价H& E染色图片, 揭示了乳腺癌NAT前TILs水平和NAT pCR的密切关系, 及其TILs在乳腺癌NAT前后的空间分布动态变化特征。
研究结果和国际乳腺癌肿瘤免疫标志物工作组、剑桥大学的C. Caldas教授[9, 10]等既往的研究结果相一致, 均提示肿瘤免疫细胞浸润的水平与乳腺癌治疗的良好反应相关; 这表明在NAT之前, 活性免疫细胞的富集可能对肿瘤细胞的清除更为重要。这部分数据也为日后进一步探索TILs亚群的分布特征和预测功能奠定了基础。
TILs在NAT前后动态变化。本研究发现, 与pCR患者相比, non-pCR患者的NAT后样本中TILs的频率明显更高(图5A), 而在pCR患者原发肿瘤区域大部分的被纤维组织代替, 仅残留及少量的炎性细胞, 有研究认为这是残存在组织里的记忆细胞, 又称组织驻地T细胞(tissue-resident memory T, TRM)[11, 12]。我们还发现, 与邻近的非肿瘤组织相比, NAT后癌症的TILs仍然较高(图5B)。
TILs肿瘤组织中间质区域和肿瘤内区域空间分布比例特征。从TILs全景(图4)可以观察到不管是NAT前还是后, 肿瘤间质区域内的TILs水平均高于肿瘤区域内的TILs。而如何将肿瘤间质内的TILs靶向迁移到肿瘤细胞区域内, 是值得研究的一个重要科学问题。
本研究依然存在以下三点不足。一是本研究为单中心、回顾性研究, 样本量有限, NAT疗程数不统一, 平均随访时间是2.9年, DFS和OS数据不成熟。二是本研究暂时未能对影响全身或者局部免疫炎症浸润的干扰因素进行排除, 如新辅助化疗后穿刺疤痕部位局部炎症、皮肤破裂患者局部病灶感染、全身免疫性疾病病史的记录等。三是H& E染色片的评价本身技术的局限性。本研究虽然采用国际通用TILs评价方法, 但是H& E染色片的评价是通过病理医生根据细胞的形态学和染色评价TILs含量, 不但主观性强、效率低下, 且不能区别浸润免疫细胞的功能和类别[10]。
总而言之, 全区域TILs、肿瘤内区域TILs可预测乳腺癌NAT pCR。同时, NAT可促进乳腺癌患者肿瘤区域TILs的免疫浸润。而TILs复杂的组分中究竟哪一亚群是真正抑制肿瘤, 真正能够预测NAT反应则有待后续的研究进一步揭示其内在的机制。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|