作者简介:
王惊华(1988-),女,河南商丘人,医师,医学博士,主要研究方向为血液肿瘤的免疫治疗。
目的 研究分析异基因造血干细胞移植(allo-HSCT)后胰腺相关指标异常患者的临床特征和影响因素。方法 选取2019年3月至2020年6月于广东省人民医院行allo-HSCT的血液肿瘤患者共54例,按照血清淀粉酶指标是否有异常升高分为异常组和正常组,回顾性分析两组性别、年龄、病因、移植前疾病状态、干细胞来源、供受者关系、HLA配型、胆结石病史、高甘油三酯血症病史、高胆固醇血症病史、预处理方案、移植物抗宿主病预防方案、环孢素A浓度水平各项指标和胰腺相关指标异常升高的关系。结果 54例患者中有11例(20.4%)出现了血淀粉酶的升高,其中10例伴有血脂肪酶的升高,有3例(5.6%)确诊为急性胰腺炎。多因素分析结果显示,有高胆固醇血症病史、应用改良全身照射/环磷酰胺预处理方案为导致胰腺相关指标异常升高的独立危险因素( P<0.05)。结论 allo-HSCT患者要重视高胆固醇血症病史的存在和预处理方案的使用,早期采取合理的干预措施,有助于防止急性胰腺炎的发生。
Objective To analyze the clinical characteristics and influencing factors of patients with abnormal pancreatic related indicators after allogeneic hematopoietic stem cell transplantation(allo-HSCT).Methods A total of 54 patients with hematological malignancies underwent allo-HSCT in Guangdong Provincial People's Hospital from March 2019 to June 2020 were selected, and they were divided into abnormal group and normal group according to whether there was abnormal increase of serum amylase. The relationship between gender, age, etiology, disease status before transplantation, source of stem cells, donor recipient relationship, HLA matching, history of gallstone, history of hypertriglyceridemia, history of hypercholesterolemia, conditioning regimen, graft-versus-host disease prevention, cyclosporine A concentration and abnormal elevation of pancreatic related indicators were analyzed retrospectively.Results Among the 54 patients, 11 (20.4%) had elevated serum amylase, 10 of them had elevated serum lipase, and 3 (5.6%) were diagnosed as acute pancreatitis. Multivariate analysis suggested that history of hypercholesterolemia and application of modified total body irradiation/cyclophosphamide regimen were independent risk factors for abnormal elevation of pancreatic related indicators.Conclusions It is important to pay attention to the history of hypercholesterolemia and the application of conditioning regimen of patients receiving allo-HSCT, and it will be helpful to take reasonable intervention measures in the early stage to prevent the occurrence of acute pancreatitis.
异基因造血干细胞移植(allogeneic hemopoietic stem cell transplantation, allo-HSCT)是将供者的造血干细胞移植到受者体内, 以重建受者造血和免疫系统的一种治疗方法[1]。即使在新药时代, allo-HSCT依然是很多血液肿瘤疾病的标准治疗选择。移植后并发症是影响allo-HSCT成功的重要因素, 主要有移植物抗宿主病(graft-versus-host disease, GVHD)、感染、植入功能不良、淋巴增殖性疾病等[2, 3]。关于移植后并发急性胰腺炎的报道不多, 有报道显示其发生率从3.5%到28%不等[4, 5, 6]。然而, 移植术后患者免疫力极低, 加上大剂量免疫抑制剂的使用及感染几率的增加等因素, 使得急性胰腺炎患者病情重、病死率高, 因此需要早期发现和早期干预。
急性胰腺炎的诊断主要依赖于临床表现、血清标志物和影像学检查[7]。由于预处理化疗、感染、GVHD等原因也会导致腹痛、恶心、呕吐等临床表现, 因此单从症状上识别急性胰腺炎相对比较困难。而血清学标志物淀粉酶和脂肪酶指标的异常, 是诊断急性胰腺炎最常用及最简便的指标, 因此我们认为, 早期评估可导致胰腺相关指标异常升高的相关危险因素, 对提早采取相应措施、防止病情进展为急性胰腺炎进而挽救患者生命具有重要意义。目前, 国内外对导致allo-HSCT术后胰腺相关指标异常升高的危险因素的报道仍较少。本研究回顾性分析广东省人民医院allo-HSCT术后早期血清淀粉酶和血清脂肪酶异常升高患者的病例资料, 从多个方面的指标分析各种潜在危险因素, 现报告如下。
选取2019年3月至2020年6月于广东省人民医院行allo-HSCT的血液肿瘤患者共54例, 进行回顾性分析。其中, 男性33例, 女性21例。移植中位年龄34(13~63)岁。髓系肿瘤40例(包括急性髓细胞白血病28例, 骨髓增生异常综合征5例, 慢性粒单核细胞白血病2例, 慢性粒细胞白血病急性变5例), 淋巴系统肿瘤14例(包括急性淋巴细胞白血病13例, 外周T细胞淋巴瘤1例)。其中30例在移植前疾病达到了完全缓解。
急性胰腺炎的诊断标准:①出现腹痛、恶心、呕吐等临床症状; ②血清淀粉酶活性≥ 3倍正常值; ③影像学检查提示胰腺有形态学改变。具备以上任意2条即可确诊[8]。
亲缘供者移植45例(全相合移植16例, 不全相合移植29例), 接受单纯外周血造血干细胞移植者44例, 骨髓和外周血造血干细胞混合移植者10例。
40例患者采用改良Bu/Cy+Flu方案, 具体为:白消安(busulfan, Bu)0.8 mg/(kg· 次), 每6小时1次, 共3天(移植前第8、7、6天); 环磷酰胺(cyclophosphamide, Cy)60 mg/(kg· d), 共2天(移植前第5、4天); 甲环亚硝脲(methylcyclonitrosourea, MeCCNU)250 mg/m2, 1次(移植前第3天); 氟达拉滨(fludarabine, Flu)30 mg/(m2· d)(最多50 mg), 共3天(移植前第6、5、4天)。
14例患者采用改良TBI/Cy方案, 具体为:采取4.5 Gy射线全身照射(total body irradiation, TBI), 共2天(移植前第5、4天); 阿糖胞苷(cytarabine, Ara-C)2g/d, 共5天(移植前第10、9、8、7、6天); 氟达拉滨(Flu)30 mg/(m2· d)(最多50 mg), 共5天(移植前第10、9、8、7、6天); 环磷酰胺(Cy)50 mg/(kg· d), 共2天(移植前第3、2天); 依托泊苷(etoposide, Vp16)15 mg/(kg· d), 共2天(移植前第3、2天)。
采用环孢素A(cyclosporine A, CsA)、霉酚酸酯(mycophenolate mofetil, MMF)和短程甲氨蝶呤(methotrexate, MTX)联合预防GVHD。人类白细胞抗原(human leukocyte antigen, HLA)不全相合亲缘移植和非亲缘移植在预处理过程中加用兔源抗人胸腺细胞免疫球蛋白(anti-human thymocyte immunoglobulin, ATG)。具体为:CsA 2 mg/(kg· d), 如使用唑类药物需减量(-8天开始); MMF 0.5 mg, 每天2次(-8天开始至-1天, 单倍体移植用至+30天); ATG 2 mg/(kg· d), 共3天(-3天、-2天、-1天)。MTX用药方法:+1天用药剂量为15 mg/m2, +3天、+6天、+11天用药剂量为10 mg/m2。
以回输造血干细胞的日期为第0天, 收集所有患者移植术后100天内血清淀粉酶、血清脂肪酶指标, 将患者按血淀粉酶指标是否有异常升高分为异常组和正常组, 比较两组临床资料的差异。并统计针对异常组患者的干预治疗方法、100天内GVHD发生、病情转归及生存情况。
采用SPSS 19.0软件对数据进行统计分析。计数资料以百分率(%)表示, 组间比较采用χ 2检验。将异常组与正常组对比差异有统计学意义的因素纳入Logistic回归模型, 筛选导致胰腺相关指标异常升高的影响因素。以P< 0.05表示差异有统计学意义。
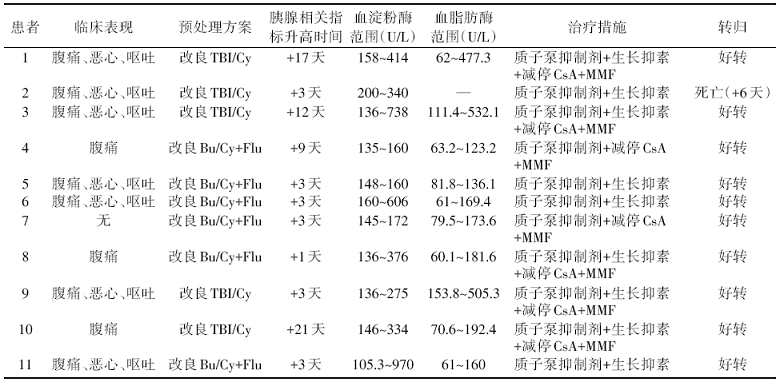
54例患者中有11例(20.4%)发生了血淀粉酶的升高, 其中10例同时伴有血脂肪酶的升高。10例胰腺相关指标异常升高的患者出现腹痛的症状, 其中7例同时伴有恶心、呕吐的症状, 8例有腹部压痛的体征, 有3例(5.6%)患者达到了急性胰腺炎的诊断标准。治疗方面, 予禁食、加强补液、加强抗感染、持续质子泵抑制剂(如奥美拉唑)抑酸的基础上, 9例患者同时予生长抑素(如奥曲肽)抑制胰酶分泌, 7例患者进行了CsA减量或停用的处理, 同时予静脉MMF, 并根据MMF浓度调整MMF用量。经治疗后, 10例患者的临床症状消失、胰腺相关指标恢复正常, 之后恢复CsA或他克莫司的使用, 移植术后100天内未再发生急性胰腺炎或严重GVHD, 其生存情况与未发生胰腺相关指标升高的患者相比无明显差别。3例确诊为急性胰腺炎患者中的1例进展为多器官功能衰竭, 进而死亡。这11例有胰腺相关指标异常升高患者的临床特点、治疗措施及转归情况见表1。
| 表1 11例胰腺相关指标异常患者的临床特点和转归 |
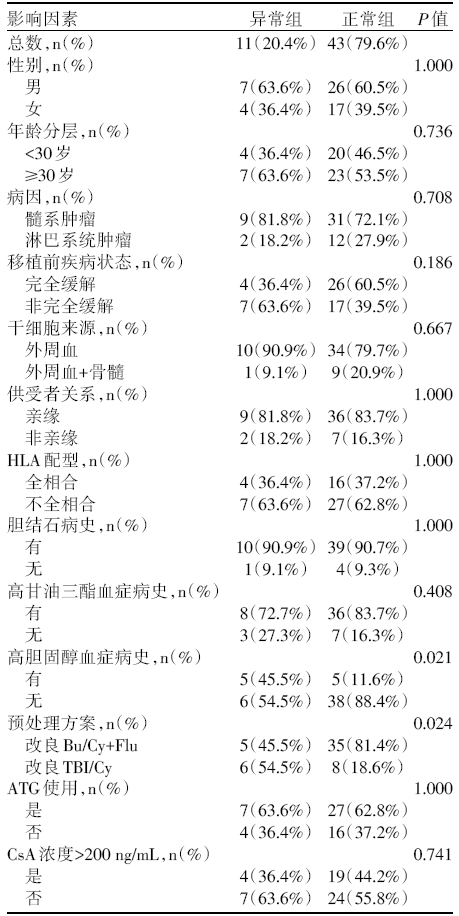
与正常组相比, 异常组有高胆固醇血症病史的人更多(P< 0.05), 接受改良TBI/Cy预处理方案的人更多(P< 0.05)。两组性别、年龄、病因、移植前疾病状态、干细胞来源、供受者关系、HLA配型、胆结石病史、高甘油三酯血症病史、GVHD预防方案、CsA浓度水平比较, 差异均无统计学意义(P> 0.05), 见表2。
| 表2 胰腺相关指标异常升高影响因素的单因素分析 |
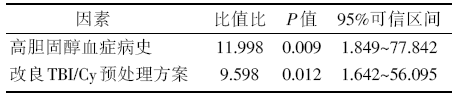
以移植术后是否发生胰腺相关指标异常升高为因变量, 以单因素分析中有统计学意义(P< 0.05)的因素为自变量行Logistic回归分析。结果显示, 有高胆固醇血症病史、应用改良TBI/Cy预处理方案为导致胰腺相关指标异常升高的危险因素(P< 0.05), 见表3。
| 表3 胰腺相关指标异常升高的多因素Logistic回归分析 |
在目前的临床治疗中, allo-HSCT是很多血液肿瘤疾病的有效治疗方法。这种方法虽然能够在一定程度上缓解疾病, 但术后并发症的发生也严重影响患者的生命健康[9, 10, 11]。关于移植后并发急性胰腺炎的报道比较罕见, 整体发生率不高。然而, 由于急性胰腺炎易引起全身炎症反应、多器官功能衰竭, 其病程凶险、病死率高, 因此应尽可能做到早期发现和早期干预[12, 13, 14]。有研究显示, 造血干细胞移植患者死后尸检证实28%患有胰腺炎, 而临床上仅10%能够明确诊断, 说明这种疾病是亚临床型的[6]。血清学标志物淀粉酶和脂肪酶的异常是诊断急性胰腺炎最常用及最简便的指标, 因此, 本研究试图探讨血液肿瘤患者allo-HSCT术后早期出现胰腺相关指标异常的影响因素, 为临床治疗和预防急性胰腺炎的发生提供证据支持。
本研究结果显示, 54例患者中共有11例患者出现了血淀粉酶和/或血脂肪酶的升高, 发生率为20.4%。这11例患者中有1例无腹痛、恶心、呕吐等急性胰腺炎的典型临床表现, 说明胰腺相关指标异常升高可能与临床表现不平行, 因此移植术后定期监测胰腺相关指标是十分必要的。本研究中有3例患者确诊为急性胰腺炎。既往有研究报道儿童造血干细胞移植术后胰腺炎的发生率为3.5%[4], 另有一项报道成人allo-HSCT术后急性胰腺炎的发生率为11.5%[5]。此外, 在一项对184名移植术后死亡的患者进行尸检的研究中发现, 28%的患者存在胰腺炎的情况[6]。本研究中胰腺炎的发生率略低, 可能与术前严格筛选手术适应证及术中术后密切监测胰腺相关指标、发现异常早期采取干预措施有关。即便如此, 仍有1例患者最终进展为全身炎症反应综合征、多器官功能衰竭, 进而死亡。需要说明的是, 本文中报道的这11例患者, 发生胰腺相关指标异常升高时均在移植仓内, 尚处于免疫缺陷期, 故未能完善影像学检查, 未拿到影像学资料。
我们对有可能导致allo-HSCT术后早期胰腺相关指标异常升高的影响因素进行单因素分析, 发现有高胆固醇血症病史、应用改良TBI/Cy预处理方案为导致胰腺相关指标异常升高的危险因素; 多因素Logistic回归分析结果提示, 这二者仍然是导致胰腺相关指标异常升高的独立危险因素。高脂血症指血浆甘油三酯或胆固醇水平升高, 经蛋白电泳后分为5型, 其中, Ⅰ 型和Ⅴ 型以甘油三酯升高为主, Ⅱ 型、Ⅲ 型和Ⅳ 型为单纯的胆固醇升高或同时合并轻、中度甘油三酯升高。研究发现, Ⅰ 、Ⅳ 和Ⅴ 型高脂血症易诱发急性胰腺炎, 而其他类型很少引起。其中Ⅳ 型高脂血症即高胆固醇血症急性胰腺炎的发生率为15%[15]。我们的研究显示, 高胆固醇血症也是allo-HSCT术后早期胰腺相关指标异常升高的独立危险因素。文献中关于放疗对胰腺的损伤也早有报道[16, 17], 但其剂量远超造血干细胞移植预处理方案中全身放疗的剂量。然而, 多药化疗联合同期放疗可能会降低放疗相关损伤的阈值[6], 因此, 这也解释了我们的研究发现改良TBI/Cy预处理方案是allo-HSCT术后早期胰腺相关指标异常升高的独立危险因素。需要说明的是, 全身放疗会导致腮腺损伤, 这也会引起血淀粉酶的升高, 但多在放疗后72小时内恢复正常, 本研究中所观察的血淀粉酶指标变化是移植术后的指标, 已经过了预处理所致淀粉酶升高的阶段, 因此主要与胰腺损伤有关。
既往我们中心报道过一例CsA导致移植后急性胰腺炎发生的病例[18], 在本文的研究中, 我们观察了CsA浓度与胰腺相关指标异常发生的关系, 却未发现二者有关联。查阅国内外文献也未见类似报道。但需要指出的是, CsA的毒性与浓度不成正相关。且在对我们研究中11例发生胰腺相关指标异常的患者的处理中, 大都进行了CsA的减停, 加予MMF针剂, 而有1例死亡患者未进行CsA剂量调整, 因此不排除CsA的使用促进了急性胰腺炎的发生发展, 而这是否与CsA使用的起始时间、患者遗传背景等因素相关, 还需在以后的研究中进一步证实。针对本研究中发生胰腺相关指标异常升高的11例患者, 我们均给予了全身支持治疗、质子泵抑制剂治疗, 大部分患者给予了生长抑素治疗及调整CsA剂量, 最终10例患者临床症状消失、胰腺相关指标恢复正常, 移植术后100天内未再发生急性胰腺炎或严重GVHD, 生存情况与未发生胰腺相关指标升高持续使用CsA的患者相比无明显差别, 有效地避免了该并发症的进展。
综上所述, 有高胆固醇血症病史、应用改良TBI/Cy预处理方案为导致allo-HSCT后胰腺相关指标异常升高的危险因素, 针对此危险因素早期采取干预措施, 并且术后密切监测和动态观察胰腺相关指标, 有助于防止急性胰腺炎的发生, 对提高患者的预后具有重要意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|