作者简介:
黄走方(1982-),男,江西赣州人,医学博士,副主任医师,主要研究方向为白血病的诊疗与预后。
目的 探讨促凋亡基因7(PDCD7)对急性髓系白血病(AML)细胞株Kasumi-1细胞增殖、凋亡的影响。方法 用针对PDCD7基因的小干扰RNA转染Kasumi-1细胞,下调PDCD7基因表达。用MTT法及台盼蓝拒染细胞技术检测细胞增殖;瑞氏-吉姆萨染色观察细胞形态;PI染色流式细胞术分析细胞周期;Annexin V/PI双染色细胞术及Hoechst染色检测细胞凋亡; Western blot法检测凋亡相关蛋白NF-κB、bcl-2和caspase-3的表达。结果 PDCD7-siRNA转染Kasumi-1细胞后,其PDCD7 mRNA表达下调69%,培养后Kasumi-1细胞的增殖、分化、凋亡、细胞周期无明显变化( P>0.05)。结论 干扰PDCD7基因表达没有影响到Kasumi-1细胞的增殖、凋亡。
Objective To investigate the effect of programmed cell death 7 (PDCD7) gene on the proliferation and apoptosis of human acute myeloid leukemia Kasumi-1 cells.Methods We transfected Kasumi-1 cells to down regulate the expression of PDCD7 gene with small interfering RNA. Cell proliferation was detected by MTT assay and trypan. Cell morphology was observed by Wright Giemsa staining. Cell cycle was analyzed by flow cytometry with PI staining. Apoptosis was detected by annexin V/PI double staining and Hoechst staining. Apoptosis related proteins NF-κB, bcl-2 and caspase-3 were detected by Western blot.Results The expression of PDCD7 mRNA in Kasumi-1 cells was down regulated by 69% after transfection of PDCD7 siRNA. The proliferation, differentiation, apoptosis and cell cycle of Kasumi-1 cells did not change significantly ( P>0.05).Conclusion The proliferation and apoptosis of Kasumi-1 cells were not affected by interference of PDCD7 gene.
促凋亡基因7, 又称为程序性细胞死亡因子7(programmed cell death 7, PDCD7), 染色体定位于15q22.31, 编码485个氨基酸多肽链, 可能参与调控细胞的增殖、凋亡。我们在研究预后相差悬殊(诱导治疗后6个月内复发和至少12个月的完全缓解期)的急性髓系白血病(acute myeloid leukemia, AML)患者的基因表达谱差异, 曾用基因芯片技术筛选出包括PDCD7等差异表达的基因[1]。然后用荧光定量聚合酶链式反应(polymerase chain reaction, PCR)检测的97例初诊AML患者的骨髓单个核细胞的PDCD7 mRNA表达水平, 发现在难治AML组PDCD7 mRNA基因表达水平显著升高, 并且, PDCD7 mRNA高表达组的3年总生存率显著低于低表达组[2, 3], 此发现被其他研究者证实[4]。但PDCD7的具体生物学功能尚不清楚, 本研究通过RNA干扰等方法, 初步探讨PDCD7基因在AML细胞中的增殖、分化、凋亡等生物学功能。
Kasumi-1细胞株, RNA逆转录试剂盒(TaKaRa公司), PCR引物(上海英骏公司), PDCD7、bcl-2、caspase3、NF-κ B抗体(Cell Signaling Technology公司), 小干扰RNA(small interfering RNA, siRNA)(上海吉玛制药技术有限公司), 小鼠单克隆抗β -actin抗体、HRP标记二抗(Santa Cruz公司), Annexin V-FITC/PI试剂盒(南京凯基公司)。PDCD7上游引物:5′ -GGAGCAGGAACTCAAAGCAG-3′ , 下游引物:5′ -CGCTGAAGATGATGCGTAAA-3′ , 扩增片段192 bp。β -actin上游引物:5′ -CGGGAAATCGTGCG TGAC-3′ , 下游引物:5′ -CAGGAAGGAAGGCTGGA AG-3′ , 扩增片段186 bp。
1.2.1 细胞培养 常规方法培养Kasumi-1细胞株, 根据细胞生长状态换液, 一般为2天1次, 取处于对数生长期的细胞进行实验。
1.2.2 定量PCR检测PDCD7 mRNA表达 细胞RNA提取后, 逆转录cDNA。PCR循环条件:预变性温度95℃ 20s, 变性温度95℃ 15s, 退火温度60℃ 31s退火, 共40个循环。PDCD7 mRNA相对表达量按2-Δ Ct公式计算, -Δ Ct为目的基因Ct值减去内参基因Ct值。每个实验标本设重复管, 并设空白对照。
1.2.3 Western blot法检测PDCD7蛋白表达 取蛋白进行凝胶电泳, 转移至PVDF膜, 室温封闭1 h。分别加入兔抗PDCD7抗体(1∶ 500)、β -actin抗体(1∶ 1 000), 4℃过夜。洗NC膜, 加入二抗, 室温孵育1.5 h, 再次洗膜, 凝胶成像系统检测蛋白表达量。
1.2.4 合成RNA干扰片段, 细胞转染, 筛选有效干扰片段 根据GeneBank中人PDCD7 mRNA序列设计小干扰RNA(siRNA)及阴性对照(negative control, siRNA-NC)(表1), 合成siRNA和siRNA-NC。利用脂质体将siRNA转染至Kasumi-1细胞, 定量PCR检测PDCD7 mRNA, Western blot检测蛋白表达。为排除转染试剂和其他干扰, 设立转染试剂组和空白组。从4组siRNA中选择PDCD7基因表达最低的实验组进行细胞增殖、分化、凋亡及其细胞转导通路实验。
| 表1 PDCD7的siRNA及阴性对照siRNA序列 |
1.2.5 检测Kasumi-1细胞增殖、分化、凋亡及凋亡通路 应用MTT法和台盼蓝拒染细胞计数法检测细胞增殖率; 瑞氏-吉姆萨染色法和流式细胞术分析细胞周期; Anexin V-FITC/PI双染色流式细胞术及Hoechst33342染色法检测细胞凋亡; Western blot法检测凋亡相关蛋白NF-κ B、bcl-2和caspase-3蛋白表达。
用SPSS 24.0软件分析。PDCD7基因mRNA和蛋白表达用平均数 ± 标准差($\bar{x}$± s)描述。组间比较用单因素方差分析。P< 0.05被认为有统计学意义。
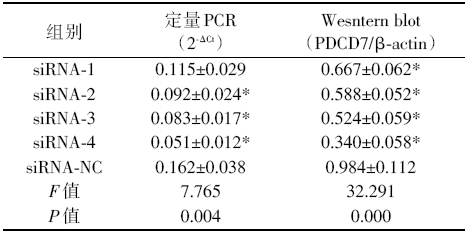
4组siRNA干扰后结果:siRNA-1干扰后, PDCD7 mRNA不显著(P> 0.05); siRNA-2、siRNA-3和siRNA-4干扰后, PDCD7 mRNA与阴性对照siRNA-NC相比, 降低均具有统计学意义(分别为P=0.16, P=0.008, P=0.001)。4组siRNA干扰后的PDCD7蛋白与3组对照相比, 均有显著下降(P< 0.05)。与阴性对照相比, siRNA-2、siRNA-3、siRNA-4的PDCD7 mRNA降低分别为43%、49%、69%, PDCD7蛋白降低分别为40%、47%、65%。siRNA-4干扰后, PDCD7的mRNA和蛋白均下降最多, 被选择为后续实验的干扰片段, 见表2。
| 表2 siRNA干扰对Kasumi-1细胞PDCD7基因mRNA和蛋白的影响 ($\bar{x}$± s, n=3) |
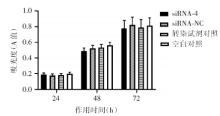
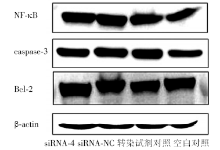
siRNA-4干扰Kasumi-1细胞24、48、72h后, 细胞增殖率与siRNA-NC组、转染试剂对照及空白对照组相比无统计学差异(P> 0.05)(图1); 各组细胞形态未见明显皱缩、染色加深和细胞核缩小; 细胞周期分布无统计学差异(P> 0.05)。流式细胞术和Hoechst 33342染色检测各组细胞早期凋亡率统计学差异(P> 0.05)。siRNA-4作用48h后, 凋亡相关蛋白NF-κ B、bcl-2和caspase-3表达水平与对照组相比无统计学差异(P> 0.05)(图2)。说明经过siRNA-4干扰使PDCD7下调后, Kasumi-1细胞增殖、分化、细胞周期、凋亡及凋亡通路无明显变化。
程序性细胞死亡因子(programmed cell death, PDCD)可通过调控信号通路来控制细胞凋亡, 其基因家族成员众多, 功能也不尽相同。在其家族成员中, 程序性细胞死亡因子1(programmed cell death 1, PD1)的关注热度最高。PD1与其配体结合, 阻断适应性免疫, 在自身免疫性疾病和肿瘤中均发挥重要作用, 是这些疾病的治疗靶点[5, 6]。PDCD7基因作为PDCD家族成员之一, 生物信息学分析显示, PDCD7蛋白表达广泛, 可能具有表面受体、粘附分子功能, 并可调控细胞生长、凋亡, 参与基因转录、钙离子平衡调节等。但其具体功能研究尚少, 现有的研究认为PDCD7与肿瘤细胞的增殖、迁移、预后相关[2, 4, 7, 8]。
台湾学者在口腔癌研究中, 发现PDCD7是miRNA-134的靶点[8]。在稳定表达miRNA-134的口腔粘膜细胞癌中, PDCD7的mRNA和蛋白水平均下调。而在抗miRNA-134的口腔鳞状癌细胞中, PDCD7表达则上调。在口腔癌的多种细胞系中发现, miRNA-134和PDCD7蛋白的表达呈负相关。用顺铂处理口腔鳞状癌细胞, 可诱导细胞凋亡, 但没有改变PDCD7表达, 说明PDCD7没有参与经典的凋亡途径。在转染PDCD7质粒后, 尽管细胞凋亡产物没有增加, 但发现PDCD7可抑制口腔粘膜细胞癌的生长, 使癌细胞增殖和迁移减少。并且, PDCD7通过调节GC盒来增加E钙黏附素启动子活性。将PDCD7敲除后, 细胞增殖和迁移增加, E钙黏附素在mRNA及蛋白水平均减少, 促进癌细胞转移[8]。PDCD7也与口腔癌的预后相关。低表达PDCD7的口腔癌病例组的总生存期和无病生存期均短于高表达PDCD7病例组。此研究低表达PDCD7与不良预后相关, 而我们在AML病例中得出的结论是高表达PDCD7患者组预后不良, 可能的解释是PDCD7在不同肿瘤和组织中的表达差异大以及在不同肿瘤中的功能不尽相同。
韩国研究者在鼠胚胎干细胞中发现了与人PDCD7同源的基因ES18[9]。鼠ES18主要表达在睾丸、淋巴结和胸腺。用地塞米松或葡萄孢霉素(一种广谱蛋白激酶抑制剂)处理的T细胞胸腺瘤凋亡细胞中, ES18的mRNA显著增加。参与地塞米松或葡萄孢霉素诱导的凋亡信号调节子C2神经酰胺, 可诱导ES18转录本。而用地塞米松处理对糖皮质激素耐药的T细胞淋巴瘤细胞株, 并不能诱导ES18基因的表达。并且, 通过TCR/CD3复合体信号的药物和某些蛋白激酶抑制剂, 也不能诱导ES18增加。在细胞凋亡过程, 鼠T细胞淋巴瘤的ES18短暂性过表达。转染过表达ES18基因的质粒的细胞, 有典型的凋亡细胞的形态学特征。放线菌素D可以抑制由ES18诱导的凋亡[9]。因此, 推测ES18参与特异性的凋亡过程, 可能通过转录依赖的机制。
我们前期研究发现PDCD7 mRNA基因表达水平在AML组显著高于非恶性血液病组, 在难治病例组显著高于疗效良好组, 并且高表达组的生存率高于低表达组[2]。此发现驱使我们进一步研究PDCD7的生物学功能, 但本研究PDCD7用RNA小干扰技术, 并没有发现在干扰PDCD7表达后, Kasumi-1细胞的增殖、分化、凋亡及细胞周期受到显著影响, 推测有以下原因:PDCD7并不是控制AML细胞系Kasumi-1增殖、凋亡的主要基因, Kasumi-1可能不是研究PDCD7增殖、凋亡的理想细胞系, 或者干扰基因表达并不足以反映PDCD7基因对Kasumi-1细胞的生长影响, 可能需要使用其他技术如基因敲除, 有待后续进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|