二代测序(next generation sequencing,NGS)已成为中国临床肿瘤医生常用检测工具,而中国超90%临床医生需要NGS报告解读支持。因此,为提升临床医生NGS报告解读能力,特编写了NGS临床报告解读指引,以帮助临床医生梳理NGS报告解读逻辑,快速抓取关键信息,同时尽可能规避过度解读基因组信息导致的潜在危害。本文从临床靶点或驱动基因相关体细胞变异注释及解读、NGS报告解读及临床决策、可报告范围及质量控制等方面详细介绍了NGS报告解读应遵循的恰当的结构化循证原则,正确理解NGS报告的逻辑结构、抓取关键信息并综合分析,为肿瘤患者带来切实的临床获益。帮助医生在综合浏览完一份样本检出的所有分子变异后,结合患者的基本临床信息以及既往或同期其他配对样本检测结果,综合判断患者疾病的全面分子特征谱及其演化过程,了解这些信息所提示的生物学意义和临床意义,最终做出正确的临床决策。
In China, next generation sequencing(NGS) has became a common molecular testing tool used by clinical oncologists, however, NGS clinical reports could be overwhelming for some clinicians who are unfamiliar with NGS. Approximately 90% of clinicians are dependent on external support for the interpretation of NGS reports. In order to improve the clinicians' ability to interpret and derive more information from NGS reports, a working group comprised of clinical oncologists and NGS professionals from all over China have compiled relevant standards and guidelines to equip the clinicians with the knowledge to identify the key information and avoid the over-interpretation of genomic information from NGS clinical reports. This article provides a detailed introduction on the logically structured evidenced-based principles of NGS reports including the interpretation of somatic mutations related to clinical targets or driver genes, the proper interpretation of genomic results to inform clinical decision-making, reportable scope, sample quality control, and other relevant information included in NGS clinical reports. With a better grasp on the information from NGS reports, the clinicians should be able to integrate the basic clinical information, other past or present test results, and the molecular profile of the patient to comprehensively assess the patient's disease and tailor a treatment strategy that will benefit the patient.
目前二代测序(next generation sequencing, NGS)已成为中国临床肿瘤医生常用检测工具, 中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)肿瘤生物标志物专家委员会发布的第1个NGS临床应用调研显示, 大于30%的肿瘤科医生每月NGS检测量超5个, 而中国超过90%临床医生需要NGS报告解读支持。为了提升临床医生NGS报告解读能力, 我们特意邀请全国多个临床肿瘤学专家及NGS检测专业人员, 共同编写了NGS临床报告解读指引, 以帮助临床医生梳理NGS报告解读逻辑, 快速抓取关键信息, 同时尽可能规避过度解读基因组信息导致的潜在危害。对于医生来说, 能否正确理解NGS报告的逻辑结构、抓取关键信息并综合分析, 以实际指导临床决策, 决定了NGS检测能否为肿瘤患者带来真实的临床获益。
每个肿瘤基因组中可能存在数百至数千个体细胞突变, 其中许多是相对个体化的变异。确定通过NGS鉴定出的多个基因变异(genomic alterations, GA)的优先级排序是一项重大挑战。这些基因变异主要包括单核苷酸变异(single-nucleotide variant, SNV/single-nucleotide polymorphism, SNP)、短片段插入/缺失突变(Indel)、重排(融合)、拷贝数变异(copy number variation, CNV)及其他复杂突变等[1]。部分变异出现在生物学及临床相关、甚至是分子治疗潜在靶标的肿瘤基因中, 但并非所有肿瘤相关基因发生的变异均为(潜在)功能性变异, 更多的基因变异尚无明确的生物学和/或临床意义。随着高通量测序分析进入临床领域, 产生了大量数据, 而如何及时、准确的将测序发现的肿瘤基因组变异信息转化为临床医生可读取并用于指导临床决策的结构化循证报告(structured evidence-based reports), 正变得越来越重要[2]。现从以下3个方面对NGS临床报告解读作以指引。
基于NGS技术检测肿瘤体细胞变异的实验流程可概括为以下几个主要环节:样本采集及质量控制、DNA提取、文库制备、测序、基因组数据生成及数据分析。其中, 数据分析可进一步拆解为三个流程:变异识别(variant identification)、变异注释及过滤(variant annotation and prioritization)、变异的临床解读(interpretation of clinical significance)。其中, 变异识别、注释及过滤经由生物信息学工具实现; 而临床解读则需要基于严格的分级逻辑, 整合当前公共数据库及已发表文献的海量信息, 特别是变异-药物敏感性信息, 建立基因变异的临床解读知识库, 最终将与送检样本的对应癌种及检出的基因变异相匹配的临床意义(如药物敏感性信息)及其证据级别呈现在NGS报告中[3, 4, 5]。
目前有多个循证分级系统可用于指导基因体细胞变异的临床解读。包括2017年美国分子病理学协会(Association for Molecular Pathology, AMP)/美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)/美国病理学家协会(College of American Pathologists, CAP)联合制定的体细胞变异解读指南, 2018年欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)发布的分子靶点临床可操作性量表(the ESMO Scale for Clinical Actionability of molecular Targets, ESCAT)以及纪念斯隆-凯特琳癌症中心(Memorial Sloan Kettering Cancer Center, MSKCC)的精准医疗肿瘤数据库(Precision Oncology Knowledge Base, OncoKB)证据等级规则。总体而言, 无论哪个分级系统都遵循一些共性原则, 包括循证、跨癌种处理等, 故其中并无优先推荐者。医生在阅读一份NGS报告时应先了解其变异解读依据的证据分级原则及其采用知识库的局限性, 以帮助自己更好的理解报告内容。
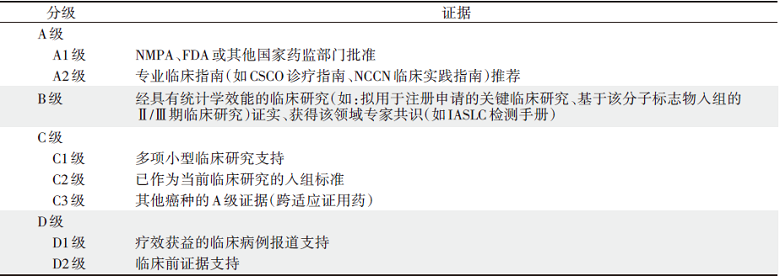
根据2017年AMP/ASCO/CAP联合制定的体细胞变异解读指南[6], 体细胞变异在不同癌种中对应的药物敏感性证据分为四个等级:A级, 美国食品药品监督管理局(Food and Drug Administration, FDA)批准或专业临床指南推荐; B级, 经具有足够统计学效能的临床研究证实、获得该领域专家共识; C级, 其他癌种中的A级证据(跨适应证用药)、或已作为临床试验的入组标准; D级, 临床病例报道或临床前证据支持。体细胞变异对特定肿瘤的诊断及预后价值, 亦给出相应分级:A级, 专业指南中定义的特定肿瘤的诊断/预后因子; B级, 经具有足够统计学效能的临床研究证实其诊断/预后价值; C级, 多项小型研究支持其诊断/预后价值; D级, 小型研究或个案报道提示其辅助诊断/预后价值(独立或联合其他标志物)。
基因变异按照其临床意义的重要性分为四个等级:Ⅰ 类变异, 具有A或B级证据; Ⅱ 类变异, 具有C或D级证据; Ⅲ 类变异, 临床意义不明; Ⅳ 类变异, 已知无临床意义。详见图1。
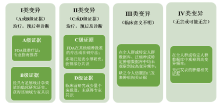 | 图1 AMP/ASCO/CAP指南:基于证据的体细胞突变分类[1] |
该体细胞变异解读指南在国内影响范围最广, 许多第三方NGS检测公司的临检报告即遵循该指南的分级原则对基因变异进行解读, 详见表1。
| 表1 NGS报告体细胞突变-药物敏感性证据分级标准 |
ESCAT是由ESMO转化研究和精密医学工作组(Translational Research and Precision Medicine Working Group, TR and PM WG)发起建立的、基于临床靶标相关证据的基因变异临床分类系统于2018年发表[7]。将基因变异分为六个级别:Ⅰ 级, 可用于常规临床决策的靶点, 如乳腺癌的HER2扩增和非小细胞肺癌(non-small cell lung cancer, NSCLC)的EGFR敏感突变。其中Ⅰ -A级突变是基于前瞻性临床研究已有了显著生存获益的靶标突变类型; Ⅱ 级, 证据表明患者将受益于针对性靶向治疗, 但仍需更多数据证实。如PI3K通路中的AKT1、PTEN突变; Ⅲ 级, 在其他肿瘤类型(而非该患者肿瘤类型)中已证实临床获益的靶标性基因变异。如NSCLC以外肿瘤中的EGFR 19del突变; Ⅳ 级, 仅有临床前证据支持靶标性的基因变异; Ⅴ 级, 有证据表明针对此类变异的靶向治疗可获得客观缓解, 但缺乏有临床意义的生存[无进展生存期(progression-free survival, PFS)或总生存期(overall survival, OS)]获益, 或可支持联合治疗策略; Ⅹ 级:已证实缺乏临床价值(而非“ 尚无证据支持” ), 不应影响临床决策。
OncoKB是由MSK癌症中心维护的精准医疗肿瘤数据库。该数据库旨在提供详细的、基于证据的基因组变异相关信息, 以帮助临床医师进行治疗决策。数据基于FDA、NCCN、ASCO指南等权威资料及其他科学文献、以及疾病专家小组的建议, 对不同变异的药物预测价值进行证据分类[8]:1/2级, FDA认可、或被认为是临床标准(standard of care, SOC)生物标志物, 可预测在特定疾病背景下对已获批药物反应的变异; 3级, 基于对临床试验中待测目标药物的有希望的临床数据, 被认为可预测药物反应的变异; 4级, 根据对临床试验中待测目标药物的令人信服的生物学证据, 被认为可预测药物反应的变异。
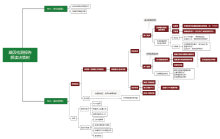
一份结构化循证报告的背后, 需要基于特定逻辑建立临床解读知识库框架, 并通过对开源知识库及海量科学文献的信息甄别、分级、编辑, 不断完善机构内部临床解读知识库。通过生物信息分析流程将基因变异识别、注释、过滤后, 可报告变异进入临床解读知识库进行变异、癌种、证据匹配, 最终形成可读的结构化NGS临床报告[9]。最终对其进行解读及实施临床决策, NGS报告解读决策树详见图2。
当医生面对一份体细胞变异“ 全阴报告” (即一份样本未能检出任何肿瘤体细胞突变)时, 应首先考虑以下两点:
(1)送检样本是肿瘤组织、外周血循环游离DNA(circulating free DNA, cfDNA)或其他; 结合样本质控信息及患者治疗史, 综合判断样本中是否含有足够肿瘤成分, DNA总提取量和/或肿瘤占比是否可能低于NGS的LOD;
(2)选择的NGS panel(尤其是仅包含数个至数十个基因热点区域的小panel)是否与患者的肿瘤类型相匹配, 即该肿瘤常见变异是否能被该panel覆盖。
以上评估可以帮助我们判断, 该“ 全阴” 结果是提示“ X基因野生型” 可能性大, 还是“ X基因状态未知” 可能性大。比如一份血检全阴报告, 采用panel针对泛癌设计、覆盖上百基因的热点区域, 对目标癌种常见变异的覆盖度> 90%, 此时的全阴, 很可能仅提示肿瘤全身负荷较低或其他原因(如患者正接受有效的抗肿瘤治疗)导致释放入血的循环肿瘤DNA(circulating tumor DNA, ctDNA)含量极低、未达检测平台的LOD。这种“ 全阴” 不能反映肿瘤基因组变异状态, 仅能提示“ 基因突变状态未知” 。当然, 这种血检全阴报告可以提供突变谱以外的其他信息, 在特定场景下提示一定的预测、预后价值。
医生在拿到一份NGS阳性报告时, 可能对其中检出的突变/重排的丰度(allele frequency/fraction, AF)及CNV的拷贝数(copy number, CN)存在疑问。基于不同的样本类型, 对AF及CN的理解可能存在一定差异。
2.2.1 基于组织样本的NGS检测
首先对AF绝对数值的解读。对于组织检测结果, 可以基于如下公式, 根据X基因突变(或重排)的AF以及样本中的肿瘤占比, 粗略判断该变异在肿瘤中的克隆占比:
X基因变异AF = 肿瘤占比 × 肿瘤中X变异克隆占比 × 0.5 (杂合突变) [或1.0 (纯合突变)/中性拷贝数LOH]。
一般情况下, 肿瘤细胞中的突变, 尤其是癌基因突变(如EGFR、KRAS活化突变, ALK、ROS1重排)以杂合突变存在; 但上述公式未考虑潜在的拷贝数变异(比如EGFR 19del伴扩增)的影响。而抑癌基因的功能缺失性(loss of function, LOF)杂合突变, 则可能由于杂合性缺失(loss of heterozygosity, LOH)的存在而影响克隆占比的估算。拷贝数为2的LOH(中性拷贝数LOH)可类比纯合突变进行肿瘤克隆占比的估算, 而拷贝数缺失的LOH则更加复杂。例如, 一份晚期肠癌组织样本中, 检出NTRK1重排(不伴CNV), AF为10%; 而病理评估提示该样本肿瘤占比约为50%; 根据公式计算(考虑为杂合突变), 携带NTRK1重排的肿瘤细胞仅占所有肿瘤细胞约40%, 提示NTRK1重排仅存在于肿瘤的一个亚克隆。当然, 用于病理评估的样本仅为一张切片, 不能完全代表检测样本整体; 且病理评估还可能受局部肿瘤坏死等因素干扰, 故病理评估结果仅供参考, 由此推算出来的变异克隆占比与实际情况可能存在一定偏差。而当样本无法进行病理评估时(比如病理蜡卷标本), 则只能以该样本中检出变异的最高突变丰度(maxAF)来反推可能的肿瘤占比。比如一份肠癌样本中同时检出KRASG12D突变、SMAD4突变和NTRK1重排, KRAS突变作为maxAF丰度为25%, 反推该样本肿瘤占比约为50%, 以此为基础评估NTRK1重排的克隆性。
其次对AF相对数值的解读。组织样本中不同变异的相对丰度同样可以提供很多信息。比如一份肺癌组织样本中, 同时检出EGFR 19del和ALK重排, 二者相对丰度为5∶ 1; 结合患者既往EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)长期治疗史, 我们有较大把握推断, 该ALK重排为获得性耐药机制, 而非EGFR/ALK双原发肿瘤。而大样本研究显示, 晚期肠癌患者cfDNA样本中检出的可靶向TRK重排(融合)多以亚克隆形式存在, 即对比主干突变maxAF的相对丰度低于50%。
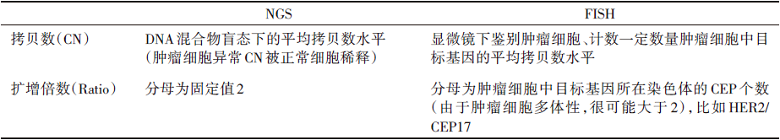
最后对CNV的解读。CNV及基因组上部分区域的扩增或缺失。面对NGS一份报告, 首先需要注意CNV有不同的报告形式, 最常见的包括拷贝数(copy number, CN)及扩增倍数(ratio)。前者即一份样本提取的DNA混合物(包含肿瘤DNA及非肿瘤来源DNA)中检出的某基因的平均拷贝数(正常CN为2); 后者即前者与2的比值。基于NGS检测得到的CNV的非校正CN或ratio值与荧光原位杂交(fluorescence in situ hybridization, FISH)检测得到的CN值或ratio值之间存在较大差异, 详见表2。
| 表2 CNV不同报告形式:NGS vs. FISH |
在已知肿瘤细胞占比的情况下, 可通过以下公式粗略换算目标基因的肿瘤细胞CNV(即校正CNV):
报告CNV = 校正CNV × 肿瘤占比 + 2 × (1-肿瘤占比)。
假设肿瘤细胞中目标基因CN为20, 当肿瘤占比仅为10%时, 实际检出CN值仅约为3.8。由于正常DNA的稀释作用, 当一份样本中肿瘤占比低于20%(即maxAF< 10%)时, CNV的检出敏感性显著降低。
2.2.2 基于外周血cfDNA的NGS检测
NGS血检, 检测对象是血浆中的cfDNA。虽然科研领域人们可以通过一些方法(比如根据cfDNA片段长度的差异)评估ctDNA的实际含量, 但在实际临床应用及大多数科研发表中, 仍以血浆样本中检出体细胞变异的maxAF作为ctDNA含量的替代指标[10]。可针对某一肿瘤患者进行不同临床节点的血检动态监控, 以maxAF反映外周血ctDNA含量的动态变化, 以此反映全身肿瘤负荷变化、预测治疗效果及生存预后。比如, 对于初诊晚期肿瘤患者, 基线的ctDNA含量高低与全身肿瘤负荷相关; 而治疗开始后(3~8周)ctDNA的早期变化趋势可预测当前治疗的总体效果, ctDNA快速清零预示更长的PFS及OS。这种变化趋势比影像学评估更加快速敏感, 比如影像学评估同为SD的患者, ctDNA早期清零与长PFS显著相关; 免疫治疗假性进展的患者, 治疗初期即表现为ctDNA快速下降甚至清零[11]。由于多数肿瘤患者外周血maxAF< 10%, 所以外周血检测对CNV的检测敏感性明显低于突变、重排等变异形式。
根据不同NGS panel的可报告范围, 一份NGS阳性报告中的变异可能有多有少。对于不同情况, 临床医生应采取不同的解读逻辑流程。对于多基因变异、特别是多个潜在驱动变异共存的情况, 要结合肿瘤类型、既往治疗史、相对突变丰度、既往分子检测结果等信息综合判读, 以推测不同变异之间的逻辑关系(原发性vs. 获得性, 主克隆vs. 亚克隆, 敏感克隆vs. 耐药克隆), 指导后续治疗。
当无配对样本(白细胞或正常组织)时, 肿瘤样本(tumor only)的检测在变异注释及过滤过程中, 需要建立生物信息学算法, 以有效区分肿瘤体细胞突变和胚系突变, 确认并过滤胚系多态性。如同时检测配对样本, 则可明确区分体细胞突变和胚系突变。对检出的胚系突变, 应参照ACMG推荐的胚系突变解读流程进行注释及解读[12]。基于当前证据, 胚系变异的致病性分为5级:5级, 致病; 4级, 可能致病; 3级, 意义未明(VUS); 2级, 可能不致病; 1级, 不致病。仅有4/5级胚系变异具有相应的临床指导价值。比如谈及PARP抑制剂与BRCA1/2胚系突变的相关性, 或BRCA相关卵巢癌-乳腺癌的风险评估, 均默认仅针对4/5类BRCA1/2突变。
2.5.1 肿瘤突变负荷
肿瘤突变负荷(tumor mutation burden, TMB)即肿瘤基因组编码区包含的非同义突变的数量或密度(突变数/Mb), 是肿瘤新抗原负荷的替代指标, 过去以全外显子组测序(whole-exome sequencing, WES)作为评估的金标准。目前基于NGS大pane检测的TMB已可达到与WES的高度相关并在大量免疫治疗临床研究中证实其对疗效的预测价值[13]。目前, 业界对组织TMB检测有几点共识:①编码区覆盖大于1 Mb(大概相当于300个以上基因的全外显子区域); ②基于经过验证的可靠生物信息分析算法。同一份样本采用不同检测平台、不同大panel、不同的生物信息学算法, 都可能导致TMB绝对数值的差异。因此, 在缺少桥连试验的前提下, 直接采用某一家公司/产品(如FoundationOne® CDx)的肿瘤突变负荷高(TMB high, TMB-H)界值(cut-off)来定义其他检测产品的TMB-H是不合适的[14]。同时还应注意, 对TMB的准确评估(无论基于组织或血浆cfDNA样本)建立在样本满足一定肿瘤占比的基础上, 肿瘤占比过低将导致TMB的严重低估。因此, 医生在拿到一份NGS报告, 看到TMB数值时, 应综合考虑以下因素:选择的panel(有无准确测算TMB的能力)、检出的肿瘤突变谱及其突变丰度(肿瘤占比是否足以评估TMB、突变谱特征与TMB高/低的组合是否合理)、TMB绝对值以及该数值在已检测的肿瘤样本中的相对排序等, 综合评估TMB水平及其可信度。
2.5.2 微卫星不稳定性
微卫星不稳定性(microsatellite instability, MSI)MSI/错配修复(mismatch repair, MMR)检测对于多种实体瘤患者具有重要临床意义。过去以多重荧光聚合酶链式反应(polymerase chain reaction, PCR)毛细管电泳法作为MSI检测的金标准, 基于美国国家癌症研究所(National Cancer Institute, NCI)推荐的5~7个经典微卫星位点, 对比肿瘤细胞与正常细胞的检测结果, 以确定肿瘤细胞的MSI状态[15]。近年来, NGS panel开始用于MSI检测, 使用计算工具同时研究基因组上的大量微卫星序列成为可能。且多数NGS-MSI算法采用正常人长度分布模型, 无需正常组织作对照。一个NGS panel需要整合一定数量的有效微卫星位点、构建相应的MSI算法并经过临床样本验证, 才能准确报告MSI状态[16]。对MSI的准确评估同样也建立在一定肿瘤占比的基础上。对于MSI检测结果, 应综合样本肿瘤占比(可参考肿瘤突变丰度)、TMB水平[微卫星高度不稳定性(MSI-high, MSI-H)的肿瘤往往TMB-H]、肿瘤突变谱特征(MSI-H可由MMR基因失活性突变导致, 且基因突变谱往往以Indel为主)等信息综合分析, 判断其可信度[17]。
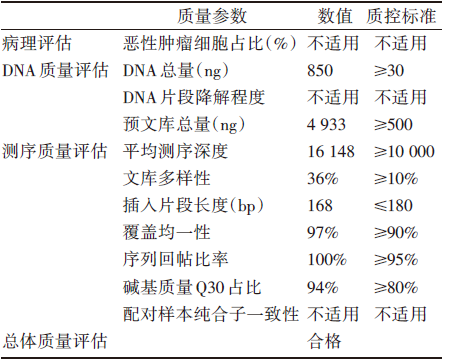
当临床医生拿到一份NGS报告时, 应关注其样本主要质控参数、可报告范围(检测内容)、检测方法及其局限性等相关内容, 具体示例详见图3及表3。相关内容可能部分位于报告首页后(如检测内容概述), 而更多详细信息则以附录形式出现在报告主体内容后, 故往往容易被忽略。但一份报告的结果是否真实可信, 或者是否能够回答临床医生最关心的问题, 恰恰严重依赖于这些看似不起眼的“ 附加信息” , 包括检测方法、可报告范围(检测内容)、质控参数、局限性说明等。
| 表3 NGS报告中的样本主要质控参数示例 |
还有一点需要注意, 不同变异形式的检出对样本肿瘤DNA含量的要求是不同的, 换句话说, 在相同的DNA投入量和肿瘤占比的前提下, NGS检测对突变、重排、CNV、TMB及MSI状态的检测敏感性不同。比如一份福尔马林固定石蜡包埋(formalin-fixed paraffin-embedding, FFPE)样本的肿瘤占比评估约为15%(或maxAF< 10%), 对于基因突变、重排检测及TMB估算来说为合格样本, 但对CNV、MSI的检测敏感性则可能受限。此类信息的获得依赖于对报告“ 局限性说明” 的仔细阅读。
NGS报告端能否遵循恰当的结构化循证原则, 形成可读性较强的临床报告; 临床医生能否正确理解NGS报告的逻辑结构、抓取关键信息并综合分析以指导临床决策, 决定了NGS检测能否为肿瘤患者带来切实的临床获益。无论报告模板如何, 无论遵循哪个具体的变异临床解读逻辑, 任何一份NGS报告的解读结果都不应抵触药物说明书或专业临床指南。医生在拿到一份NGS报告后, 不应拘泥于一条条检测报告结果本身, 而应抽提出具体信息, 整合到患者的实际临床背景中去讨论。医学强调循证, 也强调个体化, 临床医生应在综合浏览完一份样本检出的所有分子变异后, 结合患者的基本临床信息以及既往或同期其他配对样本检测结果(如果有), 判断患者疾病的全面分子特征谱及其演化过程, 联系这些信息提示的生物学意义和临床意义后给出临床决策建议, 而不是机械地仅仅基于报告检出的证据级别最高的基因变异给出对应用药推荐。对于复杂情况应鼓励采取多学科讨论(如分子肿瘤专家组, Molecular Tumor Board, MTB)的形式辨析不同变异组合的生物学意义和临床意义[18, 19]。
附录:名词解释
• AF/MAF/VAF(allele fraction/ mutation allele fraction/variant allele fraction):突变丰度, 或突变/变异等位基因丰度, 是指某个基因位点所有的等位基因中, 突变的等位基因所占的相对比例, 即等于突变型/(突变型+野生型)。
• CEP(chromosome enumeration probe):染色体计数探针, 能够与位于着丝粒区域高度重复的alpha卫星序列结合, 用于检测染色体的数目异常。
• cfDNA(circulating free DNA):循环游离DNA, 是细胞凋亡或者坏死后降解和释放到外周血的游离DNA。
• CHIP(clonal hematopoiesis of indeterminate potential):意义未明克隆性造血, 是一种普遍的与老化相关的现象, 造血干细胞或其他造血祖细胞形成携带一定基因特征的血细胞亚群。这些亚克隆所携带的变异一般丰度较低, 可以通过白细胞等深度测序对照及生信算法(部分)进行过滤。
• CNV(copy number variation):拷贝数变异, 是基因组上部分区域的扩增或缺失。CNV是一种结构变异, 在肿瘤基因组中常见, 包括插入、缺失和重复。NGS可通过对该区域的覆盖度(测序深度)来估算CNV。
• ctDNA(circulating tumor DNA):循环肿瘤DNA, 是外周血中携带一定肿瘤特征(如SNV、插入/缺失突变、重排、CNV等), 来自肿瘤基因组的DNA片段。主要来源有凋亡或坏死的肿瘤细胞、循环肿瘤细胞(CTC)以及肿瘤细胞分泌的外泌体。
• LBx(liquid biopsy):液体活检, 是指对非固体生物样本(主要是血液)的采样和分析。液体活检和组织活检一样, 主要用于癌症等疾病的诊断和监测, 与组织活检相比具有无创, 能动态检测等优点。
• LOD(limit of detection):最低检测限, 是指能以适当的置信度(一般是95%)被检出的突变的最低浓度。
• LOH(loss of heterozygosity):杂合性缺失, 是一种使某特定基因丢失的基因组变化。如果一个特定位点的等位基因一侧正常、一侧有突变, 某种原因导致的正常等位基因缺失或突变会产生没有正常功能的基因座。
• MaxAF/MSAF(maximum allele fraction /maximum somatic allele frequency):最大变异丰度, 或最大体细胞基因变异频率, 是指在组织、血浆等类型样本中, 所检出的最高的体细胞变异丰度。
• MMR(mismatch repair):错配修复。DNA错配修复是指在含有错配碱基的DNA分子中, 使核苷酸序列恢复正常的一种修复方式。
• MSI(microsatellite instability):微卫星不稳定性。微卫星是指细胞基因组中以少数几个核苷酸(多为1~6个)为单位串联重复的DNA序列。DNA错配修复(MMR)功能出现异常时, 微卫星出现的复制错误得不到纠正并不断累积, 使得微卫星序列长度或碱基组成发生改变, 称为微卫星不稳定性。
• SNV(single-nucleotide variant):单核苷酸变异, 是基因组上部分区域发生的点突变。SNV是最常见的变异类型。
• TBx(tissue/tumor biopsy):组织活检或肿瘤组织活检, 是采集组织并对组织进行检查和分析。
• TMB(tumor mutation burden):肿瘤突变负荷, 是指肿瘤基因组编码区每百万碱基中的体细胞非同义突变个数。理论上TMB越高, 可能被T淋巴细胞识别的新抗原越多, 免疫检查点抑制剂疗效可能越好。
解读专家组成员
名誉主编:吴一龙(广东省人民医院)
执笔组长:张绪超(广东省人民医院)
执笔委员会成员(按姓名拼音排序):蔡林波(广东三九脑科医院), 常建华(中国医学科学院肿瘤医院深圳分院), 陈锋夏(海南省人民医院), 陈炬(中山大学孙逸仙纪念医院), 成建德(山西白求恩医院), 关印(首都医科大学附属北京朝阳医院), 郭禹标(中山大学附属第一医院), 黄媚娟(四川大学华西医院), 蒋华(常州市第二人民医院), 金时(中国医学科学院肿瘤医院深圳医院), 李敏(中南大学湘雅医院), 李延(四川省人民医院), 陆元志(暨南大学附属第一医院), 罗永忠(湖南省肿瘤医院), 马虎(遵义医科大学第二附属医院), 马建群(哈尔滨医科大学附属肿瘤医院), 潘小杰(福建省立医院), 邱剑光(中山大学附属第六医院), 斯璐(北京大学肿瘤医院), 宋子正(河北大学附属医院), 孙玉萍(济南市中心医院), 涂海燕(广东省人民医院), 王慧娟(河南省肿瘤医院), 吴迪(深圳市人民医院), 吴现瑞(中山大学附属第六医院), 谢展鸿(广州医科大学附属第一医院), 徐蓓(复旦大学附属中山医院), 许隽颖(无锡市人民医院), 杨学宁(广东省人民医院), 姚文秀(四川省肿瘤医院), 叶峰(厦门大学附属第一医院), 叶贤伟(贵州省人民医院), 岳君秋(湖北省肿瘤医院), 臧远胜(海军军医大学附属长征医院), 张璐(广州燃石医学检验所有限公司), 张晓春(青岛大学附属医院), 张新伟(天津市肿瘤医院), 张瑜(中南大学湘雅医院), 张周(广州燃石医学检验所有限公司), 赵宏(中国医学科学院肿瘤医院), 赵军(苏州大学附属第一医院), 庄莉(云南省肿瘤医院)
顾问委员会成员(按姓名拼音排序):陈元(华中科技大学同济医学院附属同济医院), 陈志康(中南大学湘雅医院), 崔同建(福建省立医院), 丁礼仁(浙江大学医学院附属第二医院), 杜瀛瀛(安徽医科大学第一附属医院), 郭人花(江苏省人民医院), 何勇(陆军特色医学中心), 侯小明(兰州大学第一医院), 姜国忠 (郑州大学第一附属医院), 李智(广东省人民医院), 梁乃新(北京协和医院), 林丽珠(广州中医药大学第一附属医院), 刘先领(中南大学湘雅二医院), 刘洋(四川省肿瘤医院), 吕冬青(台州恩泽医疗中心台州医院), 马杰(河南省肿瘤医院), 孟宏学 (哈尔滨医科大学附属肿瘤医院), 欧阳能太(中山大学孙逸仙纪念医院), 潘跃银(安徽省肿瘤医院), 乔贵宾(广东省人民医院), 饶创宙(中国科学院大学宁波华美医院), 宋勇(东部战区总医院), 宋正波(中国科学院大学附属肿瘤医院), 唐源(四川大学华西医院), 王根和(黄山市人民医院), 王洪琰(河北医科大学第四医院), 王佳蕾(复旦大学附属肿瘤医院), 王珂(天津市肿瘤医院), 王晰程(北京大学肿瘤医院), 温灏(复旦大学附属肿瘤医院), 邬麟(湖南省肿瘤医院), 项轶(上海交通大学医学院附属瑞金医院), 肖德胜(中南大学湘雅医院), 徐嵩(天津医科大学总医院), 姚煜(西安交通大学第一附属医院), 杨帆(北京大学人民医院), 杨衿记(广东省人民医院), 杨林(深圳市人民医院), 杨农(湖南省肿瘤医院), 杨宇(哈尔滨医科大学附属第二医院), 殷伟强(广州医科大学附属第一医院), 虞巍(北京大学第一医院), 袁瑛(浙江大学医学院附属第二医院), 曾珊(中南大学湘雅医院), 张沂平(中国科学院大学附属肿瘤医院), 张智泓(江苏省人民医院), 赵军(北京大学肿瘤医院), 赵明芳(中国医科大学附属第一医院), 钟文昭(广东省人民医院), 周承志(广州医科大学附属第一医院), 周清(广东省人民医院), 周晓燕(复旦大学附属肿瘤医院), 周永春(云南省肿瘤医院), 朱梁军(江苏省肿瘤医院), 朱耀(复旦大学附属肿瘤医院)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|