邓艳红(1979-),女, 广东韶关人, 主任医师, 博士研究生导师, 主要研究方向为胃肠肿瘤药物治疗。
结直肠癌(colorectal cancer, CRC)是世界上第三大最常见的恶性肿瘤, 也是第四大最常见导致死亡的恶性肿瘤[1]。近年来, 通过早期筛查等手段, CRC患者的5年生存率有所提高, 但仍有25%~50%的早期患者会继续发展为晚期转移性结直肠癌(metastasis colorectal cancer, mCRC)[2, 3, 4, 5]。尽管治疗方法和药物不断涌现, mCRC患者的中位5年生存率仅为12.5%, 疗效亟需提高。随着以程序性死亡受体-1(programmed death 1, PD-1)为代表的免疫检查点抑制剂的研发, 免疫治疗在肿瘤药物治疗领域取得了长足的发展, 在CRC患者中也有不少研究数据, 即将改变或已经成为CRC的标准治疗, 将其进展分述如下。
DNA错配修复(mismatch repair, MMR)是指纠正DNA双螺旋上错配的碱基对, 恢复正常核苷酸序列的修复方式。错配修复基因缺陷(deficient mismatch repair, dMMR)是指当MMR基因发生突变或甲基化时将导致MMR功能下降, 导致DNA序列中的碱基错配、缺失或插入不能被修复[6]。微卫星不稳定性(microsatellite instability, MSI)是指当存在dMMR时, DNA错配修复功能出现异常, 使得微卫星序列长度和碱基组成发生改变, 基因组中短的重复单元组成的DNA重复序列长度发生改变, 增加基因组的不稳定性, 导致基因组大量突变形成及下游靶基因表达异常形成新抗原[7]。5%的晚期CRC存在微卫星高度不稳定性(microsatellite instability-high, MSI-H)/dMMR, 这类CRC对常规化疗不敏感, 预后较差, 但是由于MSI-H/dMMR型CRC具有较高的肿瘤突变负荷(tumor mutation burden, TMB), 且肿瘤组织中有大量的免疫细胞浸润和较高水平的肿瘤新抗原[8], 这类患者对免疫治疗效果较好。
从2015年起, KEYNOTE-016研究率先发现PD-1单抗帕博利珠单抗(pembrolizumab)能带给dMMR/MSI-H型mCRC显著临床效益开始, CRC的免疫治疗开启了新篇章[9]。随后KEYNOTE-164研究发现针对MSI-H/dMMR型CRC患者, 无论既往接受过多少线的标准治疗, 患者接受单药帕博利珠单抗治疗(200mg, q3w)后, 中位随访时间为31.3个月, 客观缓解率(objective response rate, ORR)为33%[95%可信区间(confidence interval, CI)21%~46%], 且一旦有效, 有效持续时间往往超过2年, 显示帕博利珠单抗提高了经过多线治疗失败的MSI-H/dMMR型CRC患者的临床效益[10]。因此2017年, 帕博利珠单抗被美国食品药品监督管理局(Food and Drug Administration, FDA)批准用于MSI-H/dMMR型实体瘤患者[11]。
后线治疗效果确立后, PD-1在dMMR肠癌一线治疗中的疗效值得探索, 另外, 也需要与化疗联合靶向治疗进行头对头比较。KEYNOTE-177研究给予了答案。此研究针对初治的晚期MSI-H型CRC患者, 入选患者一组采用单药帕博利珠单抗(200 mg, q3w, n=153), 另一组采用了遵循指南医生选择的化疗± 靶向方案(n=154)。主要研究终点是无进展生存期(progression-free survival, PFS)。在数据截止时(2020年2月), 帕博利珠单抗单药组PFS为16.5个月, 化疗± 靶向治疗组PFS是8.2个月。帕利珠单抗单药组的ORR为43.8%, 化疗± 靶向治疗组的ORR是33.1%。帕博利珠单抗单药组发生3度及以上不良反应的比例为22%, 而化疗± 靶向治疗组的比例为66%。从此研究发现针对MSI-H型初次治疗mCRC患者, 帕博利珠单药免疫治疗比常规的化疗± 靶向治疗能获得更好的临床效益, 安全性也更高[12]。
另外一个免疫检查点细胞毒性T细胞相关抗原-4(cytotoxic T-lymphocyte-associated protein 4, CTLA-4)单抗伊匹木单抗(ipilimumab)也是非常重要的免疫治疗药物, 其主要作用于抗原递呈细胞激活T细胞的过程, 与PD-1的联合应用理论上不仅能促进淋巴细胞自身功能被激活, 还能增加对肿瘤细胞的识别[13]。CheckMate-142研究共纳入了74例MSI-H/dMMR型mCRC患者使用单药PD-1(纳武利尤单抗), 9个月和12个月的无进展生存率分别为76%和71%; 119例患者使用纳武利尤单抗联合伊匹木单抗, 9个月和12个月的总生存率分别为87%和85%, 尽管是间接比较两个队列的PFS和OS, 对比于纳武利尤单抗单药治疗, 伊匹木单抗联合纳武利尤单抗的双免治疗能使MSI-H/dMMR型mCRC患者获得更好的长期临床效益[14]。不过, 联合双免治疗的毒性也增加, 对比纳武利尤单抗治疗, 伊匹木单抗联合纳武利尤单抗的双免治疗组中3/4级治疗相关毒性率为32%, 严重不良事件率为20%, 如何在维持较好的临床效益的同时降低药物毒性是之后研究的重要环节。另一方面, 双免联合的新辅助治疗对早期MSI-H/dMMR型CRC患者也有一定的临床疗效, NICHE研究纳入了20例患者接受双免治疗, 1次剂量伊匹木单抗加上2次剂量纳武利尤单抗后, 6周内接受手术[15], 全部20例患者术后病理检查残留的活性癌细胞< 10%。即使缺失了影像学评估的肿瘤缓解情况, NICHE是首次免疫治疗作为新辅助治疗的研究, 给予了我们重要的启示:针对于早期MSI-H/dMMR型CRC, 免疫治疗可以在短期内明显减少肿瘤负荷, 有利于手术的进行, 但仍然需要大样本的临床研究去证实。
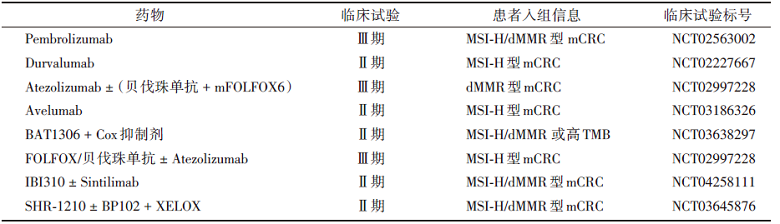
总体而言, 将KEYNOTE-177、KEYNOTE-164和CheckMate-142三个研究的数据进行横向对比, 我们可以发现对于MSI-H/dMMR型mCRC患者, 免疫治疗比化疗± 靶向治疗能获得更好的临床效益, 同时双免联合治疗比单免治疗疗效更优, 部分患者甚至获得治愈的机会。当然, 仍然有接近一半的患者会发生原发或继发性的耐药, 大量的研究还在不断推进, 目前正在开展的针对于MSI-H/dMMR型CRC临床研究大多数是围绕着PD-1单抗和CTLA-4单抗与其他治疗联合, 见表1。
| 表1 正在进行的有关dMMR/MSI-H型CRC免疫治疗的临床研究 |
免疫治疗在MSI-H肠癌中取得了令人瞩目的疗效, 但是约90%以上的CRC为微卫星稳定性(microsatellite stability, MSS)型, 此类肿瘤由于基因的差异, 肿瘤免疫微环境中, 免疫细胞聚集较少, 对免疫治疗的敏感性较低, 属于“ 冷肿瘤” [16]。如何将这类肿瘤转化为类似于MSI-H型CRC对免疫治疗敏感的“ 热肿瘤” 是目前免疫治疗的研究热点, 其中免疫治疗联合其他治疗是重要的研究方向。
首先被想到的是, 双免联合治疗是否会有效呢?2019年美国临床肿瘤学会胃肠道肿瘤研讨会(American Society of Clinical Oncology Gastrointestinal, ASCO GI)会议上报告的CCTG CO.26是第一个在MSS型mCRC患者中取得阳性结果的大型Ⅱ 期临床研究, CTLA-4单抗联合程序性死亡配体-1(programmed death ligand-1, PD-L1)单抗延长了MSS型难治性mCRC患者的OS, 同时发现虽然TMB不能预测OS, PFS或疾病控制率(disease control rate, DCR), 但是TMB> 28 mts/Mb的患者使用双免治疗时能获得最大的OS获益[风险比(hazard ratio, HR) 0.34, 90%CI 0.18~0.63][17]。但是这个研究的结果并不能予以我们希望, 患者的OS虽然有提高, 但是只有2.5个月, 跟MSI-H/dMMR型mCRC患者从免疫治疗中获取的临床效益相比相差甚远。另外在CheckMate-142(20例)和NICHE(8例)研究中同样纳入了使用了双免治疗的MSS型CRC患者, 但是临床效益却不高。因此双免治疗对MSS型CRC患者的临床疗效仍然需要更多的临床研究数据去探究。
免疫联合抗血管生成靶向治疗的研究也在展开, 不过, 随着PD-L1单抗联合MEK抑制剂的Ⅲ 期研究IMblaze370, 到PD-L1单抗联合抗血管生成抑制剂的MODUL研究的失败, 使得免疫治疗在MSS型CRC中的运用陷入困境。REGONIVO研究结果予以了希望, 研究中纳入的25例CRC患者使用瑞戈非尼联合纳武利尤单抗后中位PFS为7.9个月, 12个月的无进展生存率为41.8%, 中位OS虽未达到, 但预计12个月的总生存率为68.0%[18]。虽然96%的纳入患者在临床试验之前都曾使用过抗血管生成靶向药物治疗, 但从目前的试验结果可发现即使后线再次使用瑞戈非尼联合免疫治疗, ORR也会明显提高。同时, 研究发现CRC肺转移患者的临床获益[ORR 50.0%(8/16)]比CRC肝转移患者的临床获益高[ORR 15.4%(2/13)], 这是否与肝转移病灶中的本身免疫微环境比肺转移灶中的免疫微环境的抑制性强存在关系, 这仍需要进一步的探究原因及机制。同样的使用瑞戈非尼联合阿维鲁单抗(avelumab)的REGOMUNE研究和使用特瑞普利单抗(toripalimab)联合瑞戈非尼的REGOTORI研究也取得较好的临床研究结果。抗血管生成抑制剂联合免疫治疗在理论上是能发挥“ 1+1> 2” 的作用效果, 肿瘤免疫微环境中的调节性T细胞(regulatory T cells, Treg)和肿瘤相关巨噬细胞(tumor-associated macrophages, TAM)等抑制性的免疫细胞增多导致MSS型肿瘤患者对免疫检查点抑制剂耐受, 同时因为其结构特殊会使抗癌药物和免疫细胞很难抵达肿瘤部位从而形成抑制性的免疫微环境, 而抗血管生成抑制剂可以调节巨噬细胞增强抗肿瘤免疫[19]。但从MODUL研究的失败到REGONIVO等研究的成功, 选择何种通路的抗血管生成抑制剂, 以及药物剂量是联合治疗需要思考的问题, 联合治疗后的毒副反应也是需要关注的问题。
免疫治疗联合化疗也是将“ 冷肿瘤” 转化为“ 热肿瘤” 的方式之一, 在其他癌种中取得了较好的结果, 例如CASPIAN研究纳入了268例使用度伐单抗(durvalumab)联合标准化疗(依托泊苷+顺铂或卡铂)的广泛期小细胞肺癌(extensive stage-small cell lung cancer, ED-SCLC)患者, 中位OS为13.0个月, 死亡风险降低了27%(HR=0.73, P=0.004 7), 比传统化疗可以更加显著改善患者生存期, 获得更好的临床效益[20]。同样对于MSS型CRC, 免疫治疗联合化疗的研究也在逐步开展, 2020年ASCO会议上汇报了MEDETREME研究的中期安全性分析, 发现10/16例RAS突变MSS型mCRC患者使用度伐单抗和替西木单抗(tremelimumab)联合FOLFOX后6个月的无进展生存率达到62.5%, ORR达62.5%, DCR达87.5%, 其中5例完全缓解、5例部分缓解和4例疾病稳定, 严重不良事件率为12.5%, 虽然尚未达到中位PFS, 但仍然证实了MEDITREME方案作为一线治疗的有效性与安全性。
最后免疫治疗联合放疗在理论上也是可以促进免疫反应, 因为放疗导致的细胞死亡会释放细胞内物质, 从而激活抗原递呈细胞触发, 改善抑制性的肿瘤免疫微环境。2019年ASCO GI会议上报告的NCT03104439研究纳入40例MSS型mCRC患者使用伊匹木单抗(1 mg/kg, q6w)、纳武利尤单抗(240 mg, q2w)以及在第2周期每隔一天进行放疗(8 Gy, 3F)。意向性治疗(intention-to-treat, ITT)人群DCR为17.5%(7/40), ORR为7.5%(3/40), 中位疾病控制时间为77天。调整ITT人群(所有接受放疗和再分期患者)为24例, DCR为29.2%(7/24), ORR为12.5%(3/24), 中位疾病控制时间为77.5天, 3个月时, 达到疾病控制的患者的疾病控制时间为252天[21]。这表明双免联合免疫治疗可以给MSS型mCRC患者带来较为长久的临床效益, 可是否对初治MSS型CRC患者有效, 单免联合放疗与免疫治疗+抗血管生成靶向治疗+放疗(REGONIVO plus)是否同样能发挥作用仍然在研究中。
MSS型CRC的免疫治疗进展较为缓慢, 如何筛选出能够预测CRC患者治疗反应的生物标志物以及真正将冷肿瘤变为热肿瘤, 仍然任重道远, 尽管部分研究认为TMB、POLE/POLD基因状态、PD-L1表达、CD8细胞浸润等可能区分MSS型CRC中对免疫治疗敏感的患者, 但是研究的一致性较低, 尚不能指导临床。另外一方面随着有关肿瘤免疫微环境及肿瘤引流淋巴结(tumor-draining lymph nodes, TDLN)微环境基础研究的进展与发现, PD-1与PD-L1的相互作用主要发生在TDLN中的cDC细胞与T细胞, PD-1抗体或PD-L1抗体的作用也主要发挥在TDLN中[22], 即可以探索免疫治疗作为新辅助治疗与辅助后线治疗和免疫治疗给药方式的不同带来的临床效益的差异。
综上所述, MSI-H/dMMR型CRC患者可以在免疫治疗中取得持久应答的疗效, 应该成为MSI-H/dMMR型CRC一线治疗的新标准。而针对于绝大多数MSS型CRC患者, 目前的免疫治疗方法在很大程度上存在局限性, 需要更多深入对免疫治疗耐药机制的研究, 筛选出能够预测CRC患者治疗反应的生物标志物以及开发新的联合治疗方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|