| 张涛,教授,主任医师,博士生导师。华中科技大学同济医学院附属协和医院肿瘤中心主任。 主要学会任职:中国医师协会肿瘤医师分会常务委员,中国临床肿瘤学会(CSCO)理事,CSCO胰腺癌专家委员会副主任委员,CSCO胃癌专家委员会和肿瘤营养治疗专家委员会常务委员,CSCO结直肠癌专家委员会委员,湖北省抗癌协会肿瘤分子靶向治疗专业委员会主任委员。 主要从事消化道肿瘤放化疗及靶向免疫治疗的临床及科研工作,承担国家重点研发计划重点专项子课题1项,国家自然科学基金3项。发表论文60余篇,其中SCI收录论文50余篇,论文收录于《Blood》、《Cancer Res》、《J Immunother》、《Int J Cancer》、《Oncogene》以及《ACS Appl Mater Interfaces》等国际权威杂志。担任人卫版高职高专《放射治疗技术》主编,《消化道肿瘤多学科协作诊疗病例》副主编。 |
Chalabi M, Fanchi L F, Dijkstra K K, et al. Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers[J]. Nat Med, 2020, 26(4):566-576.
1b。
• 程序性死亡受体-1(programmed cell death 1, PD-1)和细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)抑制剂的治疗方案对错配修复功能缺陷(mismatch repair-deficient, dMMR)的晚期结直肠癌非常有效, 但在错配修复功能完整(proficient mismatch repair, pMMR)的晚期结直肠癌患者中疗效不佳。
• 在对早期黑色素瘤、肺癌和膀胱癌的最新研究表明, 新辅助免疫治疗有不错的病理反应。在早期结肠癌中还未进行新辅助免疫治疗的探索。
通过使用新辅助免疫疗法对早期dMMR和pMMR结肠癌患者进行治疗, 对该方法的有效性、安全性相关生物标记物进行探索。
• 研究条件:荷兰癌症研究所主持的NICHE研究项目(NCT03026140)。
• 研究方法:单中心、开放、探索性随机对照临床试验。
• 研究时间:2017年3月29日开始, 仍在招募患者。
• 研究对象:早期dMMR或pMMR结肠癌患者。
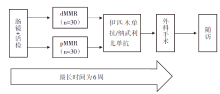
• 干预措施:对dMMR或pMMR的非转移性结肠癌患者进行短期术前伊匹木单抗/纳武利尤单抗联合或不联合塞来昔布的治疗, 患者在手术前给予1剂伊匹木单抗和2剂纳武利尤单抗, 并且pMMR患者联合或不联合塞来昔布。有3例患者仅接受纳武利尤单抗单药治疗。具体研究设计见图1。
• 评价指标:有效性:病理组织学肿瘤消退率; 安全性:3~4级不良事件(adverse event, AE)发生情况。
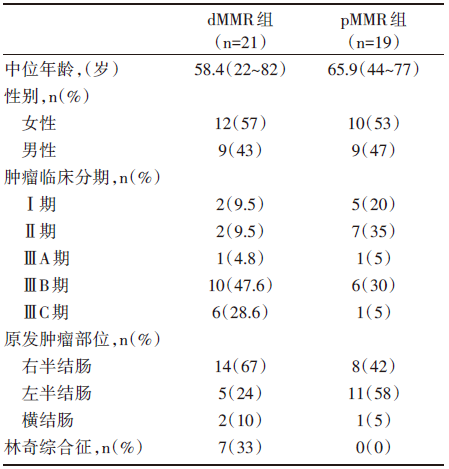
患者特征:研究共纳入40例结肠癌患者, 其中21例为dMMR型, 20例为pMMR型(1例患者同时为pMMR和dMMR型)。首例患者入组时间为2017年3月, 81%的dMMR型患者和40%的pMMR型患者为临床Ⅲ 期结肠癌。在3例患者接受纳武利尤单抗单药安全性导入后, 给予37例患者伊匹木单抗+纳武利尤单抗方案治疗。pMMR治疗组17例患者中, 有8例患者随机分配接受塞来昔布治疗。患者基线信息详见表1。
| 表1 研究对象基线信息 |
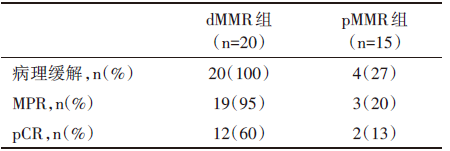
dMMR组20例均有病理缓解, 其中19例达到病理学显著缓解(major pathological response, MPR, 定义为治疗后残留存活肿瘤≤ 10%), 并包括了12例病理完全缓解(pathological complete response, pCR), 这12例中9例为Ⅲ 期结肠癌。pMMR组观察到4例有病理缓解, 其中3例达到MPR, 这3例其中2例达到pCR, 见表2。
| 表2 新辅助免疫治疗在pMMR和dMMR的早期结肠癌的病理反应 |
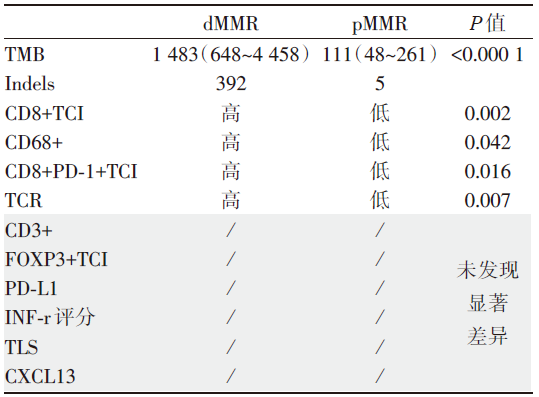
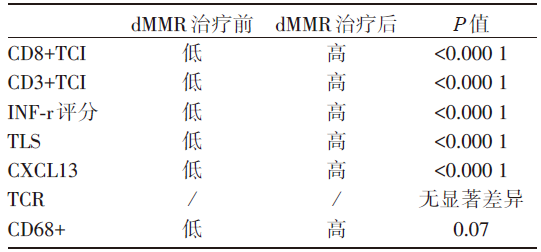
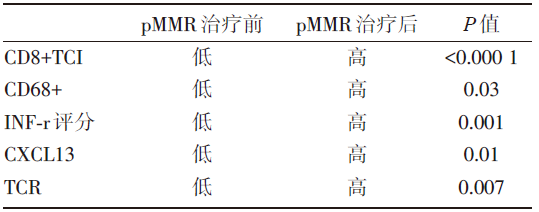
与结肠癌免疫治疗反应相关的生物标志物:为了研究新免疫治疗对肿瘤微环境(tumor microenvironment, TME)的影响, 使用全外显子测序、免疫组化、免疫相关基因检测及T细胞受体(T cell receptor, TCR)测序。基线dMMR和pMMR组各生物标志物的情况对比见表3。
| 表3 基线dMMR和pMMR组各生物标志物的情况对比 |
表3中的相关生物标志物也在pMMR有反应型和无反应型中进行了检测, 除CD8+PD-1+TCI可能可以预测治疗反应性外, 其余生物标志物均未发现显著差异。
| 表4 dMMR的早期结肠癌患者治疗前后免疫微环境的变化 |
| 表5 pMMR的早期结肠癌患者治疗前后免疫微环境的变化 |
安全性:总体治疗耐受性良好, 所有患者均在纳入研究后6周内接受了根治性切除手术。从首次使用纳武利尤单抗到手术的中位持续时间为32天。有5例患者(13%)经历了3~4级与治疗相关的毒性反应。2例患者出现3级皮疹, 可通过类固醇激素治疗缓解(1例口服, 1例局部用药)。1例患者在手术后2个月经历了3级结肠炎, 为此, 给患者使用单剂英夫利昔单抗, 可在3天内缓解症状。在8例患者中观察到了与手术有关的3级AE。40例患者中有4例[10%, 95%可信区间(confidence interval, CI)3%~24%]观察到吻合口漏。
本研究可以初步证明非转移性结肠癌患者或许可从等待手术治疗前接受短程的新辅助免疫治疗中获益。其中dMMR患者可以100%从该治疗方案中获益, 部分pMMR患者(27%)可从中获益。因此该研究值得更深入的进行研究, 通过更大样本量的临床试验, 以论证新辅助免疫疗法是否应当作为标准疗法应用于结肠癌的治疗。
自2015年PD-1单抗免疫治疗错配修复缺陷(dMMR)或微卫星高度不稳定性(MSI-H)的转移性结直肠癌(metastasis colorectal cancer, mCRC)显著获益的首次发现, 开启了mCRC的免疫治疗时代[1]。随着2020年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)报道的KEYNOTE-177研究提示dMMR人群晚期一线PD-1单抗单药免疫治疗完胜传统化疗联合靶向治疗, 更让我们对免疫治疗在肠癌中的辅助治疗、新辅助治疗有了进一步的期待[2]。临床前研究表明相比于术后辅助治疗, 新辅助免疫治疗可以利用手术前肿瘤体积大、新抗原多等优势, 充分增强体内抗肿瘤免疫T细胞的活性, 清除微小转移灶[3]。确实, 新辅助免疫治疗在黑色素瘤、肺癌等实体肿瘤中均取得了不错的疗效, 而NICHE研究结果的横空问世可以说是既在情理之中, 又在意料之外, 更是让我们对结肠癌尤其是传统认知上的非优势人群的微卫星稳定人群的免疫治疗有了新的认识。
众所周知, 即使在Ⅱ ~Ⅲ 期肠癌患者中dMMR型肠癌也仅占15%左右, FOXTROT研究提示该类型患者对新辅助化疗不敏感, 2年生存无获益[4]。NICHE研究中接受伊匹木单抗+纳武利尤单抗双免疫治疗的患者共37例, 2例最终不符合入组标准被排除。其中20例dMMR型患者首次接受免疫治疗后短短4周内行手术治疗的病理学缓解率达到100%, 而达到病理学完全缓解(pCR)的患者高达60%(12例)。仅仅2次的免疫治疗及4周左右的时间就可以带来如此惊人的疗效, 而晚期肠癌患者中双免治疗的中位起效时间则为2.8个月[5]。与此类似的是在2019年ASCO报道的Voltage研究则探讨了局部晚期直肠癌行长程同步放化疗后予以纳武利尤单抗的新辅助免疫治疗, 巧合的是dMMR人群的pCR同样也达到了60%[6]。而从既往经验来看, 局部晚期直肠癌的新辅助放化疗pCR通常在15%~30%左右。很显然, 无论单药还是联合, dMMR型肠癌的新辅助免疫治疗一定是未来探讨的重点, 尤其是在需要涉及到器官保留的直肠癌患者中显得更有意义。
与dMMR型肠癌数据相比, 该研究引起我们更加关注的则是15例pMMR患者中, 有4例达到了病理学缓解(27%), 且其中2例达到pCR。而类似的Voltage研究中, pMMR型局部晚期直肠癌患者行长程同步放化疗后予以纳武利尤单抗的新辅助免疫治疗, pCR同样达到了30%。无独有偶, 我们中心启动了一项短程放疗联合PD-1单抗及化疗新辅助治疗局部晚期直肠癌的临床研究, 初步结果提示pMMR人群的pCR率超过48%。相比于mCRC中单药PD-1治疗有效率的0%及CTLA-4联合PD-1单抗双免疫治疗的5%[7], 这一结果让我们对免疫治疗在不同肿瘤不同分期中的疗效差异有了更深刻的认识, 这一差异的背后体现的更是肿瘤免疫微环境的时空异质性。既往许多研究探讨了pMMR人群的免疫微环境特点, 无论MMR状态如何, 低表达CD3+和CD8+细胞预示着更高的复发风险, 而IDEA研究中免疫评分更是Ⅲ 期肠癌强烈的预后预测因素[8, 9]。在NICHE研究后续的分子标志物探索中, 唯一提示有可能预测新辅助免疫治疗疗效的标志物为CD8和PD-1共表达T细胞的浸润, 如果该结果能够进一步在大样本数据中得到验证, 将为我们对pMMR免疫优势人群的筛选提供方向。
当然, 在pMMR新辅助免疫治疗无效患者中, 我们同样看到了免疫治疗后CD8+T细胞数目、TCR多样性、IFN-γ 评分及CXCL13表达增加, 提示免疫系统的激活, 尽管这种效应在NICHE研究治疗模式中未带来病理学缓解。但我们知道既往黑色素瘤中发现CD8+T细胞浸润与临床反应密切相关, 尤其在延期反应者中, 更多的是免疫细胞从肿瘤边缘到内部的逐步浸润[10]。那么进一步增加新辅助免疫治疗强度或者术前观察等待的时间能否给我们带来惊喜呢?无反应者中是否是由于微环境中的其他免疫抑制因素导致?后续对这类患者能否通过其他的联合手段来提高疗效, 相应这些都是我们迫切需要回答的问题。
免疫治疗初期由于免疫细胞浸润和炎症, 传统的CT在内的影像学评估手段可能并不准确, 治疗后CT最常见的表现是疾病稳定或假性进展。因此, 目前很多新辅助免疫治疗临床研究都把主要病理缓解(MPR)作为主要评价标准, 而不是传统的客观缓解率。尽管在乳腺癌和前列腺癌等瘤种中病理学缓解能够很好能否预测患者总生存期, 但在结直肠癌中我们仍然不得而知。在NICHE研究中我们同样看到了影像学反应与病理学缓解的不一致性, 尤其是在组织学评估MPR的病例中CT影像上仍可以看到大体肿瘤。新辅助免疫治疗时代, 如何结合其他影像手段或者分子标志物来评估疗效, 尤其是在直肠癌患者中, 如何筛选出影像学未达到临床完全缓解(clinical complete response, cCR)而已经pCR的患者来进行观察等待策略又是我们面临的难题。
尽管NICHE为我们在结肠癌的新辅助免疫治疗打开了大门, 同时我们也不得不承认在这一领域我们仍然是管中窥豹。这一小样本的研究结果能否在更大样本人群中得到验证仍然不得而知, 新辅助免疫治疗的病理学缓解能否最终带来患者的生存获益?新辅助免疫治疗的具体应用, 如何与其他治疗手段联合、治疗强度和时机的把控、人群的筛选、术后患者的治疗选择、疗效的判断等等一系列问题都将是未来我们需要面对的。但无论如何, 长风破浪会有时, 直挂云帆济沧海, 新辅助免疫治疗的曙光已在眼前, 未来可期!
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|