| 谢琳,博士,博士研究生导师,教授,消化肿瘤内科主任。云南省中青年学术科技带头人后备人才,云南省医学学科带头人。美国Emory大学医学院肿瘤研究中心访问学者。兼任中国南方肿瘤临床研究协会青年委员会副主任委员、云南省转化医学会消化肿瘤分会主任委员、云南省抗癌协会肿瘤临床化疗专业委员会副主任委员、云南省医师协会中西医结合内科专业委员会副主任委员、中华结直肠癌MDT联盟云南分盟昆明分会常务委员以及多个国家、省级专业委员会委员。 从事肿瘤内科化疗相关临床工作20余年,擅长消化道肿瘤的化疗、靶向及综合治疗,特别是肿瘤转移和化疗耐药的临床及基础研究。近5年主持国家自然科学基金2项和云南省级科学基金5项。以第一作者或通讯作者发表论文40余篇,其中SCI收录20篇,单篇影响因子最高10.12分,累计影响因子61.37分。主要学术观点被包括Nature(IF=42.35)在内的国际顶级杂志多次引用。以主编、副主编身份出版专著或教材3部,参编4部。曾获云南省科技进步特等奖1项,二等奖、三等奖及云南省卫生科技成果奖等6项。研究成果申请国家专利并获授权6项(其中发明专利5项,实用新型专利1项)。 |
Le D T, Kim T W, Van Cutsem E, et al. Phase Ⅱ open-label study of pembrolizumab in treatment-refractory, microsatellite instability-high/mismatch repair-deficient metastatic colorectal cancer: KEYNOTE-164[J]. J Clin Oncol, 2019, 38(1):11-19.
2a。
• 微卫星高度不稳定性(microsatellite instability high, MSI-H)或错配修复功能缺陷(mismatch repair-deficient, dMMR)结直肠癌患者的预后比微卫星稳定(microsatellite stability, MSS)结直肠癌患者的预后差。
• 有证据表明, 程序性死亡配体1(programmed cell death-ligand 1, PD-L1)拮抗剂或合并细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA4)抑制剂对MSI-H/dMMR实体瘤患者具有抗肿瘤活性。
• 对于MSI-H/dMMR晚期结直肠癌患者, 一线或二线以上使用帕博利珠单抗的抗肿瘤活性是否一致, 目前尚未有定论。
评价帕博利珠单抗对MSI-H/dMMR晚期结直肠癌的疗效及安全性。
• 研究条件:包括美国、韩国等7个国家, 共128个中心参与(NCT02460198)。
• 研究起止时间:2015年9月14日至2017年9月12日。
• 研究方法:全球、多中心、非随机、开放、Ⅱ 期前瞻性研究。
• 研究对象:初诊不可切除的局部晚期或转移性MSI-H和/或dMMR结直肠癌患者。
• 干预措施:非随机接受帕博利珠单抗200 mg, q3w至35周期或肿瘤进展或不能耐受。具体干预措施见图1。
• 评价指标:主要终点指标:客观缓解率(objective response rate, ORR); 次要终点指标:缓解持续时间(duration of response, DOR), 疾病控制率(disease control rate, DCR), 无进展生存期(progression-free survival, PFS), 总生存期(overall survival, OS), 安全性和耐受性。
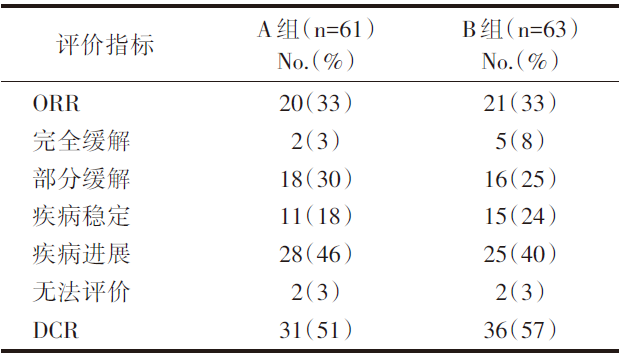
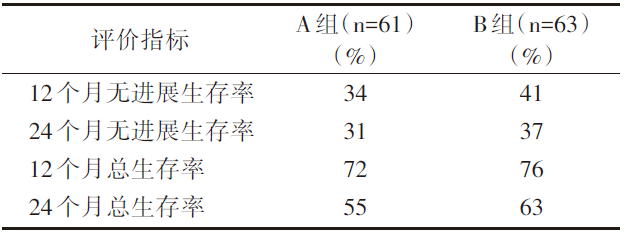
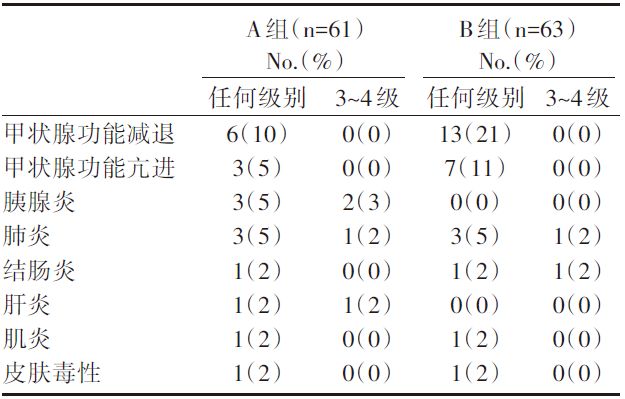
共纳入124例, A组平均随访31.3个月; B组平均随访24.2个月。主要疗效评价及不良反应事件见表1~表4。
| 表1 近期疗效评价 |
| 表2 远期疗效评价 |
| 表3 免疫相关总不良反应 |
| 表4 免疫相关具体不良事件 |
从以上结果可见:B组的生存获益优于A组, 且毒副作用均可耐受。对于MSI-H/dMMR晚期结直肠癌患者, 无论是一线及以上线数使用帕博利珠单抗治疗都有疗效, 且可耐受。
本研究证实帕博珠利单抗对MSI-H/dMMR晚期或转移结直肠癌的患者是有效而且安全、可控。
结直肠癌(colorectal carcinoma, CRC)在全球范围均是高发肿瘤之一, 2019年中国癌症统计报告显示:我国CRC发病率、死亡率在全部恶性肿瘤中分别位居第3及第5位。美国《2020年癌症统计》提示CRC仍然为占据前三的高发肿瘤之一, 但近年的病死率持续下降[1]。CRC的综合多学科治疗及精准治疗的发展明显延长了患者的生存。在免疫治疗时代, CRC依据微卫星不稳定性(microsatellite instability, MSI)或错配修复基因状态(mismatch repair, MMR)的不同分成了两类差异明显的群体。一类是免疫治疗获益人群, 为MSI-H/dMMR型肠癌, 另一类为免疫治疗无效人群, 为MSS/错配修复功能完整(proficient mismatch repair, pMMR)型肠癌。临床数据表明, CRC患者中约13%~14%为MSI-H/dMMR, 多为差分化或粘液腺癌, 右半结肠多见, 对化疗不敏感。CRC细胞的微卫星状态随癌症进展过程动态变化, 分期越晚, MSI-H患者占比越低, Ⅳ 期MSI-H/dMMR病例仅占4%~5%[2]。MSI-H/dMMR与免疫治疗获益有关。
KEYNOTE-016、012、158等研究中, 标准治疗失败的转移性CRC(metastatic CRC, mCRC)患者, 帕博利珠单抗单药治疗dMMR病例的客观缓解率(ORR)为39.6%~62%, 而在pMMR者的ORR为0[3]。这些数据使帕博利珠单抗2017年获美国食品药品监督管理局(Food and Drug Administration, FDA)批准用于治疗MSI-H/dMMR的实体瘤患者, 包括CRC。后续开展的KEYNOTE-164研究主要评估帕博利珠单抗用于MSI-H/dMMR经治mCRC的疗效和安全性。研究分A、B两个队列, 纳入了更多的标准治疗失败的MSI-H/dMMR型mCRC患者(61+63例), 选择了固定剂量(200 mg/3周)的帕博利珠单抗单药治疗, ORR为33%, 中位PFS为4.1个月, 中位OS尚未达到, 12个月总生存率为76%。两队列分别有56%和62%的患者的靶病灶对比基线时有缩小。研究结果进一步确认了帕博利珠单抗在MSI-H/dMMR型mCRC患者后线治疗中的持久临床获益。但免疫检查点抑制剂在MSI-H/dMMR型mCRC中的应用, 尚有很多问题值得思考。
1. 仅用MSI-H/dMMR作为筛选指标能否达到精准治疗的目标?
KEYNOTE-164中单药帕博利珠单抗用于MSI-H/dMMR经治mCRC中ORR为33%。CheckMate-142中, 纳武利尤单抗单药组用于经治MSI-H/dMMR mCRC患者, ORR为34%, 数据相似。可以发现有很大一部分MSI-H/dMMR mCRC患者并没有从免疫检查点抑制剂中获益, 这也说明MSI-H/dMMR作为唯一的筛选指标还远远不够。如何精准的甄选合适的患者是进一步提高疗效的一个关键点。首先, 肿瘤突变负荷(tumor mutation burden, TMB)状态是mCRC的预后因子, 免疫检查点抑制剂对高TMB患者的治疗有显著优势[4], MSI-H/dMMR与TMB或肿瘤新抗原负荷(tumor neoantigen burden, TNB)联合预测有望提高效能。其次, MSI-H/dMMR型CRC具体到分子亚型, CMS1-MSI免疫型中散发型MSI-H的患者常见BRAF突变, 在CIMP-H/MSI-H/BRAF肿瘤内, 常常是淋巴细胞浸润增加。CIMP-H或CIMP-L, BRAF突变的状态都会影响MSI-H型CRC的预后, 这些基因的表型状态改变肿瘤内淋巴细胞浸润的状态。MSI肿瘤微环境中肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)对治疗也有明显影响作用。肿瘤-基质比(tumor-stroma proportion, TSP)是另一个影响肿瘤局部炎性浸润的因素[5]。但是目前的多个相关临床试验尚未达成上述多个指标的共筛选条件。期待后续研究的进一步探讨。
2. 单药免疫治疗, 即便在MSI-H/dMMR型mCRC的获益人群中是否足够?
在KEYNOTE-164的数据中, 我们同样也会发出疑问, 单药免疫检查点抑制剂的治疗, 在这个优势人群中, 不足40%的ORR能否有进一步的提升?细胞毒性T淋巴细胞相关抗原-4(CTLA-4)会影响人体免疫系统, 削弱T细胞对癌细胞的杀伤能力。CTLA-4单抗可以阻断抑制性信号通路, 使T细胞活化, 程序性死亡受体1(programmed cell death 1, PD-1)单抗与CTLA-4单抗联合, 能活化淋巴细胞自身功能及增加对肿瘤细胞的识别发挥协同作用。CheckMate-142中纳武利尤单抗单药组用于经治MSI-H/dMMR型mCRC患者, ORR(34%)及12个月总生存率(72%)和KEYNOTE-164的结果类似。CheckMate-142中双免疫联合在经治组ORR为58%, 12个月的总生存率达85%, 和单药相比ORR和OS及PFS都有明显优势[6]。同时, 双免疫联合治疗不可避免的增加了联合治疗组的毒性, 3/4级治疗相关毒性从20%增加到32%, 严重不良事件也从12%增加到20%。联合免疫治疗是提高疗效的策略之一, 但是也要客观看待毒性, 个体化选择。同时今年《Nat Immunol》上的研究提示烟酰胺核糖苷(nicotinamide riboside, NR), 一种维生素B3的化学类似物可以增强各种细胞中的线粒体自噬能力和线粒体适应性, 防止TIL最终衰竭。膳食补充NR可以刺激TIL的抗肿瘤活性, 改善动物实验中双免疫联合治疗的效果[7]。同样在免疫联合治疗的模式中, 免疫检查点抑制剂和化疗、放疗的联合也值得关注, 具体如何联合, 用于什么样的患者, 毒性如何期待更多数据解答。
3. 几线选择免疫检查点抑制剂更加合适, 能否跨线治疗?
KEYNOTE-164研究结果提示, 入组人群多数MSI-H/dMMR型mCRC患者是三线应用帕博利珠单抗, 三线治疗12个月总生存率为76%, 中位OS未达到, 和目前标准三线治疗瑞戈非尼的中位OS(6.4个月), 呋喹替尼(7.2个月), TAS-102(7.1~7.8个月)有明显延长。但是KEYNOTE-164中, 患者超过3种以上治疗后应用帕博利珠单抗, ORR为26%, 明显低于相对前线治疗的ORR(33%~45%)。2020年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)报告KEYNOTE-177研究结果, 免疫单药用于MSI-H/dMMR型mCRC一线治疗, 帕博利珠单抗单药治疗ORR为43.8%, 较化疗或靶向化疗(33.1%)有明显提高, PFS及OS较化疗有明显延长, 而毒性则明显减少[8]。同时, ASCO大会上CheckMate-142数据更新, 双免疫联合方案一线治疗MSI-H/dMMR型mCRC患者ORR达69%, 双免疫一线治疗使多数患者获益并获得深度缓解。KEYNOTE-177和CheckMate-142的数据对比, 尽管标准、药物有差异, 但双免联合一线治疗可见优势。当然, 一线免疫检查点抑制剂治疗, 是单药, 联合化疗, 还是双免疫联合, 甚至跨线治疗是否可行均需要更多临床数据给予验证, 也需要考虑患者经济、体能、毒性等个性化原因。
临床中MSI-H/dMMR型mCRC占比较少, 近年免疫治疗有了很多突破, 但还有很多热点问题需要解决。对于MSS型mCRC则任重而道远。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|