| 王晰程,北京大学肿瘤医院副教授,中国抗癌协会大肠癌专业委员会内科学组/遗传学组委员,中国临床肿瘤学会(CSCO)青年专家委员会委员,北京癌症防治学会结直肠癌防治专业委员会常务委员。从事消化道肿瘤尤其是结直肠癌综合治疗及科研工作19年,具有丰富的临床经验。同时,还特别关注家族遗传性胃肠肿瘤这一特殊患者群体,为患者及家属提供遗传咨询,并建立家系随访工作,以期达到疾病预防与早期诊断的目的。作为秘书组组长参与卫健委《中国结直肠癌诊疗规范》2017版和2020版撰写工作,作为执笔编委参与2017~2020版《CSCO结直肠癌指南》、2018年《中国结直肠癌肺转移多学科综合治疗专家共识》、2018年《遗传性结直肠癌临床诊治和家系管理中国专家共识》、2019年《可切除的进展期结直肠癌围手术期专家共识》、2020年《恶性肿瘤相关急腹症多学科管理中国专家共识》等多项临床指南与共识的编写工作,为推动国内结直肠癌的规范诊疗、满足基层医疗卫生需求提供了切实的贡献。在科研方面,总共发表科研论文40余篇,主持国家青年自然基金1项,参与“十三五”重点研发计划1项。作为参与人分别获得2016年华夏医学科技一等奖和2020年中国抗癌协会科技一等奖。此外,作为教学医院的临床医师积极参与内科研究生的培养工作以及进修医师的带教工作,承担研究生课程2课时。2018年荣获北京大学医学部“住院医师心中好老师”奖。2019年荣获北京大学肿瘤医院“优秀带教老师”奖。 |
Fukuoka S, Hara H, Takahashi N, et al. Regorafenib Plus Nivolumab in Patients With Advanced Gastric or Colorectal Cancer: An Open-Label, Dose-Escalation, and Dose-Expansion Phase Ib Trial (REGONIVO, EPOC1603)[J]. J Clin Oncol, 2020, 38(18): 2053-2061.
2a。
免疫检查点抑制剂在多种实体瘤中取得了显著成就, 然而仍有很多患者无法从免疫治疗中获益, 如约占95%的错配修复蛋白完整(proficient mismatch repair, pMMR)的转移性结直肠癌(metastatic colorectal cancer, mCRC)患者无法从单纯的免疫治疗中获益。微卫星稳定(microsatellite stability, MSS)肠癌长期以来是免疫治疗难以破解的困局, 如何改善冷肿瘤免疫治疗的疗效是一个热点问题。免疫抑制细胞, 如调节性T细胞(regulatory T cell, T-reg)或肿瘤相关巨噬细胞(tumor-associated macrophage, TAM)可能与程序性死亡受体1(programmed cell death 1, PD-1)和程序性死亡配体1(programmed cell death ligand 1, PD-L1)抑制剂治疗的耐药密切相关。瑞戈非尼是血管生成和致癌激酶的有效抑制剂, 能减少肿瘤模型中的TAM。在小鼠模型中, 瑞戈非尼联合纳武利尤单抗显示出显著的抑制肿瘤生长的作用, 显著优于二者单独治疗。
旨在通过Ⅰ b期临床试验评估瑞戈非尼联合纳武利尤单抗在晚期胃癌(gastric cancer, GC)和结直肠癌(colorectal cancer, CRC)中的安全性和有效性。
• 研究条件:由日本国立癌症中心东病院(National Cancer Center Hospital East, NCCHE)发起研究(EPOC 1603, NCT03406871)。
• 研究起止时间:2018年1月至2018年10月。
• 研究方法:单中心、开放标签、剂量递增、剂量扩展的Ⅰ b期研究。
• 研究对象:本研究的主要纳入标准是组织学或细胞学证实晚期或转移性实体瘤患者, 对标准化疗无效或不耐受; ECOG PS评分为0或1; 接受既往抗PD-1/PD-L1抗体经治的患者。主要排除标准包括既往使用瑞戈非尼治疗或有活动性或慢性或复发性自身免疫性疾病病史。
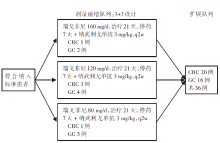
• 干预措施:入组晚期经治的GC和CRC患者均是二线及以上治疗失败。研究初期采用3+3方式, 包括80 mg、120 mg和160 mg 3个剂量组, 以确定瑞戈非尼的合适剂量, 初期探索性研究中, 瑞戈非尼160 mg单药标准剂量在两药联合时毒副作用较大, 所以后期研究中采用了120 mg作为推荐剂量, 整个治疗过程中120 mg剂量耐受性较好, 但仍有部分患者出现3级皮疹, 因此, 约一半患者瑞戈非尼其后剂量改为80 mg, 最终接受瑞戈非尼120 mg和80 mg剂量的患者各接近一半。PD-1抗体剂量在治疗过程中未做调整。研究设计见图1。
• 评价指标:主要研究终点是评估瑞戈非尼与纳武利尤单抗合用时的安全性和最大耐受剂量(maximum tolerated dose, MTD)和推荐剂量(recommended dose, RD)。次要研究终点包括评估不良事件发生率、客观反应率(objective response rate, ORR)、疾病控制率(disease control rate, DCR)、无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)。探索性研究终点包括生物标记物分析, 如肿瘤组织中PD-L1的表达和肿瘤突变负荷(tumor mutation burden, TMB)以及新鲜活检样本的免疫表型分析。
截至2018年10月共招募了50例患者, 包括25例GC, 25例CRC, 既往中位治疗线数为3。所有患者中, 仅1例为微卫星高度不稳定性(microsatellite instability-high, MSI-H)型, 为CRC患者。其余49例均为MSS型。剂量爬坡队列中, 瑞戈非尼160 mg组出现3例剂量限制性毒性(dose-limiting toxicitie, DLT)(3级结肠穿孔、斑丘疹和蛋白尿), 80 mg或120 mg未见DLT。在剂量扩展队列, 由于频繁的斑丘疹, 瑞戈非尼的剂量从120 mg减少到80 mg。总体人群中, 常见的3级治疗相关不良事件为皮疹(12%)、蛋白尿(12%)和手足综合征(10%)。
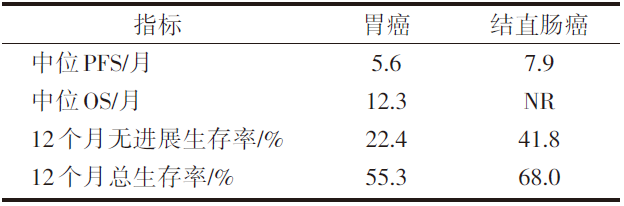
中位治疗持续时间6.1个月, 观察到客观缓解的患者有20例(40%), 其中11例为MSS GC, 8例为MSS CRC, 1例为MSI-H CRC。GC的ORR为44%(11/25), CRC的ORR为36%(9/25), 其中MSS CRC的ORR为33%(8/24)。7例既往曾接受过PD-1治疗的GC患者中有3例获得部分缓解(partial response, PR)。GC和CRC的中位PFS分别为5.6个月和7.9个月。GC的中位OS为12.3个月, CRC尚未达到OS, 见表1。对9例GC患者治疗前和治疗后的活检标本行流式细胞学检查发现, 瑞戈非尼+纳武利尤单抗治疗后获PR的患者CD45RA-FoxP3hi效应T-reg比例降低。1例HER2阴性的GC患者, 纳武利尤单抗单药治疗后疾病进展, CD45RA-FoxP3hi效应T-reg升高, 经瑞戈非尼+纳武利尤单抗治疗后该值下降。
| 表1 REGONIVO研究的疗效结果 |
瑞戈非尼80 mg联合纳武利尤单抗安全性可控, 在MSS GC和CRC患者中具有令人鼓舞的抗肿瘤活性, 这些数据需要在更大的人群中进行更多的研究。
这项由Fukuoka教授等开展的Ⅰ b期研究主要在日本研究瑞戈非尼联合纳武利尤单抗治疗晚期胃癌和结直肠癌的作用。支持这项研究的临床前数据显示, 瑞戈非尼对肿瘤相关巨噬细胞(TAM)有影响, 能够抑制巨噬细胞在肿瘤内的浸润与分化, 而且研究还显示当瑞戈非尼与纳武利尤单抗联合时, 抗肿瘤活性得到增强。本项研究总共纳入了50例患者, 剂量爬坡阶段14例, 扩展阶段纳入36例, 剂量限制性毒性发生于160 mg剂量水平, 120 mg时出现最大耐受剂量主要表现为较高的皮肤毒性发生率, 因此在队列扩展研究阶段, 瑞戈非尼剂量水平减至基础剂量80 mg。发生率超过10%的不良反应包括蛋白尿、皮疹和手足皮肤反应, 不过这些不良反应较为容易恢复。
本研究是针对瑞戈非尼联合免疫治疗晚期胃癌和结直肠癌的一项临床研究。众所周知, 免疫检查点抑制剂单药在胃癌中有效(10%~15%), 且疗效持久。然而, 在转移性结直肠癌(mCRC)中, 免疫检查点抑制剂对于绝大部分pMMR mCRC患者(95%), 无明显应答。因此, 越来越多的研究集中在探索pMMR mCRC患者免疫联合治疗, 本文我们也将重点评论REGONIVO研究在mCRC免疫治疗中的重要意义和影响。
瑞戈非尼是一种多靶点酪氨酸激酶抑制剂, 为mCRC标准三线治疗。瑞戈非尼可以直接消耗TAM, 并可通过多重机制重新编程TAM表型, TAM是肿瘤微环境(tumor microenvironment, TME)的关键组成部分, 在肿瘤的增殖与凋亡之间起着平衡的作用, 肿瘤细胞分泌炎症因子致使巨噬细胞进入TME, 进而分化为TAM, TAM受不同的微环境的影响, 可以分化为多种表型, 其中典型的有抗肿瘤的M1型和促瘤的M2型[1, 2]。TAM的M2型通过分泌血管内皮生长因子(vascular endothelial growth factor, VEGF)可促进血管生成, 以及通过表达免疫抑制配体(PD-L1a)和细胞因子(IL-10和TGFβ )抑制肿瘤免疫应答[1]。基于以上观点, 瑞戈非尼促进TAM从M2型向M1型转化, 故其与免疫检查点抑制剂联合使用时, 在结直肠癌中可能存在协同抗肿瘤的作用[3]。
瑞戈非尼联合免疫检查点抑制剂依据主要包括以下几点:首先, 瑞戈非尼可抑制血管生成, 降低血管通透性, 改善TME。其次, 瑞戈非尼可抑制集落刺激因子1受体(colony stimulating factor 1 receptor, CSF1-R), 从而抑制TAM增殖, 并将TAM重新编程为具有抗肿瘤功能的M1表型[4]。此外, 它还能抑制IFN-γ 诱导的PD-L1表达, 以及抑制其他免疫抑制剂细胞因子作用[5]。初步观察表明, 瑞戈非尼与免疫抑制剂联合应用, 在免疫调节活性方面存在协同作用[6]。这些理论基础支持了在pMMR mCRC中使用瑞戈非尼联合抗PD-1抗体治疗。REGONIVO研究结果肯定了瑞戈非尼与纳武利尤单抗二者联合治疗在pMMR mCRC中的疗效[7]。
然而, REGONIVO的研究结果并未得到其他研究的佐证。NCT03475953[7]研究显示瑞戈非尼联合avelumab治疗MSS/微卫星低度不稳定性(microsatellite instability-low, MSI-L)mCRC的ORR为0%, 中位PFS为3.5个月, 中位OS为10.8个月。REGOTORI试验[8]为国内首个PD-1单抗联合瑞戈非尼治疗难治性pMMR mCRC, 其研究结果显示ORR仅为15.2%, 也不尽人意。这两项研究结果显示似乎瑞戈非尼联合其他免疫检查点抑制剂治疗pMMR mCRC有效率难以达到REGONIVO一样好的疗效。
针对pMMR mCRC的瑞戈非尼联合不同PD-1/PD-L1单抗的临床研究疗效不一致性, 这也促使全球的研究者去探索如何更好地让pMMR mCRC患者从免疫治疗获益的策略, 包括更精细地筛选人群、尝试免疫治疗不同的组合等。①首先筛选人群:患者一般状况较好, 且肿瘤负荷较小, REGOTORI研究显示无肝转移的pMMR mCRC患者似乎从这种联合治疗中获益更大[8]。②免疫检查点抑制剂联合其他小分子酪氨酸激酶抑制剂:2020年欧洲肿瘤内科学会(European Society of Medical Oncology, ESMO)公布的LEAP-005研究[9]显示仑伐替尼联合帕博利珠单抗治疗经过三线治疗失败的非MSI-H/pMMR mCRC, 初步ORR为21.9%, 似乎也有一定前景。③免疫+免疫治疗:通过更多具有不同作用机制的免疫检查点抑制剂的协同作用能否增加疗效呢?一项Ⅱ 期临床试验报告显示, 在难治性pMMR mCRC患者中评估了抗PD-L1药物度伐单抗与CTLA-4抑制剂tremelimumab的组合, 与最佳支持治疗相比, 双免疫治疗临床获益有限, 但其亚组中肿瘤突变负荷(TMB)大于28个/mb具有最大OS获益[10]。④免疫+抗表皮生长因子受体(epithelial growth factor receptor, EGFR):西妥昔单抗(一种嵌合IgG1抗体)通过Fc区依赖性机制与效应免疫细胞相互作用, 导致形成免疫复合物并诱导抗体依赖性细胞毒性(antibody-dependent cell-mediated cytotoxity, ADCC), 这是一种针对宿主的抗肿瘤机制[11]。 此外, 西妥昔单抗可诱导自然杀伤(natural killer, NK)细胞的活化, 随后肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)之间的细胞毒性T细胞(cytotoxic T lymphocytes, CTL)/ T-reg细胞比例增加。基于以上理论基础, 目前正在开展多个关于免疫抑制剂联合西妥昔单抗的临床研究, 研究结果值得期待。CAVE mCRC是一项单臂、多中心的Ⅱ 期研究, avelumab联合西妥昔单抗RAS野生型mCRC, 其中位OS为13.1个月, 中位PFS为3.6个月, 研究初步显示avelumab联合西妥昔单抗作为再挑战策略在化疗难治性RAS野生型mCRC患者有效[12]。
总之, 约占95%的pMMR mCRC患者对免疫治疗获益十分有限, REGONIVO这项Ⅰ b期研究及其他研究提示我们应该进一步探索更多精准的生物标志物、更严格筛选合适人群以及在此基础上有针对性地进行不同组合的免疫联合治疗。此外, 我们也期待REGONIVO研究之后有更大样本量的Ⅲ 期研究来验证其早期研究结论。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|