| 邱萌,女,肿瘤学博士,四川大学华西医院腹部肿瘤科主任医师,教授,硕士生导师。主要研究方向为胃肠道肿瘤生物靶向治疗。学术任职包括中国医师学会结直肠肿瘤分会青年委员副主任委员、中国临床肿瘤学会(CSCO)理事、CSCO结直肠癌专家委员会委员及肿瘤药物安全委员会委员、中华医学会外科分会结直肠肿瘤学组委员、中国抗癌协会肿瘤靶向治疗专业委员会委员、四川肿瘤学会结直肠癌专业委员会副主任委员、四川省抗癌协会大肠癌专业委员会常务委员等。作为负责人承担国家自然科学基金、国家精准医疗项目子课题等科研项目,以第一作者或通讯作者发表SCI论文16篇。 |
文献一:André T, Shiu KK, Kim TW, et al. Pembrolizumab in microsatellite-instability-high advanced colorectal cancer[J]. N Engl J Med, 2020, 383(23):2207-2218.
文献二:André T, Shiu KK, Kim TW, et al. Pembrolizumab versus chemotherapy for microsatellite instability-high/mismatch repair deficient matastastic colorectal cancer: The phsae 3 KEYNOTE-177 study[J]. J Clin Oncol, 2020, 38(18S): Abstr LBA4.
1b。
大约5%转移性结直肠癌(metastatic colorectal cancer, mCRC)是微卫星高度不稳定性(microsatellite-instability-high, MSI-H)/错配修复功能缺陷(mismatch-repair-deficient, dMMR)类型, MSI-H /dMMR mCRC淋巴细胞浸润丰富, 免疫检查点表达强。
Ⅱ 期KEYNOTE-016研究提示程序性死亡受体1(programmed death 1, PD-1)抑制剂帕博利珠单抗(pembrolizumab)在dMMR mCRC患者中客观缓解率(objective response rate, ORR)达到40%, 而在错配修复功能完整(proficient mismatch repair, pMMR)患者中ORR为0%。PD-1抑制剂对比化疗在MSI-H/dMMR晚期或mCRC患者一线治疗的疗效仍未知。
在MSI-H/dMMR mCRC患者的一线治疗中评估帕博利珠单抗对比标准治疗(化疗± 贝伐珠单抗或西妥昔单抗)的疗效和安全性。
• 研究条件:包括美国在内23个国家的192家中心参加(NCT02563002)。
• 研究起止时间:2015-11-30至2018-5-16。
• 研究方法:国际多中心、随机、开放标签、Ⅲ 期对照临床试验。
• 研究对象:年龄≥ 18岁确诊为MSI-H/dMMR mCRC患者, ECOG PS评分0或1。按实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumor, RECIST)v1.1评估有可测量病灶, 有足够器官功能, 无活动性自身免疫性疾病或脑转移。
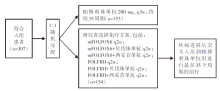
• 干预措施:入组患者按1∶ 1随机分配至帕博利珠单抗200 mg q3w, 持续两年治疗, 或化疗(以5-氟尿嘧啶为基础的方案), 包括mFOLFOX6(奥沙利铂 85 mg/m2 d1+亚叶酸钙 400 mg/m2 d1+5-氟尿嘧啶 400 mg/m2 推注d1 2 400 mg/m2 持续静脉滴注46~48 h)方案或FOLFIRI(伊立替康 180 mg/m2, d1, 亚叶酸钙 400 mg/m2 d1+5-氟尿嘧啶 400 mg/m2 推注d1 2 400 mg/m2 持续静脉滴注46~48 h)方案± 贝伐珠单抗 5 mg/kg d1, 或西妥昔单抗400 mg/m2静脉滴注2h序贯250 mg/m2, 静脉滴注1 h, q1w。所有化疗方案q2w重复, 随机前进行化疗方案选择。治疗直至疾病进展、不可耐受毒性、患者/研究者决定退出或完成35周期治疗(仅对帕博利珠单抗)。接受化疗的患者可在确认疾病进展后交叉入组到帕博利珠单抗组进行最多35个周期的治疗。研究设计见图1。
• 评价指标:主要研究终点指标为无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)。关键次要终点指标为ORR和安全性。
共入组307例结直肠癌患者, 在数据截止时, 共153例患者随机分配至帕博利珠单抗组, 154例患者随机分配至化疗联合组。帕博利珠单抗组的中位随访时间为28.4(0.2~48.3)个月; 化疗联合组的中位随访时间为27.2(0.8~46.6)个月。对于PFS, 帕博利珠单抗组的结果明显优于化疗联合组, 中位PFS分别为16.5个月和8.2个月, 风险比(hazard ratio, HR)0.60, 95%可信区间(confidence interval, CI)0.45~0.80, P=0.000 2)。帕博利珠单抗组12个月和24个月的无进展生存率分别为55.3%和48.3%, 而化疗联合组则为37.3%和18.6%, 帕博利珠单抗组和化疗联合组确认的ORR分别为43.8%和33.1%; 帕博利珠单抗组未达到中位缓解持续时间, 而化疗联合组的中位缓解持续时间为10.6个月。帕博利珠单抗组和化疗联合组的3~5级治疗相关不良事件(adverse event, AE)发生率分别为22%和66%。化疗联合组中有1例患者因治疗相关的AE死亡。
对比一线化疗, 帕博利珠单抗为MSI-H/dMMR mCRC患者带来了具有临床意义和统计意义的PFS改善, 与化疗相比, 帕博利珠单抗治疗相关AE发生率更低。
近年, 免疫治疗在众多瘤种都呈现高歌猛进的发展势态, 但在肠癌中一直举步不前。2015年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)和《N Engl J Med》首次同步报道了突破性Ⅱ 期研究KEYNOTE-016结果[1], 表明微卫星高度不稳定性(MSI-H)是免疫检查点抑制剂治疗有效的跨瘤种生物标志物, 帕博利珠单抗在MSI-H转移性肠癌(mCRC)后线治疗中单药有效率高达40%, 因此2015年也被认为是“ 肠癌免疫治疗元年” , 同年探索一线免疫治疗的KEYNOTE-177研究正式启动。
肠癌根据微卫星状态分为高度不稳定性(MSI-H)、低度不稳定性(microsatellite-instability-low, MSI-L)和稳定性(microsatellite-stability, MSS)。MSI-H约占mCRC的5%, 常见于右半结肠, 肿瘤内大量淋巴细胞浸润, 伴发BARFV600E突变多见, 常为高肿瘤突变负荷(tumor mutation burden, TMB), 对传统化疗药物, 尤其是5-氟尿嘧啶不敏感, 在联合化疗和靶向治疗时代, MSI-H mCRC疗效和预后均差于MSI-L/MSS型[2, 3]。KEYNOTE-177研究是首个在MSI-H晚期肠癌一线治疗中头对头比较单纯免疫治疗与标准化疗或联合靶向治疗的随机、对照Ⅲ 期临床研究[4], 2020年ASCO大会报道[5]结果显示帕博利珠单抗在无进展生存期(PFS)、客观有效率(ORR)和安全性方面均优于标准化疗联合靶向治疗, 奠定了PD-1单抗在MSI-H晚期肠癌一线治疗中的首选地位, 目前已被2020年NCCN指南第4版推荐[6]。这项研究带来鼓舞人心且惊艳的结果同时, 也给我们带来很多思考和期待, 该研究全文近期在《N Engl J Med》发表, 在此结合发表全文及会议报道尝试解析此重大研究带来的几点思考。
1. 自信的研究设计方案:KEYNOTE-177采用了优效性Ⅲ 期随机对照、双终点设计, 第一终点为基于盲态中央评估的PFS, 帕博利珠单抗组PFS明显优于对照组(化疗)组(16.5个月 vs. 8.2个月), α =0.000 2(双侧), 达到统计学上要求在第二次中期分析α 需达到单侧0.011 7, 优效性达成; 第二主要终点OS是否能达成已不影响该研究阳性结果, 试验方案允许化疗组出现进展后可交叉至试验组接受帕博利珠单抗或其他免疫治疗, 对照组有59%接受了后线免疫治疗, 必然缩小两组间OS差异, OS终点能否达成存在悬念, 也表明研究者对第一终点PFS非常有信心; 当然, 这样的交叉设计也形成了免疫与化疗不同治疗序贯顺序的病例队列, 为后期分析免疫治疗作为一线或二线治疗对于OS是否存在不同影响提供数据。
2. PFS生存曲线交叉现象:帕博利珠单抗组与化疗组PFS生存曲线在治疗6个月时发生交叉, 6个月后帕博利珠单抗组才显示出明显PFS获益, 且在治疗早期尤其是3个月内帕博利珠组近30%患者出现疾病进展, 帕博利珠单抗组虽ORR明显优于化疗组(48.3% vs. 33.1%), 但总体疾病控制率差于化疗组(64.7% vs. 75.3%), 分析原因可能包括:入组时MSI-H或dMMR状态是由地方实验室通过免疫组化或聚合酶链式反应(polymerase chain reaction, PCR)检测, 既往《JAMA Oncol》曾发文表明MSI状态的误判可能是免疫治疗无效的原因之一[7], KEYNOTE-177研究后期也进行了MSI状态的复核, 期待相关结果。此外, 既往He WZ等分析了dMMR肠癌的原发灶和转移灶MMR状态一致性约80%[8], 近20%转移灶转变为pMMR, 基于原发灶MSI状态的入组也可能影响疗效; 化疗与免疫治疗作用机制不同, 起效方式不同。化疗联合靶向治疗可快速杀伤肿瘤细胞, 导致肿瘤缩小和快速控制, 而免疫治疗相对起效较慢。如何减少一线免疫治疗的早期进展, 胃癌一线免疫联合化疗的KEYNOTE-062研究提供了思路, 其中MSI-H亚组化疗联合免疫治疗可获得更好的有效率[9], 因此未来化疗联合联合免疫策略在肠癌中同样值得探索和期待; 既往KEYNOTE-016[1]及CheckMate-142[10]二线队列研究结果均显示PD-1单抗单药治疗MSI-H mCRC的疗效约在30%~40%, 提示存在原发免疫耐药, 未来需要进一步细分和甄别MSI-H人群, 寻找有效生物标志物, 比如结合TMB, PD-L1表达等; 本研究采用的RECIST 1.1标准并不是免疫治疗疗效评估的最佳方法, 存在假性进展患者早期停止免疫治疗的可能, 免疫相关RECIST(immune-related RECIST, irRECIST)标准在消化道肿瘤Ⅲ 期临床研究未被常规采纳[11], 未来也需要探索一些代谢相关影像学检查如PET/CT或观察肿瘤动态变化的循环肿瘤细胞DNA(circulation tumor DNA, ctDNA)检测来早期预测免疫治疗疗效和识别假进展。
3. 基于临床和基因特征的亚组分析:KETNOTE-177亚组分析显示< 70岁, PS评分0, 左半肠癌、RAS野生型可能是免疫一线治疗的获益人群。BRAF突变则不影响MSI-H人群免疫治疗疗效, 这与既往CheckMate-142研究结果一致。高龄、PS评分不佳与疗效的关系仍存在争议, 在不同瘤种也不尽相同, 今年一篇荟萃分析显示年龄、性别和PS评分(0或大于0)并未对免疫治疗疗效和生存获益产生影响[12]。与既往临床认识不同的是, MSI-H通常以右半结肠、RAS或BRAF基因突变为主, 也被认为是免疫治疗获益人群, 未来需要累积或汇总更多研究或病例进一步分析基因分型与免疫治疗疗效的关系。
4. 免疫治疗持续获益及治疗时长问题:KEYNOTE-177研究方案帕博利珠单抗组最长治疗时间为105周(2年), 结果显示中位持续有效时间帕博利珠单抗组尚未达到, 且2年无进展生存率为48%, 较1年无进展生存率仅下降7%, 呈现明显拖尾效应。此外, 经过中位随访32.4个月, 免疫组完全缓解率高达11%, 表明存在延迟起效或完全缓解(complete response, CR)的情况。2020年ASCO公布了CheckMate-142研究更新结果[13], 显示接受纳武利尤单抗和低剂量伊匹单抗双免一线治疗的MSI-H mCRC患者中, 完全缓解率随着随访时间延长而增加, 14例中止治疗的患者中10例持续无进展, 甚至有的患者只接受几次免疫治疗可维持无进展, 表明对于免疫治疗的起效模式或判断尚缺乏有效的方法, 如果早期已达到CR或部分缓解(partial response, PR)的患者治疗时长可否缩短, 毕竟长期免疫治疗会同时带来毒性反应和经济考量的问题。
5. MSI-H mCRC化疗或联合靶向治疗疗效:KEYNOTE-177研究中对照组(研究中选择化疗)最终ORR达到33.1%, 高于既往文献报道的低于20%[14], 这有点出乎意外, 表明MSI-H并非对化疗无效, 因此如何甄别对化疗敏感的MSI-H人群也同样重要, 一线免疫治疗进展后线治疗应该换化疗还是继续免疫强化治疗是未来需要解决的问题。此外, CALGB/SWOG 80405研究后期分析显示MSI-H患者接受贝伐珠单抗疗效优于西妥昔单抗[15], 本研究中只有60%选择了贝伐单抗的方案, 甚至有17%仅用了化疗。对于BRAFV600E突变者, TRIBE研究[16]显示三药联合贝伐优于两药联合贝伐, 对于本研究中22%BRAF突变患者接受两药治疗或部分患者未加靶向治疗, 都可能不是最佳化疗方案。
6. 安全性和生活质量比较:帕博利珠单抗也获得了完胜, 3~4级毒性仅是化疗组三分之一, 免疫相关不良反应3~4级也仅有10%, 2020年欧洲肿瘤内科学会(European Society of Medicine Oncology, ESMO)大会补充报道了KEYNOTE-177研究的生活质量数据[17], 结果表明PD-1单抗组较化疗组有更好的生活质量及症状改善, 进一步支持了免疫治疗是低毒、有效、高生活质量保证的一线治疗选择。
7. 尚未披露的转化治疗数据:据会后对主要研究者的采访报道, 两组均有超过10%患者转化成功接受局部治疗。2020年《Nat Med》发表了纳武利尤单抗联合伊匹单抗作为MSI-H早期结肠癌新辅助治疗的NICHE研究[18], 病理缓解率达100%, 病理完全缓解率达60%, 因此让大家非常期待的是, KEYNOTE-177中转化成功的MSI-H晚期肠癌中最终病理缓解情况。
因此KEYNOTE-177研究的确是一项里程碑研究, 研究者的追求绝不会止步于此。既往CheckMate-142多队列研究中, 一线单臂队列显示纳武利尤单抗联合低剂量伊匹单抗双免有效率高达69%, CR达13%, 二线队列中双免与单免比较有效率更高(55% vs. 31%)[19], 与上面讨论到的免疫化疗联合策略相比, 接踵而来的问题:MSI-H mCRC一线免疫治疗的最佳方案是什么?联合方案是否优于单免?什么联合方式最好?以及在转化治疗中的价值。当然, 免疫治疗从晚期治疗向辅助、新辅助治疗的推进也必然成为探索方向, 正在进行的A021502研究就是在MSI-H/dMMR的Ⅲ 期结肠癌根治术后采用FOLFOX联合PD-L1单抗(atezolizumab)对照FOLFOX的Ⅲ 期多中心随机对照研究。此外, MSI-H在mCRC中仍是小众人群, 临床中需要提高患者的检出, 保证MSI-H患者都有接受免疫治疗的机会, 更为重要的是, 不论是在MSI-H或MSS人群, 持续探索免疫治疗有效的生物标志物仍是永恒的话题。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|