作者简介:
谭佩欣(1988-),女,广东佛山人,医师,博士研究生,从事肿瘤放射治疗研究。
目的 评估驱动基因阳性局部晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)靶向治疗序贯根治性放疗有症状放射性肺炎(radiation pneumonitis,RP)的发生率及风险因素。方法 回顾性分析2017年1月至2020年4月在广东省人民医院接受靶向治疗序贯胸部放疗的不可手术Ⅲ期NSCLC患者。采用不良反应评价标准5.0版进行RP分级,≥2级定义为有症状RP。使用Χ2检验以及Kruskal Wallis检验评估潜在的临床及剂量学危险因素。结果 13例入组患者,其中6例(46.1%)发生有症状RP。2级RP 5例,3级RP 1例。经激素治疗后所有RP均转归为肺纤维化1~2级。单因素分析结果显示年龄、慢性阻塞性肺炎病史等临床因素与≥2级RP不相关,V20、肺平均受量等剂量学因素均未见与≥2级RP相关。结论 靶向治疗序贯胸部放疗后≥2级RP的发生率较高,未发现与有症状RP相关的临床或剂量学危险因素。
Objective To evaluate the incidence and risk factors of symptomatic radiation pneumonitis(RP) in patients with driver gene positive locally advanced non-small cell lung cancer(NSCLC).Methods From January 2017 to April 2020, patients with inoperable stageⅢ NSCLC who received targeted therapy followed by sequential thoracic radiotherapy in Guangdong Provincial People's Hospital were retrospectively analyzed. Radiation pneumonitis was graded according to the common terminology criteria for adverse events 5.0. The symptomatic RP was defined as ≥ grade 2. Chi square test and nonparametric Kruskal Wallis test were used to evaluate the potential clinical and dosimetric risk factors.Results Among the 13 patients, 6 (46.1%) had symptomatic RP. There were 5 cases of ≥ grade 2 RP and 1 case of grade 3 RP. After steroid treatment, all RP were recovered and resulted in pulmonary fibrosis grade 1~2. Univariate analysis showed that age, history of chronic obstructive pneumonia and other clinical factors were not associated with ≥ grade 2 RP. Dose factors such as V20 and average lung dose were not related to ≥ grade 2 RP.Conclusion The incidence of ≥ grade 2 RP after targeted therapy followed by sequential radiotherapy is high. No clinical or dosimetric risk factors related to symptomatic RP were found.
在初诊非小细胞肺癌(non-small cell lung cancer, NSCLC)的患者中, 近1/3为不可手术的局部晚期[1]。长期以来, 不可手术局部晚期NSCLC的标准治疗为同步放化疗, 但疗效难以令人满意[2, 3]。PACIFIC临床研究结果的发表彻底改变了这部分患者的治疗模式。同步放化疗加上免疫巩固治疗成为不可手术Ⅲ 期NSCLC的标准治疗。
在肺癌的治疗中, 靶向治疗占有不可或缺的地位。对于驱动基因阳性的晚期NSCLC, 靶向药物酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)已作为一线治疗推荐使用。对于驱动基因阳性的可手术Ⅲ 期NSCLC, EMERGING[4]及ADJUVANT[5]研究证实TKI作为术前新辅助及术后辅助治疗可显著延长无进展生存期(progression-free survival, PFS)。但是对于不可手术的局部晚期患者, TKI与放化疗的联合治疗模式仍处于探索阶段。RTOG 1306 Ⅲ 期临床试验对比TKI诱导联合同步放化疗与单纯同步放化疗在不可手术的Ⅲ 期NSCLC中的疗效, 但最终因为入组缓慢而终止了试验。因此, 目前对于驱动基因阳性的局部晚期NSCLC使用TKI作为诱导治疗序贯放疗尚没有循证医学证据。这种治疗策略仅限于不能耐受化疗的患者, 并且经过多学科会诊讨论后使用。此外, TKI联合放疗的疗效以及安全性仍待证实, 其中值得注意的是TKI与放疗联合后肺毒性潜在风险增大的问题。
针对肺癌常见突变驱动基因的TKI药物, 如EGFR-TKI、ALK-TKI, 有一定的肺毒性。药物临床研究表明, EGFR-TKI相关的间质性肺炎发生率仅为0%~5.7%, 但致死率高达50%[6, 7]。吸烟史为发生EGFR-TKI相关性肺炎的显著危险因子[8]。NSCLC根治性同步放化疗或序贯化放疗后≥ 3级的急性放射性肺炎(radiation pneumonitis, RP)的发生率为4%~9%, 而≥ 2级的RP发生率高达29.8%[3, 9, 10]。与RP相关的危险因素包括同步化疗、肺部接受20Gy照射剂量的体积(V20)、肺平均接受射线的剂量(mean lung dose, MLD)等[11, 12]。目前尚未有研究报导TKI联合放疗后发生放射性肺损伤的风险因素分析。本研究将回顾性分析驱动基因阳性、不可切除的Ⅲ 期NSCLC使用TKI诱导治疗序贯胸部根治性放疗后发生RP的风险因素。
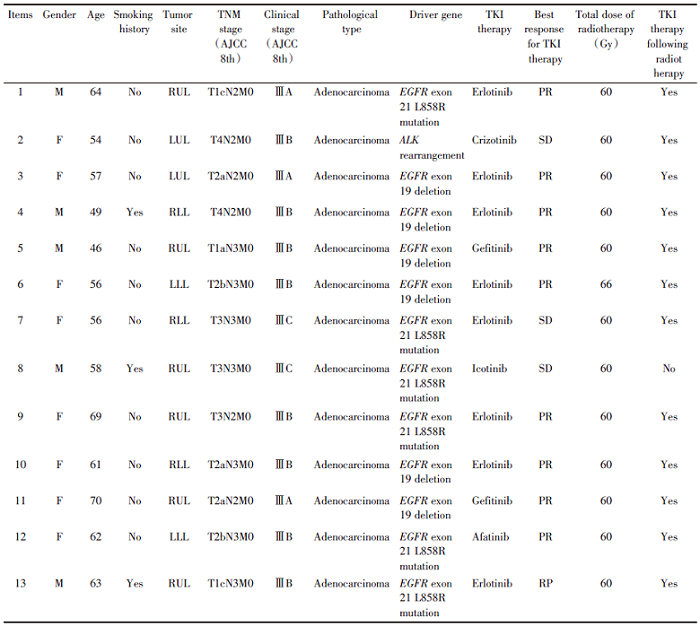
回顾性收集2017年1月至2020年4月在广东省人民医院放疗科接受了胸部根治性放疗的NSCLC患者。纳入符合以下条件的患者:(1)组织病理学基因检测证实有驱动基因突变; (2)确诊为不可切除的Ⅲ 期NSCLC(AJCC 8th); (3)在放疗前接受TKI治疗; (4)胸部放疗剂量为根治性剂量60 Gy~66 Gy。有以下因素的排除出本研究:(1)行肿瘤姑息性切除术后; (2)术后复发; (3)既往接受过胸部放疗。最终筛选出符合条件的患者共13例。详细患者临床特征见表1。
| 表1 13例行TKI诱导治疗序贯胸部根治性放疗的不可手术Ⅲ 期NSCLC患者一般临床特征 Tab.1 Clinical characteristics of 13 patients with inoperable stage Ⅲ NSCLC received TKI induction therapy followed by sequential radical thoracic radiotherapy |
所有患者都必须经过病理分子诊断, 明确有驱动基因突变, 包括EGFR 19外显子缺失、EGFR18外显子L858R突变、ALK融合等, 根据突变基因选择对应靶向药物。所有患者均经过肺癌多学科讨论, 明确为不可手术切除的Ⅲ 期NSCLC, 并且因基础疾病较多等原因不能耐受根治性同步化放疗或序贯化放疗, 最终决定行TKI诱导治疗序贯胸部根治性放疗。服用TKI过程中建议每3个月复查胸部CT进行疗效评估, 根据疗效及患者的耐受程度调整TKI治疗时间。
TKI诱导后, 肿瘤缩小至可行根治性放疗时即开始胸部放疗。所有患者均使用模拟CT定位, 热塑体膜固定, 2.5 mm层厚平扫及增强扫描, 范围从下颌扫至膈下。所有患者均采用调强放疗(intensity-modulated radiation therapy, IMRT)技术, 采用直线加速器6MV X射线实施。靶区的勾画包括大体肿瘤体积(gross target volume, GTV)、临床靶体积(clinical target volume, CTV)以及计划靶体积(planning target volume, PTV)。GTV包括TKI治疗后CT中可见的残留淋巴结以及原发灶。CTV包括TKI治疗前阳性淋巴结区域以及TKI治疗后原发灶外扩0.5 cm~0.6 cm区域。PTV为CTV外扩1.0 cm~1.5 cm, 具体根据肿瘤的大小、位置而定。PTV的处方剂量为60 Gy~66 Gy, 单次剂量分割2 Gy。正常组织的限量包括:双肺V20≤ 35%, 双肺MLD≤ 20 Gy, 食管Dmean≤ 34 Gy, 心脏Dmean≤ 20 Gy, 心脏V50< 25%。采用Eclipse 13.5治疗计划系统软件进行放疗计划设计, 根据具体情况使用多野照射或容积旋转调强照射方式。
服用TKI及放疗过程中若有不适应随时就诊并复查胸部CT, 以排除疾病进展或治疗相关性肺炎。放疗结束后建议每3个月进行胸部CT复查以评估疗效并及时发现RP。PFS定义为开始行TKI治疗至疾病进展的时间。急性RP定义为放疗结束后3个月内出现的与放疗相关的肺部急性渗出且合并有干咳、低热、气促等临床症状。急性RP的分级标准采用不良反应评级标准5.0版(common terminology criteria for adverse events, CTCAE 5.0):1级, 无症状, 仅有影像学改变; 2级, 有症状, 但不影响日常活动; 3级, 有症状, 影响日常活动或需要吸氧; 4级, 病情危重, 需要辅助通气; 5级, 死亡。≥ 2级定义为有症状的RP。肺纤维化分级标准采用CTCAE 5.0版:1级, 影像学改变不超过全肺25%体积; 2级, 影像学改变占全肺25%~50%体积; 3级, 影像学改变占全肺50%~75%体积; 4级, 影像学改变超过全肺75%体积; 5级, 死亡。
采用IBM SPSS 21.0软件对数据进行统计学处理分析, 计量资料采用均数± 标准差表示, 采用Kaplan-Meier法计算PFS, χ 2检验及非参数Kruskal Wallis检验进行临床特征及剂量学参数的危险因素分析, 显著性检验水准为0.05, P< 0.05表示差异有统计学意义。
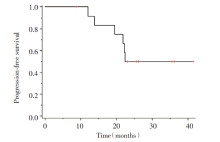
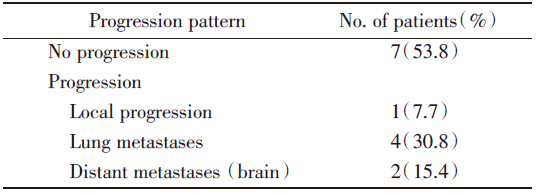
本研究13例患者接受TKI诱导治疗的平均时间为5.1± 3.1个月, 随后接受胸部根治性放疗。中位随访时间为24.5个月。6名患者出现疾病进展, 其中1名患者为原发灶增大伴肺内转移, 3名患者为肺内转移, 2名患者出现脑转移(表2)。其余7名患者未出现进展, 仍在随访期中。所有患者的中位PFS为20.7个月(图1)。
| 表2 13例NSCLC患者接受TKI治疗序贯胸部放疗后的进展模式 Tab.2 Progression pattern of 13 NSCLC patients after sequential thoracic radiotherapy following TKI therapy |
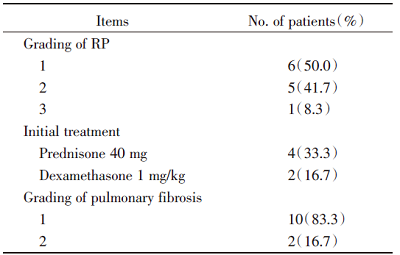
13例患者中12例(92.3%)发生了急性RP, 其中6例(46.1%)为≥ 2级的RP(5例2级, 1例3级)。对于≥ 2级RP的患者予以激素治疗, 根据病情使用口服泼尼松40 mg/日或静滴地塞米松1 mg/kg/日, 逐渐缓慢减量维持6~8周。经治疗后所有RP患者均好转, 但肺部出现了不同程度的慢性纤维化改变(表3)。
| 表3 12例急性RP的分级、治疗与转归 Tab.3 Grading, treatment and outcomes of 12 acute RP |
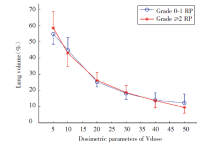
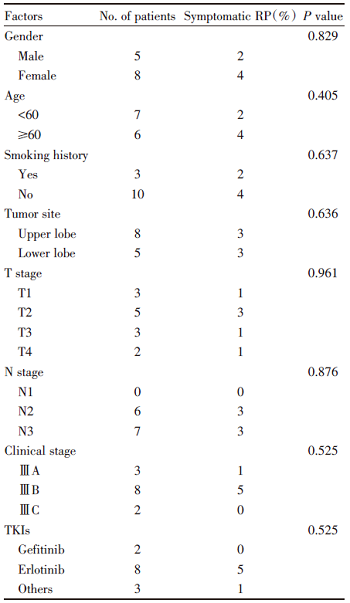
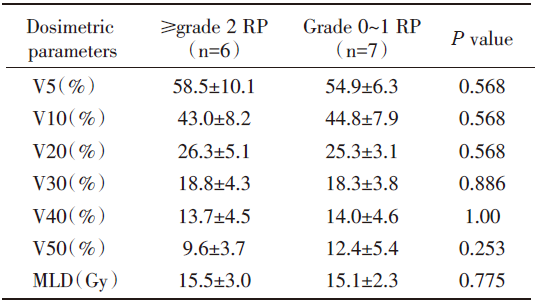
在13例患者的单因素分析中未发现与有症状RP发生相关的临床因素(表4)。患者的年龄、性别、吸烟史以及肿瘤的位置和大小均与有症状RP的发生无关。进一步分析放疗的肺部剂量学参数与有症状RP的关系, 结果提示V5、V10、V20、V30、V40、V50、MLD均与有症状RP的发生不相关(表5, 图2)。
| 表4 13例NSCLC接受TKI治疗序贯胸部放疗后有症状RP相关临床因素分析结果 Tab.4 Analysis of clinical factors related to symptomatic RP in 13 NSCLC patients after sequential thoracic radiotherapy following TKI therapy |
| 表5 13例NSCLC接受TKI治疗序贯胸部放疗后是否发生有症状RP的剂量学参数比较 (Mean± SD) Tab.5 Dosimetric parameters of symptomatic RP in 13 NSCLC patients after sequential thoracic radiotherapy following TKI |
目前暂无针对驱动基因阳性不可手术的Ⅲ 期NSCLC患者TKI诱导治疗后序贯胸部单纯放疗的临床研究, 对其安全性及有效性均未见报道。本研究回顾性分析了13例患者在此治疗模式下的初步疗效、≥ 2级RP的发生率及相关风险因素。
截止随访日期, 13例TKI序贯放疗的患者有6例出现了疾病进展, 主要复发进展模式为肺内转移(30.8%)及脑转移(15.4%), 而放疗照射区域内疾病控制良好。生存分析提示中位PFS为20.7个月, 较目前的标准治疗同步放化疗联合免疫巩固治疗的PFS(16.8个月)更长[13]。7例(53.8%)患者仍未出现进展, PFS尚未成熟, 需要更长的随访时间及总生存期(overall survival, OS)进一步证实此治疗模式的疗效。
在TKI同步放化疗或同步放疗的临床研究中发现, ≥ 2级RP的发生率为17.4%~24.1%[14, 15, 16], 与同步放化疗的发生率基本一致。而本研究中TKI序贯单纯放疗发生≥ 2级RP的几率高达46.1%, 远远高于TKI同步放疗的发生率。其中可能的原因是TKI作为诱导化疗口服时间较长, 本研究中13例患者平均口服TKI时间为5.2个月, 远远大于TKI作为放疗同步治疗的用药时间。TKI口服时间越长与放疗相互作用后潜在的肺毒性可能越大。另外, 放疗后继续口服TKI治疗也可能增加RP发生的风险。尽管有症状的RP发生率高, 但经过激素治疗后RP均明显好转, 无RP相关死亡。83.3%的患者转归为1级的肺纤维化, 对肺功能的影响较小。
在既往的研究中, 某些临床特征如高龄、慢性阻塞性肺炎病史以及肿瘤位于中下叶都被认为是发生有症状RP相关的危险因素[17], 而吸烟却是一种保护因素[18]。然而, 在本研究的单因素分析下未发现上述临床因素与有症状RP的发生相关。在剂量学参数方面, 预测RP最成熟的指标为V20。研究表明, 当V20< 22%, 2年内发生≥ 2级RP的风险为0%, 而当V20为22%~31%时, 风险升高至7%, 当V20> 40%时, 有症状RP的风险陡然上升至36%[19]。V20作为发生RP的危险因素是建立在患者接受单纯胸部放疗或放疗联合化疗的研究基础上, 对于TKI联合胸部放疗目前并未确定剂量学方面的危险因素。从本研究纳入的患者资料来看, 所有患者V20均< 35%, 而≥ 2级RP的发生率高达46.1%, 由此可见, 既往在化疗联合放疗模式下建立的预测RP发生的风险模型在TKI联合放疗的治疗中并不适用。遗憾的是, 本研究未能从V5、V10、V20、MLD等剂量学参数中发现与发生≥ 2级RP相关的风险因素。
本研究存在一定的不足。首先是样本量少, 导致统计效能低。由于目前TKI诱导序贯胸部根治性放疗在局部晚期的NSCLC中非指南推荐治疗方案, 其实施仅限于对放化疗联合治疗难以耐受的驱动基因阳性患者, 经过多学科讨论后谨慎决定, 因此样本量较少。其次本研究是回顾性研究, 不可避免地存在病例选择性偏倚以及治疗策略差异的问题。
综上所述, 驱动基因阳性不可手术的Ⅲ 期NSCLC接受TKI治疗后序贯胸部放疗≥ 2级RP的发生率较高, 但经过治疗后均恢复良好, 此治疗模式对特定人群是安全可行的。本研究未发现TKI序贯胸部放疗发生≥ 2级RP的独立风险因素。需要更大样本量的前瞻性临床研究进一步明确其相关风险因素。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|