作者简介:
牛飞玉(1986-),女,河南济源人,主治医师,医学博士,从事肺癌的综合治疗。
目的 核转录因子Y的C亚基的反义RNA 1(nuclear transcription factor Y subunit C antisense RNA 1,NFYC-AS1)可能是肺腺癌的预后标志物。然而,NFYC-AS1的具体作用机制尚不明确,该研究拟探讨NFYC-AS1在肺癌细胞系中的作用机制。方法 在H838细胞系中分别建立NFYC-AS1敲除和对照细胞株,然后进行WST-1/侵袭和转移/蛋白质印迹法(western blotting)实验,验证NFYC-AS1的功能。结果 下调NFYC-AS1后,H838细胞系的增殖、迁移和侵袭受到抑制,自噬主要蛋白P62下调,Becline上调,同时MET和c-Myc蛋白的表达下调。结论 NFYC-AS1可能在H838细胞系中经促增殖移动、抑制自噬而发挥促癌作用。
bjective The lncRNA nuclear transcription factor Y subunit C antisense RNA 1(NFYC-AS1)was a candidate prognostic biomarker in lung adenocarcinoma. However, the exact role it played in lung cancer cell lines was yet to be clarified. This study aimed to explore the mechanism of NFYC-AS1 in lung cancer cell line.Methods We established NFYC-AS1 knockdown and control cell lines, and conducted WST-1, migration/invasion assays and western blotting in order to verify the function of NFYC-AS1.Results It was found that the proliferation, migration and invasion of the H838 cells were inhibited after the knockdown of NFYC-AS1. We found that MET/c-Myc/P62 was downregulated, while Becline was upregulated by western blotting.Conclusion It indicated that NFYC-AS1 promoted proliferation and migration, but inhibited autophagy in the H838 cell line.
肺癌是世界范围内发病率和死亡率最高的癌症之一[1]。在没有靶向药的年代, 晚期肺癌的中位总生存期(overall survival, OS)仅有10~12个月, 随着越来越多的靶向药物相继应用于临床, 有驱动基因改变且接受相应靶向治疗的晚期肺癌中位OS延长到3年以上[2]。随着越来越多的靶向药应用于临床, 患者生存质量得到了很大的改善, 同时生存期也得到了明显的延长。
在各种RNA中, 长链非编码RNA(long non-coding RNA, lncRNA)是很有前景的生物标志物和治疗靶标, 因为它们在不同的肿瘤和相同肿瘤的不同发展阶段具有很强的表达特异性。lncRNA被定义为一类长度超过200个核苷酸的RNA分子, 具有低编码潜力, 并且已经显示它们在癌症生物学的各个方面发挥重要作用[3, 4]。越来越多的研究表明lncRNA在肿瘤中高度失调[5, 6, 7], 影响各种细胞过程如增殖, 细胞周期进程和凋亡, 进而参与癌症的发生和发展[8]。
通过查阅文献我们发现核转录因子Y的C亚基的反义RNA 1(nuclear transcription factor Y subunit C antisense RNA 1, NFYC-AS1)的功能、表型、动物模型等均未见报道, 仅有少量研究通过分析数据库数据, 提示NFYC-AS1可能在疾病中扮演一定的角色。比如Li等通过分析肿瘤基因组图谱(The Cancer Genome Atlas, TCGA)数据库中肺腺癌的RNA测序结果, 发现NFYC-AS1是独立的预后因子, 但作者并没有进一步在细胞系中验证该lncRNA的功能[9]。Diana等通过分析全基因组关联分析(Genome-Wide Association Study, GWAS)数据库发现, NFYC-AS1可能在不吸烟人群的气道受阻中起作用[10]。我们拟在肺腺癌H838细胞系中验证NFYC-AS1的功能。
肺腺癌细胞株H838购自ATCC公司。所有培养基均添加10%胎牛血清(Invitrogen公司)。
设计合成针对NFYC-AS1保守序列的siRNA及对照siRNA, 分别命名为si-ctrl和si-1/si-2, 将si-ctrl和si-1/si-2用Lipofectamine3000转染试剂转染入H838细胞系中, 建立NFYC-AS1敲除和对照细胞系。细胞增殖检测:细胞以每孔1 000个细胞的密度被移植到96孔板上。在24 h和48 h标记时, 将siRNA (NFYC-AS1和对照组)和转染试剂加入细胞中。转染96~120 h后, 使用WST-1试剂(罗氏, 曼海姆, 德国)按照产品说明书测量细胞增殖。所有实验都进行了三次。
使用miRNeasy Mini试剂盒(Qiagen公司)按照产品说明书, 从细胞中分离总RNA。使用高容量cDNA逆转录试剂盒(Thermo Fisher Scientific公司), 在标准条件下, 使用随机引物对总RNA进行逆转录反应。随后对相应的cDNA进行实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR), 按照说明书步骤进行。根据磷酸苷油酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GADPH)的表达对结果进行了归一化处理。PCR方案为95℃ 15 s, 60℃ 60 s, 重复40个循环。所有程序重复进行3次, 数据采用比较周期阈值(CT值)方法进行分析。
在transwell小室系统中定量分析了H838细胞的迁移和侵袭能力。上室(Costar Inc., USA)加入稀释后的ECM凝胶溶液60 μ l, 37℃孵育4小时。对于迁移实验, 上室采用相同的方法制备, 只是没有添加ECM。随后, 将细胞以1× 105个细胞的密度接种在含1%胎牛血清的100 μ l的培养基中。较低的腔室加入500 μ l含10% FBS的RPMI和DMEM中。然后将transwell小室在37℃ 5% CO2中孵育24~48 h, 以允许细胞迁移。当潜伏期结束时, 用棉签将上部腔室中剩余的细胞取出。到达膜底部的细胞用多聚甲醛固定。用结晶紫染色固定细胞, 在室温下孵化30分钟。用200 μ l的33%冰醋酸冲洗绑在细胞上的结晶紫, 在590 nm波长下检测洗脱液的吸光度, 进而确定细胞数量。
siRNA转染72 h后收集细胞, 按照参考文献规定的方法进行裂解、电泳和目标蛋白可视化。在样品缓冲液中制备总细胞裂解液, 并在95℃下煮沸5 min。样品在80 v下用SDS-聚丙烯酰胺凝胶处理3 h, 然后转移到PVDF膜上再处理3 h。然后将膜与P62、Becline、MET、c-Myc和GAPDH的特异性抗体在4℃孵育过夜。随后, 用1%的TBST洗涤3次, 用二抗孵育1 h, 用ECL显影, 并暴露在X光胶片上。
采用SPSS 17.0分析, 数据如增殖被评估的非配对的t检验。所有统计值以均数± 标准差表示。所有统计检验均在显著性水平(P< 0.05)下进行。所有的细胞生物实验都是独立的三次实验。
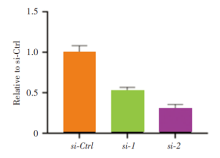
本研究前期结果提示NFYC-AS1在H838细胞系中高表达, 为验证NFYC-AS1的功能, 首先利用小RNA干扰技术在H838细胞系中建立敲除NFYC-AS1表达的细胞系和对照组, 为了避免脱靶效应, 本研究应用两条siRNA:si-1和si-2, NFYC-AS1在两组细胞系中的沉默率分别为20%和52%, 差异具有统计学差异, 见图1。
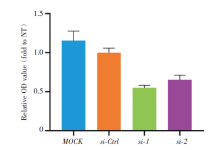
为验证NFYC-AS1对细胞增殖的影响, 研究采用WST-1方法分别检测不同NFYC-AS1表达水平的H838细胞系的增殖效率, 结果显示, si-1和si-2处理后的细胞分别有45%和35%受到抑制(图2)。采用transwell实验探讨NFYC-AS1对细胞迁移和转移的影响, 发现细胞迁移能力下降(图3), 细胞转移能力亦下降(图4)。上述细胞实验结果提示NFYC-AS1在肺癌细胞系中促进增殖移动。
NFY是一种哺乳动物转录因子, 通过与位于启动子区域的CCAAT结构域结合, 调控诸多基因的表达。NFY由三聚体组成:NF-YA、NF-YB和NF-YC[11]。NFYC-AS1是NF-YC亚基的反义转录本。反义lncRNA已被公认在转录后水平中对相应编码基因的表达起调控作用, 通过调控癌基因和抑癌基因的表达, 进而参与癌症的发生发展[12]。lncRNA参与肿瘤发生发展的研究目前已有大量报道, 比如MALAT-1[13]和HOTAIR[14]等。到目前为止, 还没有对NFYC-AS1的功能进行过分子生物学研究。我们发现, 在肺腺癌细胞系中敲除NFYC-AS1显著降低了肺腺癌细胞的增殖、侵袭和转移, 提示NFYC-AS1可能参与了肺癌细胞增殖和转移的调控。
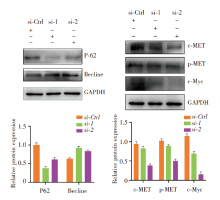
我们检测NFYC-AS1可能参与调控上述功能的下游蛋白。结果发现NFYC-AS1敲除后, 自噬主要蛋白P62下调, Becline上调。自噬是一种分解代谢过程, 受损或无用的蛋白质或其他细胞质成分通过溶酶体降解系统降解。许多研究揭示了自噬在调节各种病理过程中的作用, 包括癌症[15, 16]。在过去的几十年中, 越来越多的证据揭示了lncRNA与自噬之间的显著相关性, 表明lncRNA通过介导自噬相关基因的转录和转录后调控参与自噬调节网络[17, 18]。自噬在癌症中的作用被认为是一把双刃剑。在不同的情况下, 自噬可能会促进生存或凋亡[19, 20]。我们的结果提示NFYC-AS1可能通过抑制自噬来促进肺腺癌细胞的增殖。MET和c-Myc是主要的致癌因素。MET和c-Myc的异常表达通过增加细胞的增殖、存活、侵袭和转移来驱动肿瘤生长[21, 22, 23]。NFYC-AS1的敲除与MET和c-Myc的下调有关。提示NFYC-AS1促进肿瘤发生与MET和c-Myc相关。综上所述, NFYC-AS1在肺腺癌细胞中促进细胞增殖、侵袭和转移, 可能与其诱导自噬和下调癌蛋白(MET和c-Myc)表达有关。这些结果提示NFYC-AS1是人肺癌细胞中有功能的lncRNA。本研究为肺腺癌中针对lncRNA的治疗提供了一定的前期研究基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|