| 曹小龙,主任医师,硕士生导师,广州市番禺中心医院肿瘤中心主任,获“岭南名医”称号。兼任广东省医学会肿瘤内科学分会副主任委员、广州抗癌协会副理事长、广州市番禺区肿瘤研究所所长、广东省肺癌研究所协作中心负责人、广东省肿瘤临床重点专科学科带头人、广东省抗癌协会化疗专业委员会常务委员、广东省抗癌协会肺癌专业委员会常务委员、广东省抗癌协会肝癌专业委员会常务委员、广东省抗癌协会胰腺癌专业委员会常务委员、广东省医师协会肿瘤医师分会常务委员、广东省医师协会肿瘤内科医师分会常务委员。 主要研究方向是肺癌和消化系肿瘤的化疗、靶向治疗和免疫治疗。参与省级、国家级、亚太地区多中心临床研究10余项,主持和参与各级别科研课题立项10余项;发表论文30余篇(核心期刊16篇、SCI收录6篇)。 |
Hong DS, Fakih MG, Strickler JH, et al.KRASG12C Inhibition with sotorasib in advanced solid tumors[J]. N Engl J Med, 2020, 383(13):1207-1217.
2b。
KRAS是人类癌症中最常见的突变致癌基因, KRASG12C突变发生于13%的非小细胞肺癌(non-small cell lung cancer, NSCLC)和1%~3%的结直肠癌(colorectal cancer, CRC)及其他癌症, 但针对KRAS突变的靶向治疗方案尚未被批准。
Sotorasib是一款高选择性的、不可逆转的KRASG12C突变抑制剂。临床前试验结果发现sotorasib通过抑制下游通路因子ERK的磷酸化, 从而实现了小鼠KRASG12C突变肿瘤的持续性完全消退。
研究sotorasib在携带KRASG12C突变的晚期实体肿瘤患者中的安全性、药代动力学和疗效。
• 研究条件:全球包括美国、澳大利亚、比利时、巴西、加拿大、法国、德国、日本、韩国、瑞士共10个国家91个中心参加的临床试验(NCT03600883)。
• 研究方法:多中心、开放标签、Ⅰ 期临床试验。
• 研究时间:2018-08-27至2024-02-14(入组中)。
• 研究对象:病理诊断为具有KRASG12C突变的局部晚期或转移性恶性肿瘤的患者。入组标准为年龄为18~100岁的病理诊断为具有KRASG12C突变的局部晚期或转移性恶性肿瘤的患者。排除标准包括脑转移、入组前6个月内发生过心肌梗塞、患有胃肠道疾病致无法服用口服药物。
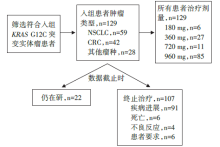
• 干预措施:符合入组条件的KRASG12C突变实体瘤患者加入剂量探索队列。剂量递增以最低剂量水平180 mg qd, 21天, 2~4例受试者开始, 如果观察到剂量限制性毒性、不可接受的副作用、受试者要求退出研究则研究结束; 若没观察到结局事件则剂量递增将持续到下一个剂量。一旦该队列的某个剂量被认为是安全的, 则可以将另外的患者纳入该队列。研究干预患者分布见图1。
• 评价指标:主要终点指标为安全性, 包括剂量限制性毒性事件的发生率, 治疗期间不良事件发生情况。次要终点指标包括:药代动力学、客观缓解率(objective response rate, ORR)、疾病缓解时间(duration of response, DoR)、无进展生存期(progression-free survival, PFS)等。
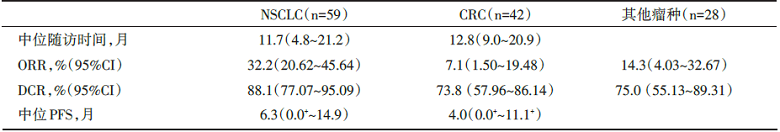
共入组携带KRASG12C突变的晚期实体肿瘤患者129例。安全性上, 未观察到剂量限制性毒性事件或治疗相关性死亡。有73例(56.6%)患者发生治疗相关性不良事件, 其中15例(11.6%)为3或4级事件。安全性可耐受。不良事件总结见表1。Sotorasib在NSCLC中的PFS为6.3个月, ORR为32.2%; CRC的PFS为4.9个月, ORR为7.1%, 患者生存获益, 具体疗效指标见表2。
| 表1 不良事件总结 |
| 表2 Sotorasib在不同肿瘤中的疗效 |
Sotorasib在初治携带KRASG12C突变的晚期实体瘤患者中显示出令人鼓舞的抗肿瘤作用。
大约30%的恶性肿瘤患者存在KRAS基因突变, 尤其常见于肺、胰腺、结肠直肠癌和胆管癌[1]。KRAS基因在过去三、四十年中一直是药物靶向研发的努力方向之一。这些研究工作包括靶向KRAS蛋白本身, 以及其翻译后修饰、膜定位、蛋白-蛋白相互作用和下游信号通路, 但是这些策略大多数都失败了, 在此之前没有一种专门针对KRAS基因的药物被批准应用, 因此KRAS基因一直是肿瘤领域“ 不可成药” 靶点的代名词。然而, 对于KRAS p.G12C突变来说, 曙光即将出现。
这项发表在《N Engl J Med》的Ⅰ 期临床研究探索了sotorasib对于KRASp.G12C突变晚期NSCLC、CRC及其它实体瘤的安全性、药代动力学及疗效。研究结果表明sotorasib安全性良好, 而且对于NSCLC和CRC的疗效优于历史数据[2]。但是, 这项研究显示出来的一些数据还是值得我们注意的。首先, 众所周知, 亚洲人群中NSCLC发生EGFR突变的频率高于欧美人群, 因此KRAS突变的亚洲人群可能会更多合并EGFR突变。目前已经知道EGFR突变合并KRAS突变会由于下游Raf-MEK-ERK信号通路激活而导致EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)较早耐药[3], 但是KRAS突变合并EGFR突变是否影响sotorasib的疗效并不清楚。由于该项研究中入组的人群绝大部分是欧美人群, 亚洲人群只占整体人群的12.4%, 因此, 将该研究的结果应用于亚洲人群时需谨慎看待。其次, sotorasib在不同瘤种间的疗效相差较大, 客观有效率在NSCLC为32.2%, 结直肠癌为7.1%, 其它肿瘤为14.3%。目前尚不清楚这种疗效的差异是由于KRAS p.G12C突变在不同瘤种间对肿瘤生长的驱动性不同, 亦或是由于sotorasib的疗效数据变异较大所致, 因此还需要更多临床研究纳入更多人群和瘤种来证实sotorasib的疗效, 尤其对于NSCLC之外的KRAS p.G12C突变实体瘤患者在临床研究以外尝试应用sotorasib进行治疗时更应当了解这一点。最后, sotorasib治疗的患者没有一例取得完全缓解, 即使部分缓解的患者的缓解深度大部分都只有30%~50%, 这种现象在NSCLC靶向治疗时代是不多见的。为什么sotorasib不能持久响应?2020年1月《Nature》的一篇文章对这个问题进行了研究[4]。该研究结果认为, 关键在于KRAS生理功能的发挥存在激活和失活两种状态的循环, 而KRAS抑制剂只是作用于失活状态, 阻止KRAS ON-OFF的循环发生, 文章通过单细胞水平研究发现, 当KRAS抑制剂作用肿瘤细胞后, 因为KRAS功能被抑制而进入“ 静息” 状态, 但会有部分肿瘤细胞可以重新恢复增殖活性, 这是因为肿瘤细胞可以新合成KRAS G12C蛋白, 新合成的蛋白保留了它的激活状态, 因而KRAS抑制剂并不能发挥功能, 从而挽救了肿瘤细胞内的EGFR-KRAS G12C-MAPK通路。也就是说由于KRAS抑制剂本身功能上的局限性, 肿瘤细胞通过不断合成新的KRAS G12C蛋白来抵抗药物的作用, 所以导致患者响应深度不够。基于这些研究结果, 未来提高sotorasib疗效的关键可能还是联合治疗, 包括但不限于联合化疗、EGFR-TKI、PD-1/PD-L1抑制剂等等治疗。
当然, 总的来说, sotorasib作为KRAS p.G12C抑制剂能进入临床无疑是一大进步, 但仍需大量工作来阐明相关的分子机制, 以便更好地确定哪些肿瘤对其最敏感, 以及如何联合。此外, G12C只是KRAS众多突变位点之一, 目前仍缺乏针对其他突变的治疗策略, 这也是未来需要继续研究探索的方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|