| 吴荻,医学博士,主任医师、教授,吉林大学白求恩第一医院肿瘤中心肿瘤综合治疗区主任。兼任中国临床肿瘤学会(CSCO)理事、CSCO黑色素瘤专家委员会副主任委员、CSCO小细胞肺癌专家委员会委员、CSCO骨与软组织肉瘤专家委员会委员、CSCO肿瘤心脏病学专家委员会常务委员,中国抗癌协会肿瘤转移专业委员会委员、中国抗癌协会流行病与病因学专业委员会青年委员、中国抗癌协会肉瘤专业委员会常务委员(化放疗学组副组长),中国医药生物技术协会组织生物样本库分会委员,中国医药教育协会骨与软组织专家委员会常务委员,亚洲黑色素瘤联盟委员,吉林省生命关怀协会黑色素瘤专业委员会主任委员,吉林省肿瘤防治专家委员会专家委员,评为吉林省卫生系统拔尖创新人才。 主要从事肺癌、黑色素瘤、骨与软组织肉瘤的临床及转化研究,抗肿瘤药物的作用机制研究。 |
Drilon A, Oxnard GR, Tan DSW, et al. Efficacy of selpercatinib in RET fusion-positive non-small-cell lung cancer[J]. N Engl J Med, 2020, 383(9):813-824.
2b。
RET融合阳性存在于1%~2%的非小细胞肺癌(non-small-cell lung cancer, NSCLC)患者中, 其主要依赖于RET激酶的激活来维持肿瘤的增殖和存活。有研究显示多靶点激酶抑制剂对RET融合阳性患者仅存在有限的临床获益且常因毒副作用导致药物减量甚至停药。
Selpercatinib(塞尔帕替尼, 又名LOXO-292)是一种高选择性RET激酶小分子抑制剂, 在RET融合阳性的NSCLC中, 高选择性RET抑制剂的疗效和安全性尚不清楚。
研究selpercatinib治疗RET融合阳性NSCLC的疗效和安全性。
• 研究条件:来自12个国家65个中心参加的LIBRETTO-001临床试验(NCT03157128)。
• 研究方法:多中心、开放标签、单臂试验、Ⅰ /Ⅱ 期临床研究。
• 研究时间:2017年5月至2019年6月。
• 研究对象:既往接受过含铂化疗或初治的局部晚期NSCLC患者, 无症状或至少2周稳定状态的脑转移、年龄≥ 12岁、ECOG评分0~2分、校正QT间期≤ 470秒、重要器官功能正常、经过二代测序(next generation sequencing, NGS)或原位杂交技术(fluorescence in situ hybridization, FISH)或聚合酶链式反应(polymerase chain reaction, PCR)验证的RET融合阳性。
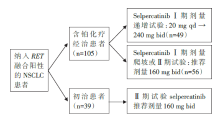
• 干预措施:符合入组标准的患者按图1流程进行临床试验。
• 评价指标:主要研究终点是由独立影像学专家评审委员会根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1版评价的客观缓解率(objective response rate, ORR), 次要终点指标包括颅内客观缓解率(intracranial ORR, iORR)、无进展生存期(progression-free survival, PFS)、缓解持续时间(duration of response, DoR)和安全性。
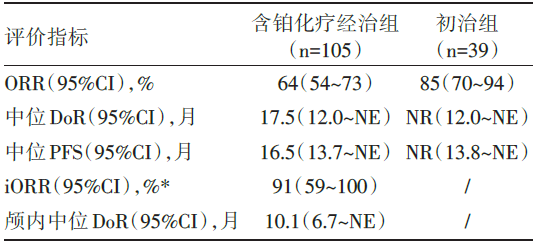
在105例RET融合阳性NSCLC患者含铂经治组中, ORR为64%[95%可信区间(confidence interval)54~73], 中位DoR为17.5个月, 中位随访12.1个月时有63%仍在缓解中; 而39例初治患者中, ORR为85%(95%CI 70~94)。在11例有可测量病灶的脑转移患者中, iORR为91%(95%CI 59~100)。研究的主要疗效指标见表1。
| 表1 LIBRETTO-001研究的主要疗效指标 |
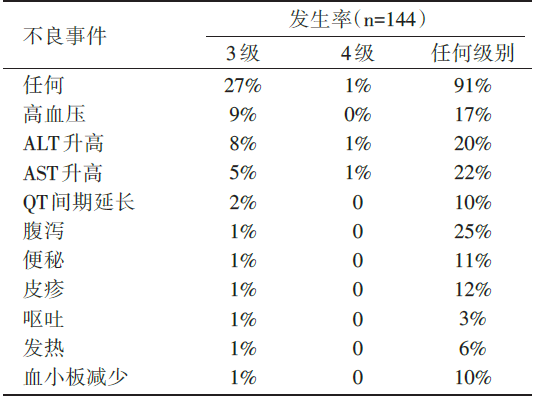
3级或以上最常见不良事件为高血压、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)升高、低钠血症及淋巴细胞减少。约2%(12/531)患者因药物相关不良事件停止使用selpercatinib。具体研究不良事件见表2。
| 表2 LIBRETTO-001研究不良事件概览 |
Selpercatinib在含铂化疗经治和初治RET融合阳性NSCLC患者中具有持久的疗效, 且具有一定的颅内抗肿瘤活性和较低的毒副作用。
2020年5月8日selpercatinib被美国食品药品监督管理局(Food and Drug Administration, FDA)批准用于治疗转染重排(rearranged during transfection, RET)融合基因阳性非小细胞肺癌(non-small cell lung cancer, NSCLC), 其加速获批基于LIBRETTO-001研究中观察到的显著临床获益, 随后《N Engl J Med》发表了LIBRETTO-001研究最新的临床数据。
LIBRETTO-001是一项多中心、开放标签、多队列的Ⅰ /Ⅱ 期临床研究, 评论文献主要介绍RET融合基因阳性NSCLC队列的有效性和安全性数据。该研究入组105例经治RET融合阳性晚期NSCLC患者, 其中49例患者纳入Ⅰ 期剂量爬坡试验, 接受20mg qd至240mg bid的selpercatinib治疗, 56例患者纳入Ⅱ 期临床试验接受160mg bid的推荐剂量治疗。此外, 39例初治患者纳入Ⅱ 期临床试验接受推荐剂量治疗。研究的主要终点指标是客观缓解率(objective response rate, ORR), 次要终点指标是无进展生存期(progression free survival, PFS), 缓解持续时间(duration of response, DoR), 颅内ORR和安全性。105例经治患者既往均接受含铂化疗, 55%曾接受免疫治疗, 48%曾接受具有抗RET活性的多靶点激酶抑制剂(multikinase inhibitors, MKI)治疗, 该部分患者ORR为64%, 中位DoR为17.5个月, 中位PFS为16.5个月。11例患者在入组时具有可评估的中枢神经系统转移病灶, 其颅内ORR为91%。39例初治NSCLC患者的ORR为85%, 中位随访7.4个月时对应的DoR和9.2个月时对应PFS均未达到。安全性方面, 治疗相关不良事件(treatment-related adverse events, TRAE)发生率为91%, 其中大多数为1~2级, 3/4级TRAE发生率为28%, 无治疗相关死亡发生。常见的3/4级TRAE包括:高血压(9%)、谷丙转氨酶升高(9%)、谷草转氨酶升高(5%)及QT间期延长(2%)。本世纪初, 表皮生长因子受体(epidermal growth factor receptor, EGFR)基因突变的发现和酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)的成功应用揭开了肺癌分子靶向治疗的序幕。随着研究的深入, 多种驱动基因突变陆续被发现, 包括间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)、c-ros原癌基因1酪氨酸激酶(c-ros oncogene 1 receptor tyrosine kinase, ROS1)等, 针对这些分子靶点的靶向治疗药物也逐渐进入临床, 表现出起效迅速、缓解率高、耐受性良好等特点, 显著改善了患者预后。2012年RET基因融合在NSCLC患者中被发现, 发生率约1%~2%[1]。多种覆盖RET融合基因的MKI被用于该突变靶向治疗的早期探索, 包括cabozantinib, lenvatinib和vandetanib等。一项全球注册登记研究[2]回顾了多种MKI治疗晚期RET阳性NSCLC的效果, ORR在18%~37%之间, 中位PFS和OS分别为2.3个月和6.8个月, 劣于靶向治疗在EGFR/ALK/ROS1阳性NSCLC患者中的获益, 并在多个Ⅱ 期临床研究中观察到类似的结果。由于这些药物不是针对RET驱动基因研发的TKI, 其对RET融合的抑制作用有限, 并且靶向血管内皮生长因子(vascular endothelial growth factor, VEGF)和EGFR信号通路, 导致大量治疗相关的毒性发生。综上在晚期NSCLC中, MKI可能不是抑制RET融合基因的最佳策略, 新型高选择性RET抑制剂selpercatinib应运而生。同时, 基于Ⅰ /Ⅱ 期ARROW临床试验结果, 第二款高选择性RET抑制剂pralsetinib也于2020年9月4日获得FDA批准用于治疗RET融合阳性的转移性NSCLC患者。
在selpercatinib获得批准之前, 没有针对RET驱动基因阳性NSCLC患者的特异性治疗, 该部分患者的一线系统治疗选择与驱动基因阴性NSCLC患者一致, 如化疗和/或程序性死亡(配体)1[programmed death-(ligand)1, PD-(L)1]单抗。注册登记研究[2]显示接受含铂一线化疗的84例RET阳性NSCLC患者, ORR为51%, 中位PFS和OS分别为7.8个月和24.8个月, 可见化疗在该群体中疗效显著。Selpercatinib一线治疗与常规化疗相比, ORR以及中位PFS均有显著改善, 但《J Clin Oncol》上的一篇研究[3]显示ORR和OS之间, PFS和OS之间的相关性较低, 决定系数r2分别为0.09和0.08, 故中位OS最终是否存在优势尚未可知。另一方面, 免疫检查点抑制剂(immune checkpoint inhibitor, ICI)在RET阳性NSCLC患者中的数据并不理想。在一项回顾性研究[4]中, 16例RET阳性患者在二线或三线接受ICI单药治疗, ORR为6%, 中位PFS只有2.1个月。另一项回顾性研究[5]纳入74例RET阳性患者, 14例患者接受了ICI治疗(中位治疗线数为2), ORR为0%, 中位PFS为3.4个月, 接受或未接受ICI治疗的患者OS没有差异。这些数据表明, RET阳性NSCLC接受免疫单药治疗疗效有限, 化疗联合免疫治疗的获益有待进一步探索。LIBRETTO-431是一项开放标签、随机对照的Ⅲ 期临床试验, 对比培美曲塞+顺铂/卡铂± 帕博丽珠单抗和selpercatinib单药一线治疗晚期RET融合基因阳性NSCLC, 初步的研究结果预计于2023年公布。
随着更有效的选择性RET抑制剂使用, 耐药性的产生往往不可避免, 必将限制其治疗效果。RET溶剂前沿突变, MET或KRAS扩增是目前发现的获得性耐药机制, 然而大部分患者的耐药机制仍不清楚, 亟待进一步研究[6]。未来可以考虑开发针对RET耐药突变的二代RET抑制剂, 另外与MET抑制剂的联合用药也有希望在一部分耐药患者中获益。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|